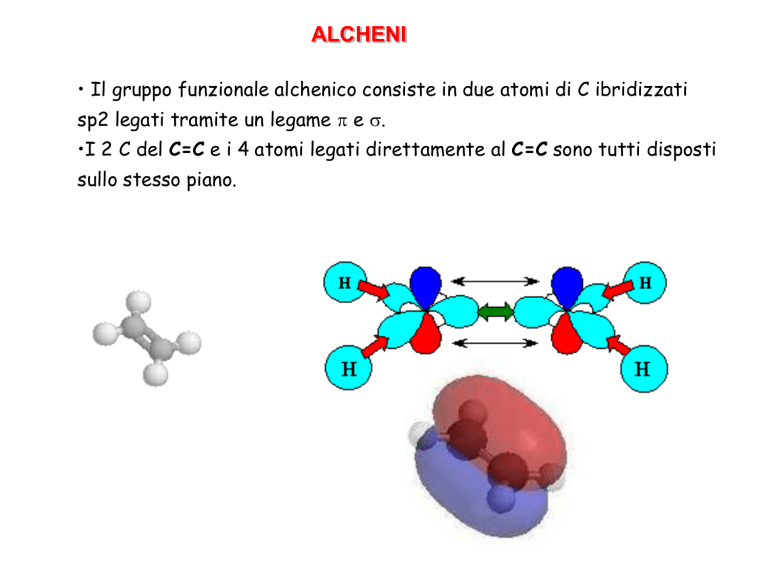
ALCHENI
• Il gruppo funzionale alchenico consiste in due atomi di C ibridizzati
sp2 legati tramite un legame p e s.
•I 2 C del C=C e i 4 atomi legati direttamente al C=C sono tutti disposti
sullo stesso piano.
ALCHENI
Stabilità:
ci sono 3 fattori che influenzano la stabilità degli alcheni:
1. Grado di sostituzione: più sono alchilati gli alcheni maggiore è la loro
stabilità, quindi tetra > tri > di > mono-sostituiti.
2. Stereochimica: trans > cis , a causa della ridotta interazione sterica dei
gruppi R disposti ai lati opposti del doppio legame.
3. Gli alcheni coniugati sono più stabili degli alcheni isolati.
Reattività
• un legame p è una regione ad alta densità (rosso) di
elettroni, quindi gli alcheni si comportano da nucleofili
• gli alcheni danno reazioni di addizione che convertono
il legame p in due nuovi legami s.
R1
R3
C
R2
C
R4
R1
A B
R3
R2 C
C R
4
A
B
La molecola A-B è addizionata
per intero al composto insaturo
Queste reazioni si chiamano reazioni di addizione
ADDIZIONE ELETTROFILA (con acidi alogenidrici)
Fasi principali del meccanismo di reazione
H
xy H
s
H
H
H+
+
H
xy
s
H
H
H
H
H
-
Cl
Formazione del
prodotto
xy H
H
s
H
p
Formazione di un
carbocatione e attacco
della particella nucleofila
H
Generazione della particella
elettrofila e attacco al
doppietto di e- p
Cl
ADDIZIONE ELETTROFILA AL DOPPIO LEGAME
Addizione elettrofila ad un alchene asimmetrico
Regola di Markovnikov (empirica):
“quando un alchene asimmetrico reagisce con un acido alogenidrico
per formare un alogenuro alchilico, l’idrogeno si addiziona al
carbonio dell’alchene che è legato al maggior numero di atomi di
idrogeno e l’alogeno al carbonio che è legato al minor numero di
atomi di idrogeno”
STABILITA’
I gruppi alchilici sono elettron donatori e quindi per effetto
induttivo tendono a stabilizzare la carica positiva del
carbocatione.
Orbitale p (non ibrido)
vuoto
Poiché i carbocationi hanno un ottetto incompleto si
comportano da eccellenti elettrofili e reagiscono
rapidamente con nucleofili. Alternativamente possono
perdere un H+ e generare un legame p.
ADDIZIONE ELETTROFILA (con alogeno)
IONE BROMONIO
MECCANISMO
ADDIZIONE ELETTROFILA (con alogeno)
IDRATAZIONE AL DOPPIO LEGAME
(catalisi acida)
N.B. questa razione è resa possibile in
presenza di un acido forte, perché la base
coniugata che si forma essendo molto debole
sarà anche un nucleofilo scadente (ad es.
SO4--). Questo permette all’H2O di
competere
con
successo
nell’attacco
nucleofilo.
IDRATAZIONE AL DOPPIO LEGAME
(catalisi acida)
H H
H C
H
+
+ H
C
H
carbocatione secondario
CH3
Si ottiene
2-cloropropano
in quanto nella prima
tappa si forma
preferenzialmente il
carbocatione secondario.
H H
H C C CH3 + Cl+
H
+
H
H
C
C CH3
H H
H C C CH3
+
H
carbocatione primario
H H
H C C CH3
H Cl
IDROGENAZIONE AL DOPPIO LEGAME
(catalisi eterogenea)
H C C CH3
H
H
H+
C C
H
CH3
C
C
+
H
+
H
CH3
C
CH3
H
O H
C
OH2
+
enolo protonato
H
H
C
CH3
H
OH2
H
C
H
H
+
CH3
C C
H
O H
CH3
C
+ H+
C
O H
enolo
H3C
CH3
C
O
propanone
H
H C C
Br
CH3
H
C
Br
C
Br
Br
C C
Br
Br
CH3
Br
Br
H
Br
Br
CH3
Br
C
C
CH3
Br
Meccanismo di polimerizzazione “ionica” degli alcheni
Nu- (nucleofilo scadente)
H+
H
H
H
C
H
H
H
C
C+
H
H
H
C+
H
H
H H
H
H
H
H
C
H
H
C
C
H
H
C
C
C
C
H
C
H
H
+
H
H
H
H H
H
H
C
H
C
C
H
C
H
H
H
+
H
H
C
C
H
H
Polietilene
H
C
H
H
C
R
Polietilene (PE)
Polipropilene (PP)
Polivinil
chloruro (PVC)
Polistirene (PS)
Molecole con più di un doppio legame
•I sistemi con più di un C=C sono definiti “polieni”.
•I più semplici polieni sono quelli in cui ci sono 2 doppi legami, i “dieni".
•La posizione relativa dei doppi legami determinano le caratteristiche di reattività
del sistema.
•Sono possibili tre differenti configurazioni.
Cumuleni
Dieni isolati
Dieni coniugati
C
C
C
Tutti e 4 i carboni
sono ibridati sp2
C
Tutti gli atomi nel diene coniugato giacciono sullo stesso piano
Coniugazione
Il termine coniugazione deriva dal latino“mettere insieme". In chimica
organica è un termine usato per descrivere sistemi in cui elettroni p
“legati insiemie.
•Un sistema a elettroni p è detto isolato quando esiste solo tra una
coppia di atomi adiacenti (es. C=C)
•Un sistema ad elettroni p è detto coniugato quando si estende su una
serie più lunga di atomi
(es. C=C-C=C or C=C-C=O etc.).
•Un sistema ad elettroni p coniugato si traduce in una estensione della
reattività chimica.
•Un sistema coniugato richiede che ci sia un allineamento di orbitali p,
tali da produrre una sovrapposizione di legami p sull’intera molecola.
•Se una posizione nella catena non è dotata di legami p, o la geometria
della molecola previene il corretto allineamento, la coniugazione è
interrotta e quindi persa in quel punto.
ADDIZIONE ELETTROFILA
AI DIENI CONIUGATI
1
H
1
H2C
C
2
H Br
HC
3
C
CH2
4
CH2
C
2
C
H
H
addizione 1,2
H
H -- Br
1
H
Br
C
CH2
H2C
C
H
H
4
addizione 1,4
Acido bromidrico
1,3 butadiene
Distribuzione
del potenziale
elettrostatico
HBr
Br -
H+
Attacco
elettrofilo
+
carbocatione secondario
+
carbocatione allilico
+
Br-
+
Equilibrio di risonanza:
spostamento di un doppietto di
elettroni dalla posizione 1-2 a
quella 2-3, spostamento della
carica positiva dal C3 al C1.
Differenti prodotti di reazione a seconda di quale sia il
carbocatione “attaccato” dal nucleofilo.
Reazioni a controllo cinetico e termodinamico
Reazione
cineticamente
favorita
G
Reazione
termodinamicamente
favorita
Poliisoprene
I TERPENI SONO POLIMERI NATURALI DELL’ISOPRENE