Tema – Valutazione tra pari
Traccia :
Illustare le reazioni di addizione al
doppio legame negli alcheni
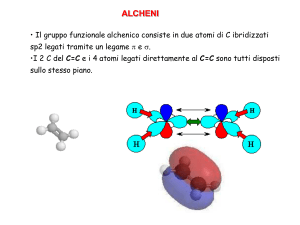
La reazione più caratteristica degli alcheni è l’addizione al doppio legame carboniocarbonio.
Le reazioni di addizione sono trasformazioni in cui due molecole si combinano per produrne
una sola, senza eliminazione di altre specie chimiche. Queste reazioni sono tipiche degli atomi
di carbonio legati tra loro da legami multipli, poiché la relativa fragilità del legame π
,rompendosi,mette a disposizione due elettroni p. Ne segue che il gruppo avente carica
positiva, povero di elettroni, attacca per primo il substrato nella zona del legame multiplo
rompendo il legame π e formando due legami σ con due nuovi atomi o gruppi di atomi. La
specie che si addiziona è una molecola elettrofila (acido di Lewis) mentre i reagenti nucleofili
(base di Lewis)sono in genere idrocarburi insaturi.
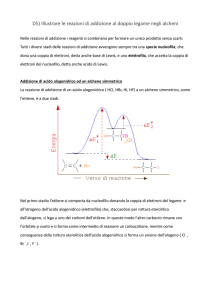
Questa reazione avviene in 2 stadi fondamentali. Nel primo stadio l'elettrofilo attacca il
legame π, comportando la formazione di un intermedio detto CARBOCATIONE che assume
una carica positiva. Questo primo stadio avviene lentamente. Successivamente nel secondo
stadio, il carbocatione essendo un intermediario instabile si combina velocemente con la
specie nucleofila per ottenere maggiore stabilità.
Le addizioni elettrofile degli alcheni sono reazoni spontanee,in esse,sia la scissione del legame
π,sia quella del reagente sono di tipo eterolitico, e possono assumere orientazioni diverse nello
spazio poiché sia i reagenti che gli alcheni possono essere simmetrici o asimmetrici .
Nell’addizione spontanea di un composto eteronucleare contenente idrogeno (H – X) ,seguendo
la regola di Markovnikov,l’ atomo di idrogeno si lega all’atomo di carbonio di per sé più ricco di
idrogeno ; ovvero il gruppo nucleofilo negativo si lega al carbonio più sostituito. Quindi il
reagente asimmetrico addizionandosi ad una alchene asimmetrico,attacca la sua parte
elettropositiva all'atomo di carbonio del doppio legame che è legato al maggior numero di
atomi di idrogeno.
In particolari condizione,per esempio in presenza di luce ultravioletta (U.V.) oppure in
presenza di perossidi,il gruppo –ene può,addizzionare anche radicali liberi,dando luogo a
reazioni di addizione radicalica. In quest’ultima la scissione del legame π è di tipo omolitico.
Pertanto in presenza di un perossido come ad esempio il perossido di iddrogeno (H2O2),oppure
in luce ultravioletta ,l’orientamento dell’addizione si inverte (addizione ANTI-Markovnikov).
L’addizione elettrofila avviene in due stadi,a seguito della scissione eterolitica dei legami,con
la formazione di un carbocatione intermedio (elettrofilo) che faciliterebbe ,im
seguito,l’aggancio del reagente nucleofilo.
Nel primo stadio l'elettrofilo attacca il doppio legame, perché gli elettroni π del doppio legame
formano un legame più debole di quelli σ. Il doppio legame si comporta come una fonte di
elettroni nei confronti dei reattivi in cerca di elettroni. L'attacco da parte dell'elettrofilo porta
alla formazione di un intermedio carico positivamente: il carbocatione.
Il secondo stadio consiste nella combinazione fra il carbocatione e la specie nucleofila, si
svolge più velocemente poiché il carbocatione è molto instabile .
Si forma in prevalenza il prodotto chimicamente più stabile , quello cioè a minor contenuto di
energia.
Ci sono vari tipi di reazioni di addizione del gruppo –ene possibili.
-Addizione di acqua ( IDRATAZIONE)
In presenza di un catalizzatore acido, l’acqua si addiziona al doppio legame carboniocarbonio di un alchene per formare un alcool (ROH). Questa reazione è chiamata
idratazione. Anche quest’ultima segue la regola di Markovnikov.
H+ è l'elettrofilo, e OH- è il nucleofilo.
-
Addizione bromo
Il bromo reagiscono con gli alcheni a temperatura ambiente addizionando atomi di
alogeno ai due carboni del doppio legame e formando due nuovi legami carbonioalogeno. l 1° stadio gli elettroni π del doppio legame C-C reagiscono col bromo formando
uno ione bromonio. Nel 2° stadio lo ione bromuro attacca il carbonio dal lato opposto del
bromo positivo.