La chimica organica si occupa dello studio
della struttura, delle proprietà e delle
reazioni dei composti del carbonio.
Proteine, zuccheri, lipidi,
DNA………..
farmaci
Carta, fibre, plastica
s2p2
C
1s22s22p2
Z=6
2p
STATO FONDAMENTALE
energia
2s
1s
2p
energia
2s
STATO ECCITATO
• Il
carbonio può formare 4 legami
covalenti perché nel suo stato eccitato
presenta quattro orbitali semioccupati .
•Si
lega con altri atomi di carbonio o con
atomi come H, O, N
• Forma legami semplici, doppi o tripli
PERCHE’ IL CARBONIO?
L’atomo di carbonio, diversamente da tutti gli altri atomi, ha
la possibilità di formare legami covalenti con un gran
numero di elementi e può inoltre formare legami con
altri atomi di carbonio generando catene di varia
lunghezza, lineari o ramificate, aperte o chiuse su se
stesse.
I composti organici sono classificati in classi diverse ognuna
sono caratterizzate dalla presenza di un gruppo funzionale,
ossia un atomo o un insieme di atomi che conferiscono la
reattività al composto.
Meccanismi di reazione
I meccanismi di reazione rappresentano la
descrizione dei possibili eventi che avvengono a
livello molecolare quando i reagenti si trasformano in
prodotti.
Ogni meccanismo è proposto sulla base di studi di
cinetica delle reazioni, di analisi spettroscopiche e di
identificazione degli intermedi di reazione.
Ogni meccanismo proposto deve essere consistente
con tutte le osservazioni sperimentali relative alla
reazione chimica in esame.
Reazioni di chimica organica sono classificabili in quattro
categorie
Sostituzioni
Addizioni
Eliminazioni
Riarrangiamenti
Due meccanismi fondamentali di rottura di legami covalenti.
Omo-Lisi
A
B
A
B
A + B
radicali
La rottura omolitica di un legame covalente (generalmente
per irradiazione o surriscaldamento) genera radicali specie
chimiche molto labili caratterizzate dalla presenza di un
elettrone spaiato
…..rottura di legami covalenti
Etero-Lisi
d+
A
dB
A
B
+
A+
B
ioni
L’eterolisi coinvolge legami polarizzati. Comporta la
separazione di cariche opposte e la formazione di ioni
CARBOCATIONI
d+
C
X
d-
C+ +
X
-
Ioni con carica netta positiva, mancano di una coppia di
elettroni
Hanno carattere ELETTROFILO
cercano elettroni per
completare l’ottetto
CARBOANIONI
d-
C
X
d+
C
-
+
X
+
Ioni con carica netta negativa, hanno una coppia di
elettroni solitaria
Donano una coppia
Hanno carattere NUCLEOFILO
elettroni
REAGENTE ELETTROFILO
Atomo o gruppo di atomi poveri di elettroni
caratterizzati da una carica positiva netta o parziale
Sono attratti da molecole (o parti di esse) con alta
densità elettronica
Sono acidi di Lewis, specie che presentano un orbitale
vuoto e possono accettare doppietti elettronici
E+
E
H+ , Cl+, Br+ NH4+, RNH3+
REAGENTE NUCLEOFILO
Atomo o gruppo con una coppia di elettroni disponibile
caratterizzati da carica netta o parziale negativa
Sono attratti da molecole (o parti di esse) con bassa
densità elettronica
Sono basi di Lewis, cioè le specie con doppietti
elettronici disponibili
Nu Cl HO CN -
Nu
O-H
H
NH3
R-NH2
REAZIONE DI SOSTITUZIONE
esempio
a)
CH4 + X
luce
CH3X + H
Reazione sostituzione radicalica
ALOGENAZIONE DEGLI ALCANI
CH4 + X2
luce
o calore
CH3X + HX
Reazione di sostituzione di un atomo di idrogeno con un
alogeno
Scissione omolitica del legame con formazione di
radicali liberi instabili e quindi molto reattivi
Reazione a catena
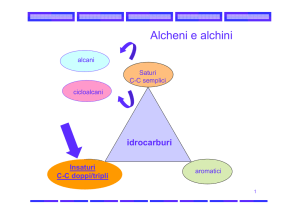
Alcani CnH(2n+2)
Idrocarburi saturi, non hanno doppi legami
Formano catene semplici o ramificate
CH4
C2H6
H
H
C
H
metano
H H H
H H
H
H C C
Formule molecolari
C3H8
H
H C C C
H H
H H H
etano
propano
H
Formule di struttura
Ibridazione C sp3
Configurazione elettronica esterna
Struttura
Legami C e H
CH4
Legami s
C
Geometria tetraedrica: i quattro orbitali ibridi sono diretti lungo i
vertici di un tetraedro (109,5°)
ALOGENAZIONE DEGLI ALCANI
CH4 + Cl2
luce
CH3Cl + HCl
o calore
Perché avvenga questa generica reazione bisogna fornire energia
CH4 + Cl2 (in condizioni di buio) → nessuna reazione
CH4 + Cl2 (alla luce) → CH3Cl + HCl
La stessa reazione si avrà trattando qualsiasi alcano con
un alogeno che sia Cl, F e Br. Con lo iodio non avviene in
modo spontaneo
Meccanismo di reazione
La reazione di alogenazione è una reazione radicalica che avviene in
più stadi
1 inizio
o calore
••
••
•• Cl + •• Cl
••
••
••
•• Cl Cl •
•
luce
••
••
••
L’energia rompe prima il legame covalente ad energia minore
Rottura omolitica del legame
2 propagazione
Il radicale Cl• ha 7 e- e per raggiungere l’ottetto
legame C-H e strappa un e-
CH3-H + Cl• HCl + •CH3
C
H
H
+ Cl ••
Radicale metile
H
H Cl + H C
••
H
••
H
rompe il
H
3 propagazione
Il radicale •CH3 possiede intorno a sé 7 elettroni, per cui ne
richiede 1 per completare l’ottetto.
•CH3 + Cl – Cl CH3Cl + Cl•
sia l’atomo di Cl• che il metile vengono continuamente rimessi
in circolo.
Stadio di teminazione
Quando si incontrano tra loro due radicali la reazione
si arresta
Cl• + Cl• Cl2
•CH3 + Cl• CH3 - Cl
•CH3 + •CH3 CH3 – CH3
La reazione non viene bloccata in una prima fase dalle reazioni di terminazione in
quanto le quantità di radicali CH3 e Cl sono molto piccole rispetto a quelle di CH4 e Cl2 e
è improbabile che si incontrino. Al procedere della reazione di clorurazione le quantità di
CH4 e Cl2 diminuiscono, le tre reazioni di arresto diventano più probabili.
.
REAZIONE DI SOSTITUZIONE NUCLEOFILA
Una reazione di sostituzione nucleofila è una particolare reazione
chimica in cui un atomo o un gruppo funzionale nucleofilo (gruppo
uscente) , è sostituito da un altro atomo o gruppo funzionale
nucleofilo.
Esempio: reazione di sostituzione nucleofila degli alogenuri
alchilici
RX + Nu-
RNu + X-
Reazione di sostituzione nucleofila degli alogenuri alchilici
CH3Cl + HO-
CH3OH + ClH
H
d+
C
Cl
d-
H
Lo ione idrossido è il nucleofilo che reagisce con il substrato e si sostituisce
all’alogeno, il gruppo uscente. Si spezza un legame covalente e se ne forma
uno nuovo, il gruppo uscente si porta via entrambi gli elettroni del legame, il
nucleofilo fornisce entrambi gli elettroni per la formazione del nuovo legame
Avviene con due meccanismi: SN1 e SN2
Meccanismo di sostituzione SN2
Alogenuro alchilico e nucleofilo partecipano contemporaneamente al
passaggio chiave della reazione.
È un processo concertato che avviene in un unico
passaggio, il legame con il gruppo uscente si spezza man a
mano che si forma il nuovo legame tra carbonio e nucleofilo
H
-
HO + R
C
H
H
Cl
R
C
H
OH +
Cl
-
Stadio di transione
Reazioni SN2
Caratteristiche del meccanismo SN2
La velocità di reazione dipende dalla concentrazione
dell’alogenuro alchilico e del nucleofilo (cinetica bimolecolare).
V=k[alogenuro][Nu]
La velocità di reazione diminuisce
dimensioni dell’alogenuro alchilico.
all’aumentare
delle
Nel caso di un alogenuro alchilico chirale, il prodotto ha la
configurazione invertita rispetto a quella del reagente.
Meccanismo di sostituzione SN1
Avviene in due o più passaggi, con la formazione di intermedi di
reazione, nel primo passaggio si spezza il legame tra alogeno e
carbonio con formazione di un carbocatione e successivamente il
nucleofilo attacca il carbocatione
1 step
H
R
C
H
Cl
lento
R
H
2 step
C +
H
H
C+
H
H
+
R
+ Cl
HO
- veloce
R
C
H
OH
-
Caratteristiche del meccanismo SN1
La velocità di
dell’alogenuro
reazione
dipende
solo
dalla
concentrazione
V=k[alogenuro]
C del carbocatione intermedio di reazione è ibridato sp2 quindi planare
e l’attacco del nucleofilo avviene indifferentemente da una parte o
dall’altra del piano. Se è presente un centro chirale, la sostituzione
porta alla formazione di un racemo
2) Stereochimica delle reazioni con racemizzazione all'atomo di carbonio che
subisce l'attacco nucleofilo:
Ph
H3C
Ph
H3CH2C
C
Br
CH3
C +
CH2CH3
Ph
H3C
CH3
HO
C
+
CH2CH3
Ph
H3CH2C
C
OH
Reazioni SN1
Il meccanismo SN1 sarà preferito dagli alogenuri che formano
carbocationi più stabili, come i terziari o il benzilico e l’allilico,
poiché si passa attraverso la formazione di un carbocatione.
H
H
H
C +
H
CH3
C +
H
CH3
CH3
CH3
C +
H
Carbocatione 1°
CH3
C +
CH3
Carbocatione 3°
Carbocatione 2°
Stabilità del carbocatione
A parità di radicale, la reazione sarà favorita quanto più
stabile sarà il gruppo uscente (X-)
RI>RBr>RCl>RF.
Confronto SN2 e SN1
ADDIZIONE ELETTROFILA
Le reazioni di addizione elettrofila sono caratteristiche dei
composti che contengono una doppio legame carbonio-carbonio
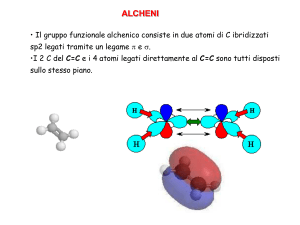
Alcheni CnH2n
Idrocarburi insaturi
Presentano almeno un doppio legame
C2H4
H
H
C
C
etene
C3H6
H
H
H
H
H
C
C
C
H
H
propene
H
Struttura
Il carbonio è ibridato sp2
Struttura
Il doppio legame è un sito ad alta densità elettronica
C2H4
Alta densità di carica negativa in corrispondenza del legame p
Suscettibile ad attacco elettrofilo
Reazione di addizione elettrofila
Reazione caratteristica dei composti contenenti doppi legami
carbonio-carbonio.
Determina la conversione di un legame p in legami s
Meccanismo di reazione
1 step
Addizione dell’elettrofilo al doppio legame. Porta alla formazione di un
carbocatione.
C
C
+ H+
lento
C
C
+
H
Rappresenta il passaggio lento della reazione
2 step
Il carbocatione reagisce con un nucleofilo
C
C
+
+ Nu
-
veloce
C
C
H
Nu
Addizione di un acido alogenidrico ad un alchene
C
d+ d-
C
+ HCl
C
C
H
Cl
1 step
C
C
+ H+
lento
C
H
2 step
C
C
+
+
Cl
-
veloce
C
C
H
Cl
C
+
Addizione di acqua- reazione di idratazione
Catalizzata da acidi
C
C
H+
+ H2O
C
C
H
OH
alcol
catalizzatore
1 step
C
C
+ H+
lento
C
H
2 step
H
C
+
+
veloce
O
H
H
C
C
H
O
H
+
C
C
+
veloce
H
C
C
H
OH
alcol
+ H+
Regioselettività dell’addizione elettrofila
Regola di Markovnikov
H
CH3 CH CH2+
H
H
H
C
C
+
C
H
H+
H
H
H
H
H
H
C
C
H
C H
+
H
Carbocatione secondario
Più stabile
Carbocatione primario
L’elettrofilo si lega al carbonio con maggior atomi di idrogeno
perché si forma il carbocatione più stabile
Stabilità dei carbocationi
Eliminazione
Due ligandi al C vengono eliminati con
formazione di C=C
Reazione di eliminazione
La reazione di eliminazione consiste nell’eliminazione di due ligandi da due
atomi di C con la formazione di un doppio legame
Reazione di dealogenazione degli alogenuri alchilici
H
H
H
C
C
H
H
Cl
ROH
H
H
C
+ HCl
C
H
H
Reazione di disidratazione degli Alcoli
H
H
C
H
C
H H
etanolo
OH
H+
H
H
C
+ H2O
C
H
H
etene
La reazione di eliminazione avviene con due meccanismi
Eliminazione E1
Eliminazione E2
Meccanismo Eliminazione E1
Step1
uscita dell’alogeno e formazione del carbocatione, passaggio lento della
reazione
H
H
H
C
C
H
H
lento
Cl
H
H
H
C
C +
H
H
+ Cl
-
Step2
la base B- rimuove un atomo di idrogeno in ß dal carbocatione
••
H
••
ROH
H
H
C
C +
H
H
veloce
H
H
C
H
+ HCl
C
H
Caratteristiche del meccanismo E1
La velocità di reazione dipende dalla
dell’alogenuro alchilico
V=k[alogenuro]
concentrazione
Più stabile è il carbocatione intermedio di reazione, più veloce
è la reazione. L'ordine di reattività delle reazione E1 segue
dunque l'ordine di stabilità dei carbocationi
terziario > secondario > primario > metilico
Meccanismo Eliminazione E2
La reazione avviene in un solo passaggio.
Mentre la base comincia a legare il protone strappandolo al
carbonio in posizione b, l’alogeno comincia a rompere il proprio
legame con il carbonio adiacente. Non si forma nessun intermedio,
ma uno stato di transizione con un parziale carattere di doppio
legame
Competizione tra eliminazione e sostituzione
Spesso le reazioni di eliminazione e sostituzione
competono tra loro. La prevalenza dell’una sull’altra
dipende dal tipo di nucleofilo, dal substrato e dalle
condizioni di reazione
Variando le condizione di reazione (temperatura,
solvente e forza del nucleofilo) viene favorita o
l’eliminazione o la sostituzione.
Competizione tra eliminazione e sostituzione