Gli idrocarburi insaturi
ALCHENI ED ALCHINI
Nomenclatura
Analisi conformazionale
Proprietà fisiche
Metodi di preparazione
Reazioni
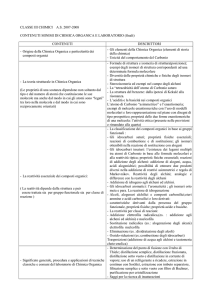
ALCHENI
O IDROCARBURI ETILENICI O OLEFINE
• HANNO ALMENO UN DOPPIO LEGAME C=C
• HANNO FORMULA GENERALE
NOMENCLATURA
• SCEGLIERE LA CATENA PIU' LUNGA CONTENENTE IL DOPPIO LEGAME,
E METTERE IL SUFFISSO –ENE
• LA NUMERAZIONE INIZIA DALL’ESTREMITÀ PIÙ VICINA AL LEGAME
MULTIPLO
• SE IL LEGAME MULTIPLO È EQUIDISTANTE DALLE DUE ESTREMITÀ, LA
NUMERAZIONE INIZIA DA QUELLA PIÙ VICINA AL PRIMO PUNTO DI
RAMIFICAZIONE
• PER INDICARE LA POSIZIONE DEL LEGAME MULTIPLO CI SI RIFERISCE
ALL’ATOMO DI CARBONIO DI QUESTO LEGAME CHE HA IL NUMERO PIÙ
BASSO
• SE I LEGAMI MULTIPLI SONO PIÙ D’UNO, LA NUMERAZIONE INIZIA
DALL’ESTREMITÀ PIÙ VICINA A QUELLO CHE VIENE PER PRIMO
Esempi e visualizzazioni
ALCHENI CICLICI
Struttura Elettronica degli
Alcheni
ibridazione sp2
Tre orbitali equivalenti a 120º
Quarto orbitale atomico p
Combinazione di elettroni in
due orbitali sp2 di due atomi
forma legame
Interazione addittiva degli
orbitali p crea un orbitale
L’orbitale occupato impedisce
la rotazione attorno al legame
(barriera del legame - circa
268 kJ/mole nell’etilene)
ISOMERIA CIS-TRANS
SE IL LEGAME SI SPEZZA, GLI ISOMERI SI RICONVERTONO
Per gli alcheni più sostituiti le posizioni si stabiliscono
con la regola delle priorità
Regola di priorità
1. Si individuano le priorità sulla base del numero atomico
dell’atomo legato al carboni del doppio legame;
2. Si usano le lettere E (opposti), Z (insieme) per le
posizioni dei gruppi a maggiore priorità.
Le Regole di Sequenza per l'Assegnamento della
Configurazione degli Alcheni
Assegnare le priorità ai gruppi sostituenti legati a ciascun atomo di carbonio,
osservando gli atomi legati direttamente ai carboni costituenti il doppio legame.
Più elevato è il numero atomico dell'atomo legato direttamente al carbonio, più
elevata è la sua priorità. Per esempio, H- < C- < N- < O- < Cl-.
Se due sostituenti hanno la stessa priorità considerando gli atomi legati direttamente
al carbonio del doppio legame bisogna considerare i sostituenti sugli atomi via via più
distanti dal doppio legame fino a che non si trova una differenza. Per esempio, CH3< C2H5- < ClCH2- < BrCH2- < CH3O-.
Gli atomi dei sostituenti legati con legami multipli si considerano equivalenti ad
atomi recanti solo legami semplici. Per esempio, C=O equivale a C(-O)2.
Se il sostituente con la più alta priorità presente sul carbonio 1 ed il sostituente
con la più alta priorità presente sul carbonio 2 si trovano dalla stessa parte del
doppio legame l'isomero è Z altrimenti l'isomero è E.
La formula per un determinato alchene ramificato è mostrata qui di seguito:
Quale è il nome IUPAC?
E-3-Etil-2-esene
Stabilità degli Alcheni
DH della rottura di C=C a C-C
più stabile di
•Alcheni con più sostituenti sono più stabili
• Gli alcheni coniugati sono più stabili degli alcheni isolati.
PROPRIETÀ FISICHE
• SONO SIMILI A QUELLE DEI CORRISPONDENTI ALCANI CON
PUNTO D’EBOLLIZIONE UN PO' PIÙ BASSO :
• P P. EBOLLIZIONE/FUSIONE:
- etene, butene, propene gas @ RT
- effetto della configurazione cis-trans
• GLI ISOMERI CIS HANNO UN PICCOLO MOMENTO DIPOLARE
• ALCHENI PIU’ ACIDI DI ALCANI (pKa = ~ 44 vs ~ 50)
• IL DOPPIO LEGAME ASSORBE LA LUCE ULTRAVIOLETTA E
QUELLA INFRAROSSA.
Alcuni tipi di reazioni Organiche E loro Meccanismi
• Rivisitazione dei concetti di Omolisi, Eterolisi
•Reagenti Nucleofili e Reagenti Elettrofili
•Reazioni Polari
•Reazioni radicaliche
•Reazioni pericicliche
Eterolisi ed Omolisi
Due meccanismi fondamentali di rottura
di legami covalenti.
OMO-LISI
ETERO-LISI
ioni
Autoscissione
Scissione indotta
radicali
Esempio di questo tipo
di meccanismo è nella
alogenazione degli
alcani
Le reazioni Polari
•L’eterolisi coinvolge legami Polarizzati (Reazioni Polari).
•Comporta la separazione di cariche opposte, ma non sempre
coinvolgono ioni;
•Spesso si ha l’intervento di una molecola con una coppia solitaria
di elettroni, che forma un legame con uno dei due atomi.
Le reazioni polari sono:
A. ADDIZIONE
B. SOSTITUZIONE
C. ELIMINAZIONE
Esempi di Reazioni in chimica organica
1) ADDIZIONI
2) SOSTITUZIONI
3) ELIMINAZIONI
Meccanismi di reazione
I meccanismi di reazione rappresentano la
descrizione dei possibili eventi che avvengono a
livello molecolare quando i reagenti si
trasformano in prodotti.
Ogni meccanismo è proposto sulla base di studi
di cinetica delle reazioni, di analisi
spettroscopiche e di identificazione degli
intermedi di reazione.
Ogni meccanismo proposto deve essere
consistente con tutte le osservazioni
sperimentali relative alla reazione chimica in
esame.
Carbocationi
L’eterolisi di un legame che coinvolge un atomo di carbonio può
portare alla formazione di due ioni diversi:
CARBOCATIONE : manca di una coppia di elettroni;
ELETTROFILO : cerca elettroni per completare l’ottetto;
Acido di Lewis : reagisce con Basi di Lewis.
Carbanioni
CARBANIONE : ha carica negativa ed una coppia di
elettroni solitaria
NUCLEOFILO = cerca protoni o centri con carica
positiva
Base di Lewis - reagisce con Acidi di Lewis.
ESEMPI DI REAZIONE ACIDO-BASE SECONDO
BRÖNSTED-LOWRY
• Acido: specie chimica che dona protoni
• Base: specie chimica che accetta protoni
• Reazione acido base: reazione di trasferimento di protoni.
H3O+ + Cl-
HCl(gas) + H2O
H3
O+
+
Cl-
+ NH3
HCl(gas) + NH3(gas)
H2O
NH4+ + Cl- + H2O
NH4Cl-(sol)
in assenza di solvente
ESEMPI DI REAZIONE ACIDO-BASE SECONDO LEWIS
E’ una generalizzazione della teoria di Brönsted-Lowry e comprende anche
processi in cui non avvengono trasferimenti di protoni.
Un acido è una specie chimica contenente atomi con orbitali di valenza
incompleti. Un acido è un accettore di elettroni.
Una base è una specie chimica avente una o più coppie elettroniche non
condivise. Una base è un donatore di elettroni.
Sono tipiche basi di Lewis:
OH- , H2O, NH3, CN-
Reagenti nucleofili
hanno un doppietto elettronico libero con una carica
negativa totale o parziale (:)
sono attratti da molecole (o parti di esse) con bassa
densita’ elettronica (carica positiva parziale o totale)
cedono un doppietto elettronico al substrato
sono basi di Lewis
ESEMPI
OH
-
H2O, NH3
Basi di Arrhenius
Basi di Broensted
CN-, Cl- Br- NO3- NO2- CH3CO2-
Anioni
Reagenti elettrofili
sono poveri di elettroni e caratterizzati da una carica
positiva totale o parziale
sono attratti da molecole (o parti di esse) con alta
densita’ elettronica
attirano a sé il doppietto elettronico del substrato
sono acidi di Lewis
Esempi
H+ , Cl+, Br+ , NH4+, RNH3+
NO2+ HSO3+
ioni dei metalli di transizione Ag+, Cu2+, Cr3+, ...
Struttura dei Carbocationi
Stabilità dei carbocationi
Mappa dei potenziali elettrostatici dei carbocationi
Terziario
Secondario
Primario
N.B. Colore Blu = Carica Positiva
Metilico
Carbanioni
Struttura dei Carbanioni
Stabilità degli alchil-carbanioni:
Reazioni pericicliche
la reazione di Diels-Alder è la più nota
In generale….
Meccanismo
Preparazione di Alcheni
Reazioni di Eliminazione
A. Disidratazione di alcoli
MECCANISMO DELLA DISIDRATAZIONE
ASPETTI ENERGETICI
B. Deidroalogenazione di alogenuri alchilici
Saytzeff:
C.Eliminazione Dibromuri vicinali
Mg
Reazioni di addizione elettrofila
Reazione caratteristica dei composti contenenti un
doppio legame carbonio-carbonio
Determina la conversione di un legame ed un legame
in due legami .
Alta densità di carica
negativa in corrispondenza
della regione del legame .
Suscettibilità all’attacco
ELETTROFILO
Reazioni di addizione elettrofila
•Attacco elettrofilo
• La formazione del
Carbocatione è la
fase che determina
la velocità di
reazione
Reazioni di addizione elettrofila
•somma di alogeni
Es. Cl2
• somma di acidi alogenidrici Es. HCl
• somma di acqua
• Le reazioni avvengono facilmente a freddo,
preferibilmente in ambiente polare, es. acido acetico.
Regioselettività dell’addizione elettrofila
regola di Markovnikov
Quando sia il reagente elettrofilo sia il substrato
dell’addizione sono asimmetrici, sono teoricamente
possibili 2 prodotti. In realtà se ne ottiene solo uno
ma non
Meno
sostituito
Meno sostituito
Meno sostituito
Regioselettività dell’addizione elettrofila
regola di Markovnikov
ma non
Meno
sostituito
Stato transizione 1
Carbocatione primario
clicca
Stato transizione 2
Carbocatione secondario
Reattività degli alcheni (C=C)
un legame è una regione ad alta
densità (rosso) di elettroni, trattenuti
più debolmente.
• Gli elettrofili sono attratti dagli elettroni rottura del
legame
• Si forma un Carbocatione come intermedio di reazione.
• Un nucleofilo si addiziona al carbocatione.
• Gli alcheni danno reazioni di addizione elettrofila che
convertono il legame p in due nuovi legami .
Addizione Elettrofila
Step 1: elettroni attaccano
l’elettrofilo.
E
C
C
+
E
+
C
C +
• Step 2: Nucleofilo attacca il carbocatione.
E
C C+
+
_
Nuc:
E Nuc
C C
Reattività degli alcheni (C=C)
R1
R3
C
R2
C
R4
R1
A B
R3
R2 C
C R
4
A
B
La molecola A-B è addizionata
per intero al composto insaturo
Reazioni esotermiche
REGOLA DI MARKOVNIKOV
ADDIZIONE DI REAGENTI ASIMMETRICI
AD ALCHENI ASIMMETRICI
Reagenti
asimmetrici
I PRODOTTI SONO REGIOISOMERI
LA REAZIONE PUÒ ESSERE: REGIO-SPECIFICA O REGIO-
SELETTIVA
Addizione elettrofila ad un alchene asimmetrico
SI OTTIENE SOLO 2-PROPANOLO
QUANDO UN REAGENTE ASIMMETRICO SI ADDIZIONA AD
UN ALCHENE ASIMMETRICO, LA PARTE ELETTROPOSITIVA
DEL REAGENTE SI LEGA AL CARBONIO CON IL MAGGIORE
NUMERO DI ATOMI DI IDROGENO.
REGOLA DI MARKOVNIKOV
ADDIZIONE DI REAGENTI ASIMMETRICI
AD ALCHENI ASIMMETRICI
Regola di Markovnikov (empirica):
“quando un alchene asimmetrico reagisce con
un acido alogenidrico per formare un
alogenuro alchilico, l’idrogeno si addiziona al
carbonio dell’alchene che è legato al maggior
numero di atomi di idrogeno e l’alogeno al
carbonio che è legato al minor numero di
atomi di idrogeno”
STABILITA’
I gruppi alchilici sono elettron donatori e quindi per effetto
induttivo tendono a stabilizzare la carica positiva del carbocatione.
REAZIONI DEGLI ALCHENI
•
ADDIZIONE D’ ACIDI ALOGENITRICI
e di ACIDO SOLFORICO
•
ADDIZIONE D’ ALOGENI
•
ADDIZIONE D’ ACQUA
•
ADDIZIONE D’ IDROGENO
•
OSSIDAZIONE
•
POLIMERIZZAZIONE
1.
Addizione di acidi
È una addizione
elettrofila
meccanismo
CINETICA DELLA REAZIONE
Addizione di acido solforico (industriale)
• Idratazione di Alcheni
H
C C
alchene
alkene
+ H2O
+
H OH
C C
alcohol
alcol
Necessita di soluzioni diluite di acidi forti (H2SO4
o H3PO4 , la base coniugata che si forma
essendo molto debole sarà anche un nucleofilo
scadente (ad es. SO4--)).
Questo permette
all’H2O di competere con successo nell’attacco
nucleofilo.
Meccanismo dell’idratazione
H
H
C C
+
+
H O H
+
H
+
H O H
C C
+
H2O
H
+
H O H
H
+
C C
+
C C
H2 O
C C
H
H O
+
H2O
C C
+
H3O
+
• Addizione di alogeni
• Cl2, Br2, e talvolta I2 si addizionano ad un doppio
legame formando dialogenuri vicinali.
• Addizione Anti, la reazione è stereospecifica.
Br
C
C
+
Br2
C
C
Br
Meccanismo dell’alogenazione
Elettroni attaccano la molecola di
bromo.
Si separa uno ione bromuro.
Intermedio = ione bromonio ciclico.
C C
Br
C C
+ Br Br
=>
+ Br
Ione Br- si aggiunge dal lato opposto a quello dell’anello
a tre vertici.
Br
Br
C C
IONE BROMONIO
C C
Br
Br
Bromo + ciclopentene
•
Idrogenazione
Alchene + H2 Alcano
Necessario un Catalizzatore, di solito Pt, Pd, or Ni.
Addizione Syn
ADDIZIONE RADICALICA DI HBr
L'addizione radicalica di HBr agli alcheni
avviene, APPARENTEMENTE con
orientazione anti-Markovnikov
si realizza in presenza di perossidi e luce o
calore
La reazione è a catena e quindi si svolge in
tre momenti: inizio, propagazione,
terminazione. Non dà trasposizioni.
H2SO4
6. Ossidazioni 1
H2SO4
H2SO4
S
Ossidazioni 2
IDROBORAZIONE – OSSIDAZIONE
Idroborazione e ossidazione
sono due reazioni distinte.
Nel totale si ottengono alcoli
con orientazione
antiMarkovnikov pur
rispettando la regola del
carbocatione più stabile.
THF = Tetraidrofurano
LA REAZIONE DI DIELS-ALDER
7. Polimerizzazione
Un alchene (monomero) può addizionarsi ad
una molecola simile per formare una catena
(polimero).
Tre metodi:
Cationica, con carbocatione intermedio
Radicalica
Anionica, a carbanione intermedio (rara)
H
C
H
H
C
R
Polietilene (PE)
Polipropilene (PP)
Polivinil
chloruro (PVC)
Polistirene (PS)
Polimerizzazione Radicalica
In presenza di un radicale libero iniziatore, (p. es.
Perossido organico R-O-O-R) si verifica la
polimerizzazione radicalica.
H
H
C C
Ph
H
RO
H
Ph
RO C C
H
H
+
H
H
C C
Ph
H
H
Ph H
Ph
RO C C C C
H H H
H
=>
7. Polimerizzazione
TIPI DI POLIMERI
1
TIPI DI POLIMERI
2
MECCANISMO DI POLIMERIZZAZIONE
Dieni, trieni….polieni
•I sistemi con più di un C=C sono definiti “polieni”.
•I più semplici sono quelli in cui ci sono 2 doppi legami, i “dieni".
•La posizione relativa dei doppi legami determinano le caratteristiche di
reattività del sistema.
•Sono possibili tre differenti configurazioni.
Cumuleni
Dieni coniugati
Dieni isolati
Sistemi coniugati
C
C
C
C
Tutti e 4 i carboni
sono ibridati sp2
Tutti gli atomi nel diene coniugato giacciono sullo stesso piano
H
H
1,3-butadiene
H
H
H
H
H
H
H
H
H
Legame ad elettroni
delocalizzati
H
H
H
H
H
H
H
Legame ad elettroni
delocalizzati nei
dieni coniugati
1,3-butadiene
H
H
H
H
H
H
ADDIZIONE ELETTROFILA
AI DIENI CONIUGATI
1
H
1
H2C
C
2
HC
3
C
CH2
4
Br
H
CH2
C
2
H
C
H
addizione 1,2
H
H -- Br
1
H
Br
C
CH2
H2C
C
H
H
4
addizione 1,4
Acido bromidrico
1,3 butadiene
Distribuzione
del potenziale
elettrostatico
HBr
Br -
H+
Attacco
elettrofilo
+
carbocatione secondario
+
carbocatione allilico
+
Br-
+
Equilibrio di risonanza:
spostamento di un doppietto di
elettroni dalla posizione 1-2 a
quella 2-3, spostamento della
carica positiva dal C3 al C1.
Differenti prodotti di reazione a seconda di quale sia il
carbocatione “attaccato” dal nucleofilo.
Reazioni a controllo cinetico e termodinamico
ALCHINI
(IBRIDAZIONE SP)
• ORBITALI IBRIDI DI TIPO sp
• HANNO ALMENO UN TRIPLO LEGAME
• HANNO FORMULA GENERALE CNHN
Formazione
del
triplo legame
Nomenclatura
Propino
2-butene
Alcheni ciclici
e nomi comuni
Torna
Preparazione di Alchini
1
2
Produzione industriale di Acetilene
•Viene prodotto a partire dall'ossido di calcio e dal carbone, che
vengono messi in un forno la cui temperatura interna supera i 2000 °C.
L'ossido di calcio ed il carbone reagiscono secondo la reazione:
CaO + 3C ---> CaC2 + CO
Il carburo che si ottiene è liquido, in quanto la sua temperatura di fusione
si aggira intorno ai 2300 °C.
•La reazione del carburo di calcio con l'acqua fu scoperta da Friedrich
Wohler nel 1862.
1 grammo di CaC2 sviluppa 349 ml di acetilene:
CaC2 + 2H2O → C2H2 + Ca(OH)2
Come gli
Alcheni
Danno:
H
H C C
Br
CH3
H
C
Br
C
Br
Br
C C
Br
Br
CH3
Br
Br
H
Br
Br
CH3
Br
C
C
CH3
Br
Ossidazione
con Ozono