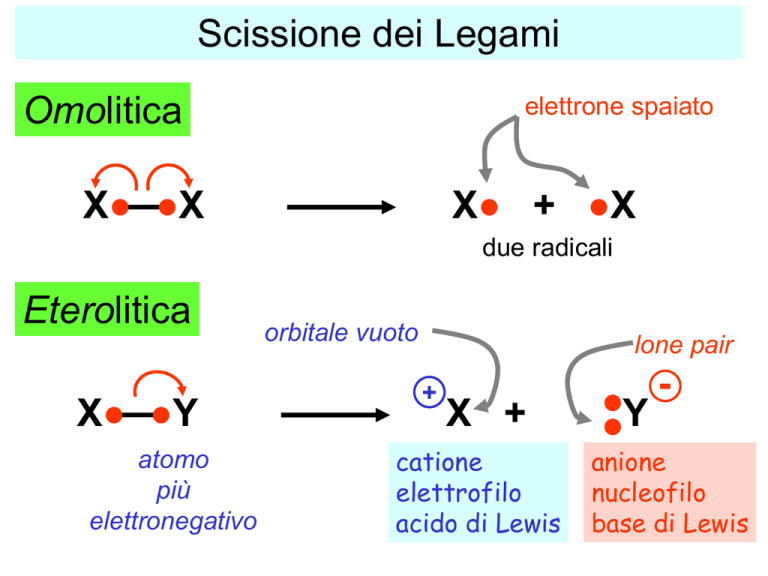
Scissione dei Legami
Omolitica
elettrone spaiato
X● ●X
X● + ●X
due radicali
Eterolitica
X● ●Y
atomo
più
elettronegativo
orbitale vuoto
lone pair
+
X +
catione
elettrofilo
acido di Lewis
●Y
●
anione
nucleofilo
base di Lewis
Processi Omolitici ed Eterolitici
Rottura di un Legame
Formazione di un Legame
SCHEMA
per ogni classe di composti si deve considerare:
• la formula generale,(di struttura e struttura semplificata)
• la nomenclatura,
•Proprietà (ibridazione C , solubilità, isomerie )
• le reazioni principali (preparazione e reazioni)
•usi in medicina
Le molecole polarizzate reagiscono con reattivi di carica opposta
NUCLEOFILO
Y
H
H
d+
C X
H
Se la molecola ha una parziale carica positiva, reagirà con reattivi
che hanno elettroni disponibili, i reattivi NUCLEOFILI
ELETTROFILO
H+
R
dO H
Se la molecola ha una parziale carica negativa, reagirà con reattivi
che hanno carica positiva, i reattivi ELETTROFILI
Tipi di reazione in chimica organica
X
Y
Sostituzione
X
C
Elettrofila o nucleofila
C
+ Y
Y
O radicalica
A B
Addizione
Elettrofila o nucleofila
C C
+ A-B
C=O + A-B
H
C C
A
C-OB
H
A B
Eliminazione
C C
C C
+ A-B
Reazioni
degli
Idrocarburi
Idrocarburi
Sono i composti organici binari, costituiti solo da Carbonio e
Idrogeno
Saturi
Alifatici
aciclici
ciclici
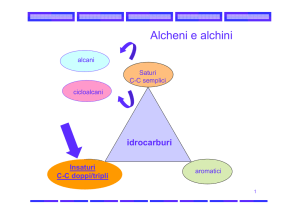
Idrocarburi
alcani
alcheni
Insaturi
alchini
Aromatici
Idrocarburi saturi: presentano esclusivamente legami singoli carbonio-carbonio
Idrocarburi insaturi: contengono almeno un legame multiplo carbonio-carbonio
Le molecole degli alcani sono apolari, per cui risultano INSOLUBILI
in acqua e solubili in molti solventi organici
Gli alcani danno reazioni di
• Combustione (reazione redox con sviluppo di
calore)
• sostituzione radicalica
Es di ossidazione del glucosio nella cellula
C6H12O6 + 6O2 6CO2 + 6H2O + 686 kcal
Combustione degli alcani
Ossigeno in eccesso:
CH4 + 2 O2
CO2 + 2 H2O + q
Ossigeno in difetto:
CH4 + 3 O2
2
CO + 2 H2O
tossico
La combustione degli alcani
è una rezione RedOx
L’Ossigeno è l’ossidante che si riduce
-4
0
CH4 + 2 O2
+4 -2
-2
CO2 + 2 H2O
Il Carbonio è il riducente che si ossida
2CH3(CH2)14CH3 + 50O2 32CO2 + 34H2O
Gli acidi grassi sono praticamente una
fonte di idrocarburi biologici
Catena
“idrocarburica”
Gli alcani danno reazione di
Sostituzione Radicalica
X
H
C R''
R
R'
X
H
C R''
R
R'
H è sostituito da X
Alogenazione del metano
CH4 + Cl2
CH3Cl + HCl
Sostituzione radicalica
H
H
H
H
H
H
H
H
H
H
H
H
H
H
+ Cl2
H
H
H
H
+HCl
H
H
Cl
H
H
H
Sostituzione radicalica
meccanismo
1.Inizio
Cl
hn, calore
Cl
2 Cl
.
Nella prima fase della reazione si scinde il legame Cl - Cl
2.Propagazione
H
H
C
H
H
H
+
.Cl
H C
.
H Cl
H
Nella seconda fase un atomo (radicale) di cloro induce la
scissione omolitica di un legame C-H del metano
3.Propagazione
H
H
H C
H
.
+ Cl
Cl
H C
Cl
+ Cl
.
H
Iniziatore della reazione
Reazione a catena
IMP: Per continuare la catena si deve formare
un nuovo radicale altrimenti si interrompe
Nella terza fase il radicale metile induce la scissione omolitica di
una seconda molecola di cloro.
Termine
H
H
.
H C
+
.C
H
H
H
H C
C
H
H
H
H
H
H
H C
. + .Cl
H
Cl
H
. + .Cl
H C
Cl
H
Cl2
La reazione a catena si interrompe quando due radicali si
combinano per formare una molecola stabile
Sostituzione Radicalica
1°
Cl
2 Cl .
Cl
H
2°
H
C
H
H + Cl.
H
H C . + Cl
H
H Cl
H
H
H
3°
H C.
Cl
H C
H
Cl + Cl .
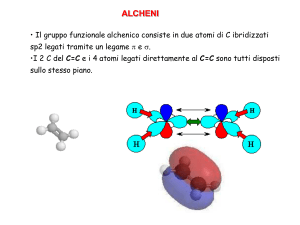
ALCHENI
Gli alcheni danno
reazioni di addizione
A
C C
sp2
+ A-B
B
C C
sp3
addizione di idrogeno
H
H H
H
+
C C
H
H2
H C C H
H
H H
etene
H
H
H
etano
H
H
H
H
H
H
H
H
cicloesene
+ H2
H
H
H
H
H
H
H
H
H
cicloesano
H
H
addizione di alogeni
H
+
C C
H
H H
H
H
etene
Br2
H C C H
Br Br
dibromoetano
addizione di H2O
+
H C
H2O
C H
H OH
etanolo
H
etene
H
H
C
OH
H
H
H
+ H2O
H
H
ciclopentene
ciclopentanolo
H
C
H
H
H
H
H H
addizione di HCl
H
H H
H
+
C C
H
H
etene
HCl
H C C H
H Cl
cloroetano
Il Meccanismo della Addizione Elettrofila
carbocatione
orbitale pz vuoto
p
H
H
s
H
+
HH
H+
s
H
H
H
H
HH
Cl
Cl-
H
H
C
C
H
H+
H
H
H+
H
s
H
H
H
H
H
lenta
C
H
+
C
H
H
H
-
Cl
Cl
veloce
H
H
C
C
H
Cl
H
Meccanismo della reazione di Addizione Elettrofila
Addizione di H2O catalizzata da acidi
H
H
H
H
C
C
H
H
H+
lenta
C
+
C
H
H
H
O
H
H
veloce
H
H
C
C
H
O
H
O
H
H
H
+
H
H
H2O è un nucleofilo
e non può interagire
con l’orbitale p
H+ viene recuperato al termine
della reazione e può essere
considerato un catalizzatore
H+
+
H
H
H
C
C
H
OH
H
Addizione elettrofila del Br2 al propene
H
H
C C
1)
H
H
CH3
Br +
H
Br -
C C
+
Br
H
CH3
catione bromonio
Br -
2)
H
H
C C
+
Br
H
CH3
H
Br
H C C
H
CH3
Br
Addizione di HCl a un alchene asimmetrico
H H
H C C CH3
H
H
+ HCl
C C
H
H Cl
2-cloropropano
CH3
propene
H H
H C C CH3
Cl H
1-cloropropano
Regiospecificità
dell’addizione elettrofila
H H
H C C CH3
+
H
A)
H
H
+ H+
C C
H
CH3
carbocatione
secondario
H H
H C C CH3
+
H
carbocatione primario
H H
B) H C C CH3 + Cl +
H
carbocatione secondario
H H
H C C CH3
H Cl
2-cloropropano
Stabilità dei carbocationi
H
R
CH3
H C
H C
H
H
H
metilico
primario
secondario
H3C
C
CH
3
H3C
C
CH3
terziario
La maggiore possibilità di delocalizzazione della carica (+) è la
spiegazione della maggior stabilità
Anche gli Alchini danno reazioni di
Addizione Elettrofila
Addizione di bromo al propino
H
Br
H C C CH3
H
C C
Br
Br
Br
C C
Br
Br
CH3
Br
Br
H
Br
Br
CH3
Br
C C
CH3
Br
Addizione di H2O
H C C CH3 + H20
H+
H3C
CH3
C
O
propanone
H C C CH3
H
H
H
+
C C
+
H
H
CH3
C C
+
H
CH3
CH3
C C
H
O H
OH2
+
enolo protonato
H
H
CH3
H
OH2
H
C C
H
H
+
CH3
C C
H
O H
CH3
+ H+
C C
O H
enolo
H3C
CH3
C
O
propanone
Es in biochimica di addizione elettrofila
La settima reazione vede la sintesi dell' L-Malato a partire dal
fumarato. L'enzima fumarato idratasi addizione al doppio legame
acqua per formare la molecola di L-Malato.