Alogenoalcani
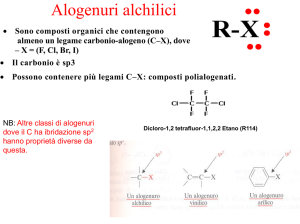
Sono composti in cui un alogeno è legato covalentemente
ad un atomo di carbonio ibridato sp3.
R-X
X = F, Cl, Br, I
Gli alogenuri alchilici
Sono composti organici in cui un idrogeno di una catena
alchilica è sostituito con un alogeno.
Gli alogenuri alchilici sono suddivisi in primari, secondari e
terziari a seconda del carbonio a cui è legato l’alogeno.
Struttura degli alogenuri alchilici
L’alogeno è più elettronegativo del carbonio. Il legame C-X
è polarizzato con maggiore densità elettronica sull’atomo di
alogeno.
Polarizzazione del legame C-alogeno
Il carbonio è elettrofilo
In un alogeno alcano, il legame Carbonio-Alogeno è un legame sigma che
avviene per sovrapposizione assiale di un orbitale sp3 del C ed un orbitale p
dell’alogeno
Nomenclatura degli
alogenoalcani
Il nome IUPAC degli alogenoalcani deriva dal nome del corrispondente
alcano secondo le regole che abbiamo già descritto.
• Individuare la catena base e numerarla cercando
di dare ai sostituenti il numero più basso
• Indicare gli atomi di alogeno come sostituenti
mediante i prefissi fluro-, cloro-, bromo- e iodoed elencarli in ordine alfabetico preceduti dal
numero dell’atomo di carbonio su cui si trovano
Esempi in organismi viventi…
Solventi clorurati
• CH2Cl2 Diclorometano
metilene
o
cloruro
di
• CHCl3 Triclorometano o cloroformio
• Sono
classificati
come
sospetti
cancerogeni: vanno usati con la massima
precauzione.
Piccole
quantità
sono
comunemente usate nei laboratori sia
chimici che biologici.
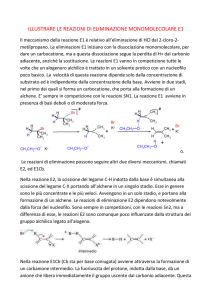
La reattività degli alogenuri alchilici
I composti organici in cui è presente
un atomo (o gruppo) elettronegativo
legato ad un carbonio sp3 possono
subire reazioni di:
-sostituzione nucleofila
-b eliminazione
Reattività degli alogenoalcani
•Reazioni di Sostituzione Nucleofila e b Eliminazione
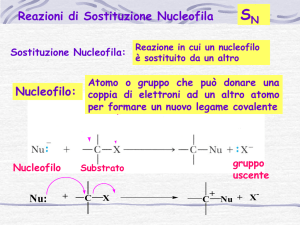
Nucleofila
E’ una reazione in cui l’atomo elettronegativo (X), è sostituito da un Nu-,(atomo
o gruppo). Si forma un legame s ed un altro legame s si rompe.
b
E’ una reazione in cui l’atomo elettronegativo (X) è eliminato insieme ad un H
che si trova su uno degli atomi di carbonio adiacenti.
Cioè vengono eliminati un H ed un alogeno (X) e nel prodotto finale si forma un
legame p con rottura di due legami s nel reagente
La reazione di sostituzione nucleofila
è così denominata perché un nucleofilo
sostituisce un alogeno.
Possibili prodotti di Sostituzione Nucleofila
(Alogenoalcano + Nucleofilo =…………………..)
La reattività degli alogenuri alchilici
Un alogeno è più elettronegativo
carbonio quindi l’alogeno possiede
maggiore densità elettronica e quindi
parziale carica negativa ed il carbonio
parziale carica positiva.
del
una
una
una
Il carbonio avendo una parziale carica
positiva si comporterà da elettrofilo.
La reazione di sostituzione nucleofila
può avvenire secondo due meccanismi
di reazione:
SN1 ed SN2
Reazioni di sostituzione nucleofila (SN) : SN2
SN2
Il Nu è attratto dalla parziale carica positiva del
carbonio e si avvicina. Appena si inizia a formare
un nuovo legame tra Nu-C, il legame C-alogeno si
rompe in maniera eterolitica. I due processi sono
CONCERTATI; cioè rottura e formazione del
legame avvengono simultaneamente, in un solo
stadio.
Reazione SN2
SN2
S sostituzione
N nucleofila
2 bimolecolare (i due reagenti sono coinvolti nello stadio che
determina la velocità della reazione
Entrambi i reagenti compaiono nella legge che
regola la velocità della reazione
Velocità= k [alogenoalcano][nucleofilo]
Esempio di Reazione SN2:
ione idrossido (Nu-) con bromometano
Energia potenziale
La reazione SN2 avviene in un solo stadio, dove sia il Nu
che l’alogenuro alchilico partecipano alla formazione della
stato di transizione, e quindi non passa attraverso
intermedi.
Stato di transizione con
simultanea rottura e
formazione di legami
Ea
Il Nu (OH-) attacca il C elettrofilo dal lato opposto
rispetto al gruppo uscente. Questo perché il gruppo
uscente blocca l’avvicinamento del Nu dalla parte frontale
della molecola.
Nello stato di transizione il carbonio è pentacoordinato:
forma 3 legami completi e 2 legami parziali. E’ quindi
chiaramente una specie molto affollata. Con il progredire
della reazione il Nu si avvicina sempre più al carbonio, il
bromo si allontana sempre più. Alla fine il legame tra C-Nu
risulterà pienamente formato, il legame tra C-Br sarà
completamente rotto ed il C tornerà ad essere
tetraedrico.
Se l’alogenuro alchilico è chirale?
Il prodotto della reazione SN2, se anch’esso chirale, presenterà
configurazione assoluta invertita rispetto a quella di partenza perché
l’attacco del Nu avviene dalla parte opposta rispetto al gruppo uscente.
Ciò produce l’inversione di configurazione.
OH
H
(R)-2-butanolo
Fattori che influenzano le
reazioni SN2
-La struttura dell’alogenuro alchilico
-La natura del gruppo uscente
-La forza del nucleofilo
-Il solvente in cui avviene la reazione
La struttura dell’alogenuro alchilico
Poiché il Nu attacca il carbonio dal lato opposto del
gruppo uscente, sostituenti ingombranti legati al
carbonio rendono più difficile per un Nu l’accesso al
carbonio. Cioè maggiore è l’affollamento al carbonio
che subisce sostituzione, maggiore è l’energia di
attivazione, più lenta è la reazione.
Gli alogenuri alchilici meno sostituiti sono più
reattivi in una reazione SN2
Fattori che influenzano le
reazioni SN2
-La struttura dell’alogenuro alchilico
-La natura del gruppo uscente
-La forza del nucleofilo
-Il solvente in cui avviene la reazione
-Natura del Gruppo Uscente
Sperimentalmente si osserva…
-Quanto più è stabile come anione, più aumenta
la capacità di agire come gruppo uscente.
-Gli anioni più stabili, perciò buoni gruppi
uscenti sono le basi deboli (basi coniugate di
acidi forti).
Le basi deboli sono stabili perciò:
Più la base è debole, più si comporta da buon gruppo
uscente
Fattori che influenzano le
reazioni SN2
-La struttura dell’alogenuro alchilico
-La natura del gruppo uscente
-La forza del nucleofilo
-Il solvente in cui avviene la reazione
-la forza del Nucleofilo
La nucleofilicità è una misura di quanto
velocemente una specie è in grado di attaccare
un sito carente di elettroni
INVECE
La basicità è una misura di come un composto (una
base) è in grado di condividere una propria coppia
di elettroni con un protone (H+)
Confronto tra specie chimiche con il centro
nucleofilo sullo stesso tipo di atomo
Maggiore è la basicità,
migliore è la nucleofilicità
Specie neutre
..
>
>
>
>
..
H2O..
CH
..
.. 3OH
..
..
..Specie– cariche
..OH .. –
CH
O
3..
..
–NH
.. 2 .. –
CH3CH2NH
..
NH3
..
CH3CH2NH2
Le specie cariche sono più nucleofile di quelle neutre
Reazioni di sostituzione nucleofila (SN):
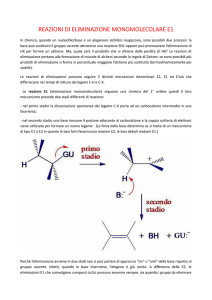
SN 1
a)
Intermedio carbocationico
SN1
b)
Avviene in due stadi:
a) Il legame C-alogeno si rompe in maniera eterolitica
formando un carbocatione.
b) Successivamente il carbocatione, un elettrofilo, reagisce
con un Nu formando il prodotto di sostituzione
Reazione SN1
Nella reazione SN1 la rottura del legame tra C e gruppo
uscente avviene prima che cominci a formarsi il legame tra C
e Nu.
SN1:
S sostituzione
N nucleofila
1 reazione monomolecolare (solo una specie è coinvolta nello
stadio che determina la velocità)
Equazione cinetica
Velocità=k[alogenuro alchilico]
Al contrario di quanto accade in una reazione SN2, in una
reazione SN1 il gruppo uscente si allontana prima che il Nu
si avvicini.
Nel 1° stadio il legame C-alogeno si rompe
eteroliticamente, con l’alogeno che trattiene la coppia di
elettroni e si forma un intermedio carbocationico (un
elettrofilo).
Nel 2° stadio il Nu reagisce rapidamente con il
carbocatione per formare un alcol protonato (nell’esempio
qui riportato).
OH-
..
Energia potenziale
Ea2
Ea1
La prima reazione che porta alla formazione del carbocatione attraversa la barriera
di energia potenziale più alta pertanto rappresenta lo stadio limitante la velocità
della reazione globale.
Velocità di reazione
Perché un alogenuro alchilico terziario è
più reattivo di un alogenuro alchilico
secondario che è più reattivo di un
alogenuro alchilico primario?
La risposta risiede nel concetto di
stabilità di un carbocatione!
Di fatto gli alogenuri metilici e primari non
reagiscono con meccanismo SN1
Se l’alogenuro alchilico è chirale?
Poiché il carbonio
carbocationico è ibridato
sp2 è una specie planare,
per cui l’attacco del Nu può
avvenire con uguale
probabilità da entrambi i
lati: al di sopra e al di
sotto del piano del
carbocatione.
OH-
OH-
Si formano entrambi i prodotti possibili, sia l’R che l’S, ovvero i due
possibili enantiomeri.
Le percentuali con cui i 2 prodotti si formano sono il 50% dell’R ed il
50% dell’S, ovvero si forma una miscela racemica.
Fattori che influenzano le
reazioni SN1
-La natura del gruppo uscente
-La reattività del nucleofilo
-Il solvente in cui avviene la reazione
Natura del gruppo uscente
Lo stadio determinante da un punto di vista cinetico per la
SN1 è quello di formazione del carbocatione dove deve
rompersi il legame C-alogeno. Per cui la natura del gruppo
uscente gioca un ruolo determinante.
Le basi deboli sono buoni gruppi uscenti in quanto stabili
Fattori che influenzano le
reazioni SN1
-La natura del gruppo uscente
-La reattività del nucleofilo
-Il solvente in cui avviene la reazione
La reattività del nucleofilo
Poiché il Nu entra in gioco nel secondo
stadio, la reattività del Nu non ha effetto
sulla velocità della reazione
Fattori che influenzano le
reazioni SN1
-La natura del gruppo uscente
-La reattività del nucleofilo
-Il solvente in cui avviene la reazione
Ruolo del solvente
Le
reazioni
di
sostituzione
nucleofila
avvengono
generalmente in solventi polari.
I solventi polari sono distinti in protici e aprotici.
Protici: presentano gruppi-OH sono quindi donatori di legami
a idrogeno (esempi: H2O e alcoli).
Aprotici: non sono donatori di legame a idrogeno (esempi:
DMSO e DMF).
Fenomeno della solvatazione in un solvente protico:
I solventi protici, capaci di formare legami a idrogeno possono
solvatare sia anioni (X-) che cationi (R+) grazie ad interazioni di tipo
elettrostatico.
Le molecole di solvente orienteranno il loro polo positivo (atomi di H)
verso gli anioni e il loro polo negativo (atomi di Ossigeno) verso i cationi.
Fenomeno della solvatazione in un solvente aprotico:
I solventi aprotici solvatano meglio le specie cariche positivamente.
Le molecole di solvente si dispongono in maniera tale che gli atomi di
ossigeno siano rivolti verso le specie cariche positivamente (K+).
SN1 Effetto del solvente
Meccanismo della reazione SN1
a)
Intermedio carbocationico
b)
I solventi protici sono buoni solventi per effettuare reazioni SN1
Essi favoriscono la scissione eterolitica del legame C-X dell’alogeno alcano
per formare un anione X- ed un carbocatione perché entrambe le specie
vengono solvatate.
H2O
CH3OH
CH3CH2OH
I solventi aprotici non sono buoni solventi per effettuare reazioni SN1.
Essi sono incapaci di promuovere la formazione di carbocationi in quanto
possono solvatare efficacemente solo il carbocatione mentre il gruppo
uscente (anione) risulterebbe non solvatato.
Dimetilsolfossido (DMSO)
Dimetilformammide (DMF)
Acetonitrile (CH3CN)
SN2 Effetto del solvente
I solventi protici non sono buoni solventi per effettuare reazioni SN2.
Essi infatti sono capaci di solvatare sia cationi che anioni, per cui essi
solvatano il nucleofilo che così ha difficoltà a prendere parte alla
reazione
I solventi aprotici sono buoni solventi per effettuare reazioni SN2.
Essi infatti sono capaci di solvatare solo cationi e non anioni, per cui
essi solvatano il catione di una coppia ionica (Na+ OH-), lasciando
l’anione “nudo” e perciò molto Nucleofilo e reattivo
Confronto tra SN2 e SN1
Riepilogo della reattività degli
alogenuri alchilici