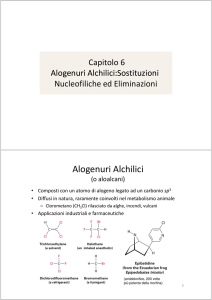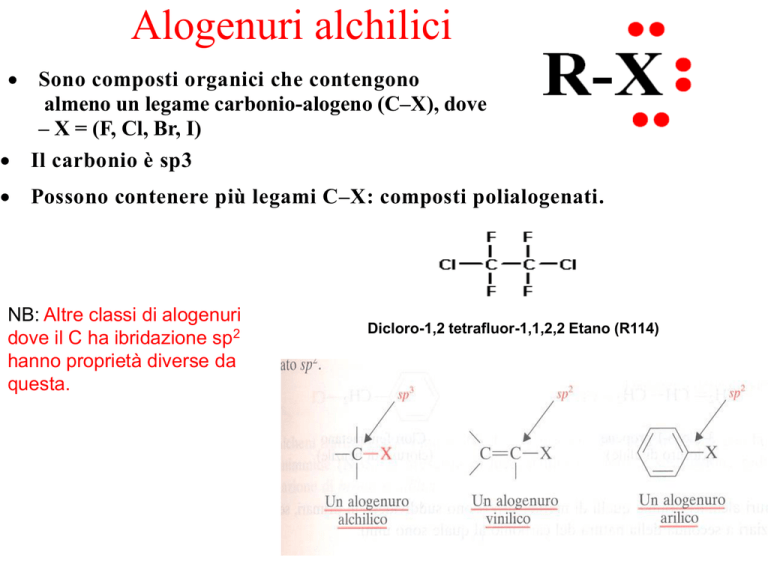
Alogenuri alchilici
Sono composti organici che contengono
almeno un legame carbonio-alogeno (C–X), dove
– X = (F, Cl, Br, I)
Il carbonio è sp3
Possono contenere più legami C–X: composti polialogenati.
NB: Altre classi di alogenuri
dove il C ha ibridazione sp2
hanno proprietà diverse da
questa.
Dicloro-1,2 tetrafluor-1,1,2,2 Etano (R114)
3
Proprietà e usi
• Diffusi in natura, ma raramente coinvolti nel
metabolismo animale
•Clorometano (CH3Cl) rilasciato da alghe, incendi,
vulcani.
• Applicazioni industriali e farmaceutiche come solventi
resistenti al fuoco, propellenti aerosol,refrigeranti,
composti farmaceutici e precursori.
CH3CH2Cl
CH3CH2Br CF3CCl2Br CCl2F2
CF2CHCl
cloroetano
bromoetano
alotano
(Freon-12) (Freon 22)
(anestetico locale) (fumigante) (anestetico)
Gas refrigeranti
Pesticidi
3
Regole IUPAC per la Nomenclatura degli Alogenuri Alchilici
1.Trovare e nominare la più lunga catena di atomi di carbonio.Se è presente un
legame multiplo bisogna scegliere la catena più lunga che lo contiene.
2.Numerare la catena partendo dall'atomo di carbonio terminale più vicino ad un
sostituente, sia esso un gruppo alchilico o un alogeno.
3.Identificare e nominare i gruppi e gli atomi di alogeno attaccati a questa catena.
4.Designare la posizione di ogni gruppo o atomo sostituente con l'appropriato
numero e nome.
5.Assemblare il nome, elencando i gruppi in ordine alfabetico. I prefissi di, tri, tetra,
etc., usati per designare più di un gruppo dello stesso tipo, non sono considerati ai
fini dell'elencazione in ordine alfabetico.
ESEMPI
IUPAC
“alogenoalcano”
CH2Cl2
diclorometano
CHI3
triiodometano
CBr 4
tetrabromometano
Comune
“alchil alogenuro”
metilene dicloruro
iodoformio
carbonio tetrabromuro
CH3Br
bromometano
metil bromuro
CCl2F2
diclorodifluorometano
Freon-12
Classificazione
Struttura
Poli(tetrafluoroetene)
V. Preparazioni
Alchil alogenuri:
– da alcheni per addizione di acidi alogenidrici HCl, HBr, HI
– da alcani e Cl2 o Br2, calore o luce
– da alcoli per reazione con acidi alogenidrici
Alchil dialogenuri:
– da alcheni per addizione anti di bromo e cloro
8
IV. Proprietà fisiche
Gli isomeri ramificati hanno forma più compatta,
diminuita area di contatto, diminuita forza di
attrazione di Van der Waals e più bassi p.eb.
CH3CH2CH2CH2Br
p.eb. 100°C
(CH3)3CBr
p.eb. 72°C
•Insolubili in H2O perché non formano legami ad idrogeno.
8
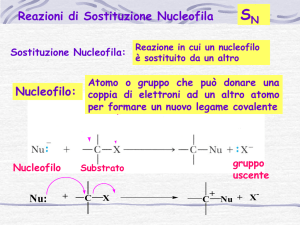
Reattività di R-X
Sostituzione Nucleofila
Il nucleofilo Y sostituisce X nel legame con il carbonio:
Sostituzione nucleofila: Esistono 2 possibili meccanismi:
•meccanismo sincrono di formazione del legame C-Nu e rottura del legame CX (reazione SN2).
Sostituzione nucleofila SN2
•meccanismo a due stadi: rottura eterolitica del legame C-X e formazione di un
carbocatione. Conseguente attacco del nucleofilo (reazione SN1).
Sostituzione nucleofila SN1
Reazione SN2
•La velocità di reazione dipende dalla concentrazione dell’alogenuro alchilico e del
nucleofilo (cinetica bimolecolare).
•La velocità di reazione diminuisce all’aumentare delle dimensioni dell’alogenuro
alchilico.
•Nel caso di un alogenuro alchilico chirale, il prodotto ha la configurazione invertita
rispetto a quella del reagente.
• Meccanismo delle Sn2
•Tutte le evidenze sperimentali sono spiegate ammettendo una reazione a
singolo stadio dove sia nucleofilo che substrato partecipano alla formazione
della stato di transizione.
•Nello stato di transizione il carbonio è pentacoordinato: forma 3 legami
completi e 2 legami parziali.
•E’ quindi chiaramente una specie molto affollata.
La struttura dell’alogenuro alchilico
• Maggiore è l’affollamento al carbonio che subisce
sostituzione, maggiore è l’energia di attivazione, più
lenta è la reazione.
• Gli alogenuri alchilici meno sostituiti sono più reattivi
in una reazione SN2
Attacco del nucleofilo: da retro
Se l’alogenuro alchilico è chirale?
Reazione SN1
• La velocità di reazione dipende solo dalla concentrazione dell’alogenuro
alchilico (cinetica monomolecolare).
• La velocità di reazione aumenta all’aumentare delle dimensioni dell’alogenuro
alchilico.
• Nel caso di un alogenuro alchilico chirale, si forma una miscela racemica.
Meccanismo SN1
Stabilità dei carbocationi
L’ordine di stabilità può essere spiegato attraverso effetti induttivi e di iperconiugazione.
•Gli effetti induttivi sono effetti induttivi che agiscono lungo i legami e sono causati da
differenze in elettronegatività degli atomi.
• I gruppi alchilici sono elettron donatori e stabilizzano una carica positiva proporzionalmente al
loro numero.
metile
1°
2°
stabilità
3°
Stabilità dei carbocationi
2. Reattività di alogenuri alchilici: SN
Stabilità di R+ : 3º > 2º >> 1º > CH3+
Reattività di R–X verso la SN1: 3º > 2º >> 1º > CH3X
CH3 +
1º R+
2º R+ benzilico 1°, allilico 1°
3º R+ benzilico 2°, allilico 2°
32
Reattività S N 1: Substrati Allilici e Benzilici
36
Reattività S N 1: Solvente
• Solventi polari (acqua, metanolo) favoriscono la S N 1 rispetto
a solventi apolari (cloroformio, etere)
• I solveti polari stabilizzano (solvatano) l’intermedio carbocationico
38
2. Reattività di alogenuri alchilici
I. Sostituzione Nucleofila SN
C. Due meccanismi limite
generale: velocità = k1[RX] + k2[RX][Y–]
aumenta k1
v
RX = CH3X 102030
SN2
aumenta k2
SN1
k1 ~ 0
k2 ~ 0
velocità = k2[RX][Y–]
(bimolecolare)
velocità = k1[RX]
(unimolecolare)
SN2
SN1
[Y–]
[RX] cost
16
Riassunto:
Nu molto buoni : I- , HS-, RS-, H2Nbuoni: Br -, HO-, RO-, CNabbastanza: NH3 , Cl-, F-, RCO2cattivi: H2O, ROH
SN2
•Primari o metile
• Nucleofilo forte
• Solvente polare aprotico
•v = k[RX][Nu]
•Inversione al carbonio chirale
•Nessun riarrangiamento
SN2 o SN1? •Terziario
SN1
•Nucleofilo debole (può
•essere anche il solvente)
•Solvente polare protico
•v = k[RX]
•Racemizzazione di composti
otticamente attivi
•Prodotti riarrangiati
43
Trasformazioni di gruppi funzionali
alcoli
eteri
esteri
tioli
Nitrili
Alchini
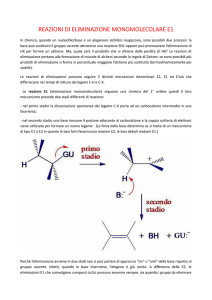
Eliminazione (EN)
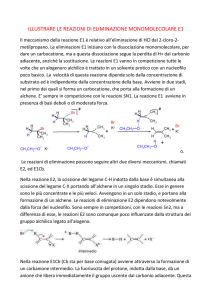
Due ligandi al C vengono eliminati con formazione di C=C Meccanismi E1 ed E2
L’eliminazione avviene secondo 2 distinte modalità indicate come E1 e E2 a
seconda dell’ordine di reazione.
•Spesso reazioni di eliminazione e sostituzione avvengono contemporaneamente,
a partire dagli stessi reagenti (nucleofilo e substrato).
• La prevalenza dell’una sull’altra dipende dalla struttura del nucleofilo, del
substrato e dalle condizioni di reazione.
Reazione di Eliminazione: il meccanismo E1
Procede in due passaggi:
• Formazione Carbocatione (come in SN1)
• Il carbocatione PERDE UN PROTONE da un atomo di carbonio adiacente
al carbonio con carica positiva (E1)
Descrizione degli orbitali coinvolti in E1
Reazione di Eliminazione: il meccanismo E2
•La reazione E2 procede in UN SOLO PASSAGGIO.
•Rottura e formazione del nuovo legame avvengono contemporaneamente.
•I legami H˗˗C˗˗C˗˗L (gruppo uscente)sono sullo stesso piano;
• H ed L sono in posizione ANTI.
Descrizione degli orbitali coinvolti in E2
E1 o E2?
E1
Terziario > Secondario
Base debole
Solvente ionizzante
v = k[alogenuro]
Prodotto di Saytzeff
Nessuna geometria richiesta
Prodotti di riarrangiamento
E2
Terziario > Secondario
Richiesta base forte
Polarità solvente non
importante
v = k[alogenuro][base]
Prodotto di Saytzeff
Gruppi uscenti coplanari (anti)
Nessun riarrangiamento
53
Competizione tra sostituzione ed eliminazione
Le reazioni di sostituzione e di eliminazione possono competere tra loro:
ALOGENURI TERZIARI: SN1, E1, E2
In presenza di
nucleofili deboli
e solventi polari
In presenza di
nucleofili forti
e solventi meno
polari
ALOGENURI PRIMARI: SN2 e E2
•SN2 generalmente prevale nettamente;
• in caso di nucleofili ingombranti e basici si ha E2.
ALOGENURI SECONDARI : SN1, SN2 , E1 e E2
•La distribuzione dei prodotti dipende dal nucleofilo e dalle
condizioni di reazione.
Sostituzione o Eliminazione?
La forza del nucleofilo determina l’ordine:
Nucleofilo forte reagirà SN2 o E2.
Alogenuri primari di solito SN2.
Alogenuri terziari miscela di SN1, E1 o E2.
Alta temperatura favorisce l’eliminazione.
Basi ingombranti favoriscono l’eliminazione.
Buoni nucleofili, ma basi deboli favoriscono la
sostituzione.
53
53
Reagenti organometallici
Sono sostanze molto reattive caratterizzate dalla presenza di un legame tra un atomo di
carbonio ed un metallo.
I composti organometallici hanno cambiato la storia della chimica organica grazie alla
loro capacità di attivare l’atomo di carbonio cui il metallo è legato, rendendo possibili
reazioni che portano alla formazione di nuovi legami C–C estremamente importanti, in
quanto aumentano la complessità della molecola.
Reattivi di Grignard
•Quando un atomo di carbonio è legato a un metallo si comporta da nucleofilo.
• Il legame Carbonio-Metallo è polarizzato con densità di carica negativa verso il
carbonio in quanto la maggior parte dei metalli sono meno elettronegativi del carbonio
composti di organomagnesio, chiamati
comunemente reattivi di Grignard, contengono il
legame carbonio-magnesio e sono tra i più
utilizzati composti organometallici.
François Auguste Victor Grignard (Cherbourg, 6 maggio
1871 – Lione, 12 dicembre 1935) è stato un chimico
francese, Premio Nobel nel 1912 per la scoperta dei
composti di alchilmagnesio
Preparazione dei reattivi di Grignard
I reattivi di Grignard si preparano per
trattamento di un alogenuro alchilico
con magnesio metallico in solvente
anidro.
I solventi utilizzati sono eteri come
THF o dietil etere.
I reattivi di Grignard sono basi molto
forti e reagiscono con gli acidi
portando alla formazione di un alcano.
reagiscono anche con l’acqua portando alla formazione di un alcano per cui il solvente
utilizzato nella formazione del Grignard deve essere assolutamente anidro.
R-Mg-X + H2O → R-H +MgX + OHI solventi utilizzati nella formazione del Grignard devono essere assolutamente anidri
Tipi di alogenuri
Tutti gli alogenuri alchilici, vinilici e arilici
possono essere utilizzati per preparare
composti organomagnesio.
Reazioni dei reattivi di Grignard
Il legame carbonio-magnesio è covalente polare: il carbonio
-più elettronegativo- reca una parziale carica negativa e il
magnesio -più elettropositivo- una parziale carica positiva
Quindi il carbonio a carattere carbanionico reagisce con gli elettrofili.
Altre Reazioni
+ MgX2