ILLUSTRARE LE REAZIONI DI ELIMINAZIONE MONOMOLECOLARE E1
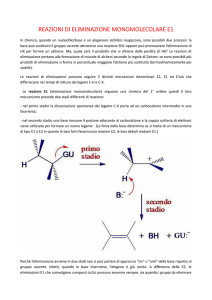
Il meccanismo della reazione E1 è relativo all’eliminazione di HCl dal 2-cloro-2metilpropano. Le eliminazioni E1 iniziano con la dissociazione monomolecolare, per
dare un carbocatione, ma a questa dissociazione segue la perdita di H+ dal carbonio
adiacente, anziché la sostituzione. Le reazioni E1 vanno in competizione tutte le
volte che un alogenuro alchilico è trattato in un solvente protico con un nucleofilo
poco basico. La velocità di questa reazione dipende solo dalla concentrazione di
substrato ed è indipendente dalla concentrazione della base. Avviene in due stadi,
nel primo dei quali si forma un carbocatione, che porta alla formazione di un
alchene. E’ sempre in competizione con le reazioni SN1. La reazione E1 avviene in
presenza di basi deboli o di moderata forza.
o.
Le reazioni di eliminazione possono seguire altri due diversi meccanismi, chiamati
E2, ed E1Cb.
Nella reazione E2, la scissione del legame C-H indotta dalla base è simultanea alla
scissione del legame C-X portando all’alchene in un singolo stadio. Esse in genere
sono le più concentrate e le più veloci. Avvengono in un solo stadio, e portano alla
formazione di un alchene. Le reazioni di eliminazione E2 dipendono notevolmente
dalla forza del nucleofilo. Sono sempre in competizioni, con le reazioni Sn2, ma a
differenza di esse, le reazioni E2 sono comunque poco influenzate dalla struttura del
gruppo alchilico legato all’alogeno.
Nella reazione E1Cb (Cb sta per base coniugata) avviene attraverso la formazione di
un carbanione intermedio. La fuoriuscita del protone, indotta dalla base, dà un
anione che libera immediatamente il gruppo uscente dal carbonio adiacente. Questa
reazione è comune nei substrati che hanno un cattivo gruppo uscente, come –OH. Il
cattivo gruppo uscente svantaggia le possibili alternative E1 ed E2, nel frattempo il
gruppo carbonilico rende l’idrogeno adiacente eccezionalmente acido, in seguito alla
consolidamento per risonanza dell’anione intermedio.
Essere in grado di distinguere questi tre tipi di reazioni è molto difficile, e spesso
bisogna usare la cinetica chimica (ramo della chimica che studia la velocità con cui
avviene una reazione chimica, e tutti i fattori che possono influenzarla) e la chimica
computazionale (ramo della chimica che si occupa dello sviluppo dei modelli
matematici ,in grado di simulare sistemi chimici).
Oltre a questi tre tipi di reazioni, ne esistono altre due: La reazione Sn2 e la reazione
Sn1.
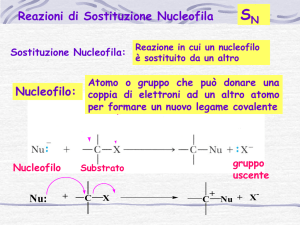
La reazione Sn2 è un processo in un solo stadio, che avviene quando il nucleofilo
attacca il substrato entrando a 180⁰ rispetto al gruppo uscente. Quando il nucleofilo
entra da una parte della molecola , la coppia di elettroni, presenti sul nucleofilo Nu:che spinge fuori, dalla parte opposta ,il gruppo uscente X:-. Questo gruppo porta via
con sé la coppia di elettroni del legame C-X. Nello stato di transizione della reazione,
si ha la parziale formazione del nuovo legame Nu-C, e contemporaneamente, la
parziale rottura del vecchio legame C-X.
La reazione Sn1 avviene soltanto con i substrati terziari, in ambiente neutro o acido,
e in solventi come l’acqua o gli alcoli. Mentre nella reazione Sn2, si ha
contemporaneamente l’allontanamento del gruppo uscente e l’ingresso del
nucleofilo, nella reazione Sn1 , si ha la perdita del gruppo uscente prima dell’attacco
del nucleofilo.. Le reazioni Sn1 possono avvenire soltanto, se come intermedi si
formano dei carbocationi stabili. Più stabile è il carbocatione, più veloce sarà la
reazione Sn1.