REAZIONI E LORO MECCANISMI
• Rivisitazione dei concetti di Omolisi, Eterolisi
• Reagenti Nucleofili e Reagenti Elettrofili
• Addizione elettrofila
• Sostituzione nucleofila
• Eliminazione
• Reazioni radicaliche
Reazioni di chimica organica
Classificabili in 4 categorie
1) ADDIZIONI
2) SOSTITUZIONI
3) ELIMINAZIONI
4) RIARRANGIAMENTI
Meccanismi di reazione
• I meccanismi di reazione rappresentano la
descrizione dei possibili eventi che avvengono a
livello molecolare quando i reagenti si
trasformano in prodotti.
• Ogni meccanismo è proposto sulla base di studi di
cinetica delle reazioni, di analisi spettroscopiche e
di identificazione degli intermedi di reazione.
• Ogni meccanismo proposto deve essere
consistente con tutte le osservazioni sperimentali
relative alla reazione chimica in esame.
Eterolisi ed Omolisi
Due meccanismi fondamentali di rottura di legami covalenti.
ioni
ETERO-LISI
radicali
OMO-LISI
L’eterolisi coinvolge legami
polarizzati.
Comporta la separazione di
cariche opposte
Spesso si ha l’intervento di una
molecola con una coppia solitaria
di elettroni, che forma un legame
con uno dei due atomi.
Carbocationi
L’eterolisi di un legame che coinvolge un atomo di carbonio può
portare alla formazione di due ioni diversi:
CARBOCATIONE : manca di una coppia di elettroni;
ELETTROFILO = cerca elettroni per
completare l’ottetto;
Acido di Lewis - reagisce con Basi di Lewis.
Carbanioni
CARBANIONE : ha carica negativa ed una coppia di
elettroni solitaria
NUCLEOFILO = cerca protoni o centri
con carica positiva
Base di Lewis - reagisce con Acidi di Lewis.
Reagenti nucleofili
hanno un doppietto elettronico libero con una carica
negativa totale o parziale (:)
sono attratti da molecole (o parti di esse) con bassa
densita’ elettronica (carica positiva parziale o totale)
cedono un doppietto elettronico al substrato
sono basi di Lewis
ESEMPI
OH-
Basi di Arrhenius
H2O, NH3
Basi di Broensted
CN-, Cl- Br- NO3- NO2- CH3CO2-
Anioni
Reagenti elettrofili
• sono poveri di elettroni e caratterizzati da una carica
positiva totale o parziale
• sono attratti da molecole (o parti di esse) con alta
densita’ elettronica
• attirano a sé il doppietto elettronico del substrato
• sono acidi di Lewis
Esempi
H+ , Cl+, Br+ , NH4+, RNH3+
NO2+ HSO3+
ioni dei metalli di transizione Ag+, Cu2+, Cr3+, ...
Addizione elettrofila
Al doppio legame
C=C
Reazioni di addizione elettrofila
Reazione caratteristica dei composti contenenti un doppio
legame carbonio-carbonio
Determina la conversione di un legame p ed un legame s
in due legami s.
Alta densità di carica
negativa in corrispondenza
della regione del legame p.
Suscettibilità all’attacco
ELETTROFILO
clicca
Reazioni di addizione elettrofila
•Attacco elettrofilo
• La formazione del
Carbocatione è la
fase che determina
la velocità di
reazione
Reazioni di addizione elettrofila
•somma di alogeni
Es. Cl2
• somma di acidi alogenidrici
Es. HCl
• somma di acqua
• Le reazioni avvengono facilmente a freddo, preferibilmente in
ambiente polare, es. acido acetico.
Regioselettività dell’addizione elettrofila
regola di Markovnikov
Quando sia il reagente elettrofilo sia il substrato
dell’addizione sono asimmetrici, sono teoricamente
possibili 2 prodotti. In realtà se ne ottiene solo uno
ma non
Meno sostituito
Meno sostituito
Meno sostituito
Regioselettività dell’addizione elettrofila
regola di Markovnikov
ma non
Meno sostituito
Stato transizione 1
Stato transizione 2
Carbocatione primario
Carbocatione secondario
clicca
Stabilità dei carbocationi
Mappa dei potenziali elettrostatici dei carbocationi
Terziario
Secondario
N.B. Colore Blu = Carica Positiva
Primario
Metilico
Sostituzione nucleofila (SN)
Un ligando nucleofilo
sostituisce un ligando del C
SN1 e SN2
Alogeno derivati
Composti contenenti un atomo di alogeno
covalentemente legato ad un atomo di carbonio
ibridato sp3.
:
R-X:
:
X = F, Cl, Br, I
H
Cl
H
Cl
C Cl
H
Diclorometano
C H
Cl
Cl
C Cl
Cl
Tetraclorometano
(tetracloruro di carbonio)
H
Clorometano
(cloruro di metile)
H
Cl
C Cl
Cl
Triclorometano
(cloroformio)
Clorofluorocarburi (CFC)
Cl
Cl
C Cl
F
triclorofluorometano
(freon 11)
F
Cl
Cl
C
F
F
diclorodifluorometano
(freon 12)
Cl
C H
Cl
diclorofluorometano
(freon 21)
F
F
Cl
C
H
F
C H
Cl
H
Br
1-cloro-1-bromo-2-trifluoroetano
(alotano)
H C H
Cl
C H
H
cloroetano
(cloruro di etile)
C
C
Cl
Cl
tricloroetene
(trielina)
Reazione di sostituzione nucleofila
Nu:- +
SN
C
X
C
Nu + :X-
Avviene secondo 2 distinte modalità indicate come:
SN1 e SN2 a seconda dell’ordine di reazione
Reazione di Sostituzione Nucleofila
Le reazioni ad attacco nucleofilo avvengono su atomi di C legati a
gruppi (gruppi uscenti) che rendono il C suscettibile all’attacco.
Substrati (R:L) di tali reazioni di sostituzione sono generalmente
gli alogenuri alchilici, o comunque molecole con un “buon” gruppo
uscente (:L-), relativamente stabile e debolmente basico.
ESEMPI
Reazione di Sostituzione Nucleofila
L’analisi della cinetica di reazione consente di distinguere due
tipi diversi di sostituzione nucleofila, dipendenti dalla natura
del nucleofilo, del substrato, del solvente e dalla temperatura di
reazione
Si distinguono quindi reazioni di
SOSTITUZIONE NUCLEOFILA BIMOLECOLARE
(SN2)
SOSTITUZIONE NUCLEOFILA UNIMOLECOLARE
(SN1)
SN2 e SN1 sono descritte da DIVERSI meccanismi di reazione
MECCANISMO di
Sostituzione Nucleofila Bimolecolare (SN2)
Reazioni di sostituzione nucleofila
con cinetiche di 2° ordine possono
essere interpretate dal meccanismo
SN2, proposto da studi di E.D.
Hughes e C. Ingold.
Esso prevede un solo passaggio,
senza formazione di intermedi
fisicamente separabili.
Il nucleofilo attacca da retro il legame
C -L, portando alla formazione di
uno stato di transizione altamente
instabile, e alla simultanea espulsione
del gruppo uscente.
clicca
MECCANISMO di
Sostituzione Nucleofila Bimolecolare (SN2)
• Due molecole (substrato e
nucleofilo) partecipano
CONTEMPORANEAMENTE
al passaggio chiave del
meccanismo (bimolecolare)
• Lo stato di transizione
corrisponde alla barriera
energetica che deve essere
superata affinché la reazione
proceda dai reagenti ai prodotti
• Lo stato di transizione può
essere descritto in termini di
orbitali
MECCANISMO di
Sostituzione Nucleofila Bimolecolare (SN2)
Teoricamente si potrebbero ipotizzare due modalità di attacco
del nucleofilo al substrato:
Frontale:
Da retro:
MECCANISMO di
Sostituzione Nucleofila Bimolecolare (SN2)
In realtà le reazioni con meccanismo SN2 sono
STEREOSPECIFICHE e quindi l’attacco del nucleofilo
avviene esclusivamente da retro, inducendo una
INVERSIONE della configurazione del substrato.
MECCANISMO di
Sostituzione Nucleofila Bimolecolare (SN2)
Il meccanismo SN2, proposto da
Hughes e Ingold, spiega anche
la diversa reattività di substrati
il cui gruppo alchilico è metilico,
oppure un carbonio primario,
secondario o terziario.
Ed anche l’effetto dovuto
a ramificazioni della catena
carboniosa in prossimità del
Carbonio reattivo.
Effetto C 1°, 2° o 3°
Effetto della ramificazione
Effetto della ramificazione
MECCANISMO di
Sostituzione Nucleofila Unimolecolare (SN1)
Reazioni di sostituzione nucleofila con
cinetica di 1° ordine sono spiegate dal
meccanismo SN1.
E’ un processo che implica più passaggi
Analisi cinetica di una reazione di
sostituzione nucleofila (SN1)
(CH3)3CCl + OH-
(CH3)3COH + Cl-
La velocità iniziale di formazione dell’alcol
dipende solo dalla concentrazione del 2-cloro2metilpropano, ed è indipendente da quella
dell’idrossile.
Vi = K[(CH3)3CCl]
UNIMOLECOLARE,
due STADI INTERMEDI.
Meccanismo di Sostituzione Nucleofila Unimolecolare (SN1)
Comporta stadi intermedi con
livelli energetici diversi
Non è una reazione
stereochimica
Racemizzazione del prodotto
più veloce quando
il gruppo alchilico del
substrato
è terziario, (STABILITA’ DEI
CARBOCATIONI)
I meccanismi SN1 e SN2 a confronto
Il destino di una sostituzione nucleofila è controllato da:
• fattori elettronici (stabilità del carbocatione, caratteristiche del solvente)
• fattori sterici (ingombro dei sostituenti)
“Forza” dei nucleofili
Sostituzione elettrofila (SE)
Un ligando elettrofilo
sostituisce un ligando del C
Solo nei composti aromatici
Es.: Alogenazione, nitrazione,
solfonazione e alchilazione
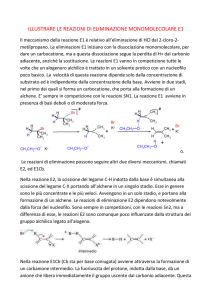
Eliminazione (EN)
Due ligandi al C vengono
eliminati con formazione di
C=C
E1 ed E2
Reazione di eliminazione
H
Nu:- +
C
E
C
X
C=C
+ NuH + X:
Avviene secondo 2 distinte modalità indicate come:
E1 e E2 a seconda dell’ordine di reazione
REAZIONI DI ELIMINAZIONE
Spesso reazioni di eliminazione e sostituzione avvengono
contemporaneamente, a partire dagli stessi reagenti (nucleofilo e
substrato). La prevalenza dell’una sull’altra dipende dalla
struttura del nucleofilo, del substrato e dalle condizioni di
reazione.
Si distinguono due principali meccanismi di eliminazione:
E1 (unimolecolare)
E2 (bimolecolare)
Reazione di Eliminazione: il meccanismo E1
Procede in due passaggi:
a) Formazione
Carbocatione
(come in SN1)
Il carbocatione
PERDE UN
PROTONE
da un atomo
di carbonio
adiacente al
carbonio con
carica
positiva (E1)
Reazione di Eliminazione: il meccanismo E1
Descrizione degli orbitali coinvolti in E1
Reazione di Eliminazione: il meccanismo E2
La reazione E2 procede in
UN SOLO PASSAGGIO.
Rottura e formazione del
nuovo legame avvengono
contemporaneamente.
I legami H C C L (gruppo uscente)
sono sullo stesso piano; H ed L
sono in posizione ANTI. (Mov-1; Mov-2)
Reazione di Eliminazione: il meccanismo E2
Descrizione degli orbitali coinvolti in E2
Competizione tra sostituzione ed eliminazione
Le reazioni di sostituzione e di eliminazione possono competere
tra loro. In particolare, nel caso substrati quali gli alogenuri
alchilici
ALOGENURI TERZIARI: SN1, E1, E2
In presenza di
nucleofili deboli
e solventi polari
In presenza di
nucleofili forti
e solventi meno
polari
Competizione tra sostituzione ed eliminazione
ALOGENURI PRIMARI: SN2 e E2
SN2 generalmente prevale nettamente, in caso di nucleofili
ingombranti e basici si ha E2.
Competizione tra sostituzione ed eliminazione
ALOGENURI SECONDARI: SN1, SN2 , E1 e E2
La distribuzione dei prodotti dipende dal nucleofilo e
dalle condizioni di reazione.
Reazioni Radicaliche
Scissione omolitica del legame
formazione di radicali liberi
instabili
Spesso reazione a catena
Reazioni Radicaliche
radicali
La rottura OMOLITICA di un legame covalente (generalmete
tramite surriscaldamento o irradiazione) genera specie chimiche
molto labili dette RADICALI, caratterizzate dalla presenza di un
singolo elettrone spaiato (.)
Tali intermedi hanno una notevole tendenza a reagire con le
molecole con cui collidono, in modo da appaiare l’elettrone
singolo (reazioni radicaliche)
Le reazioni radicaliche sono ubiquitarie nei sistemi viventi (O2, NO,
O2-) ed utilizzate anche dall’industria chimica (polimerizzazione)
Energia di Dissociazione Omolitica (DH°) di
alcuni legami singoli a 25°C.
Stabilità dei radicali
Sono specie molto instabili. Tendenzialmente esiste una
proporzionalità inversa tra valore di DH° e stabilità del radicale
a)
b)
Reazioni radicaliche: alogenazione degli alcani
Reazione
Meccanismo (passaggi di propagazione)
Meccanismo
(terminazione della catena)
Reazioni radicaliche: l’addizione di
Bromuro d’idrogeno agli alcheni
in assenza
di perossidi
Meccanismo
Reazioni radicaliche:
polimerizzazione degli alcheni
Unità monomeriche
Etilene
(monomero)
• Mov Radicalica
Polietilene
(polimero)
Polimeri degli alcheni
Monomero
FINE