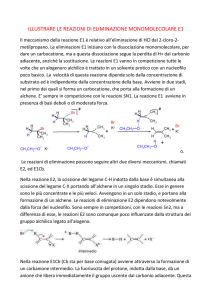
Tema -­‐ valutazione tra pari D1) Illustrare le reazioni di sostituzione nucleofila monomolecolare SN1. Le reazioni di sostituzione nucleofila hanno molta rilevanza nella chimica e sono le più comuni . Nelle reazioni di sostituzione nucleofila un atomo o un gruppo uscente di una molecola viene sostituito da un altro atomo o gruppo uscente. Gli alogenuri alchilici (R -­‐ X) subiscono le reazioni di sostituzione nucleofila essendo elettrofili. Le reazioni di sostituzione nucleofila furono scoperte nel 1986 da Paul Walden; egli appurò che gli acidi (+)-­‐ e (-­‐
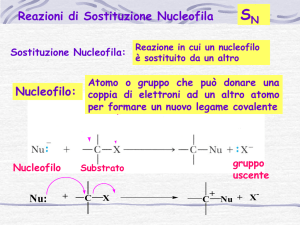
)-­‐ malici potevano essere convertiti l'uno nell'altro: riuscìa trasformare l'acido(-­‐)-­‐ malico in acido (+)-­‐malico, constatando che alcune reazioni avvenute nel ciclo di Walden erano avvenute con inversione , in poche parole, attraverso un cambiamento della configurazione del centro chirale. In ciascun momento durante le trasformazioni del ciclo di Walden, che oggi chiamiamo reazioni di sostituzione nucleofila, avviene la sostituzione di un nucleofilo (ione cloruro, Cl-­‐ , o ione idrossido, OH-­‐ ) da parte di un altro nucleofilo. R-­‐X + Nu:-­‐ -­‐> R-­‐Nu + X:-­‐ Le sostituzioni nucleofile possono avvenire con due meccanismi chiamati reazione Sn1 e reazione Sn2. Entrambe le trasformazioni che si realizzano nelle sostituzioni nucleofile sono le stesse: un nucleofilo (Nu:, o Nu:-­‐) reagendo con un substrato R-­‐X, sostituisce il gruppo uscente X:-­‐ per dare poi il prodotto finale R-­‐Nu. Se il nucleofilo è neutro (Nu:), il prodotto sarà carico positivamente, invece, se il nucleofilo è carico negativamente (Nu:-­‐) il prodotto sarà neutro Nu:-­‐ + R-­‐X -­‐> R-­‐Nu + X:-­‐ Nu: + R-­‐X -­‐> R-­‐Nu+ + X:-­‐ Sostituzione nucleofila monomolecolare Sn1 La reazione nucleofila Sn1 avviene soltanto con i substrati terziari, in ambiente neutro o acido e in solventi protici come acqua e alcoli. R-­‐Br + H2O -­‐> R-­‐OH + HBr Nella reazione Sn1, un alogeno rimpiazza il gruppo -­‐OH nonostante sia un pessimo gruppo uscente e l'ordine di reattività è 3°>2°>1°. Nella reazione Sn1 si ha la perdita spontanea del gruppo uscente prima dell'attacco del nucleofilo; questa perdita genera un carbocatione intermedio che reagisce col nucleofilo per dare il prodotto finale di sostituzione. La reazione Sn1 si divide in due stadi: il primo stadio determina la velocità totale della reazione e il secondo stadio prevede la formazione di un carbocatione intermedio. R-­‐X -­‐> R+ + X-­‐ (stadio lento) R+ + Nu-­‐ -­‐> R-­‐Nu (stadio veloce) nel secondo stadio il nucleofilo si attacca al carbocatione. Lo stadio lento non coinvolgendo il nucleofilo fa capire perchè la velocità iniziale non cambia cambiando il nucleofilo. Con la formazione dell'intermedio carbocationico è lo stadio lento della reazone che condiziona e limita la velocità dell'inteo processo. L'equazionedi velocità non contiene quindi la concentrazine del nucleofilo ed è la seguente: v=k ·∙ [R-­‐Lg]. Questo è un classico esempio di reazione Sn1 con il bromuro di t-­‐butile con lo ione idrossido OH-­‐: (CH3)3C-­‐Br + OH-­‐ -­‐> (CH3)3C-­‐OH + Br-­‐ Durante il primo stadio della reazione (stadio lento) avviene la formazione del catione t-­‐butilico (CH3)3C+ Durante il primo stadio della reazione (stadio veloce) avviene l'attacco nucleofilo (OH-­‐) al catione t-­‐butilico. Si può notare che il primo stadio della reazione costituisce lo stadio lento della reazione ( dato che ha una unergia di attivazione maggiore) e determina la velocità dell'intero processo. La stereochimica delle reazioni Sn1 I carbocationi nelle reazione Sn1 sono piani, ibridati sp2 esono specie achirali. Il carbonio con carica positiva potrà subire l'attacco del nucleofilo con uguale probabilità su tutte e due le facce. Come risultato si otterrà la formazione di una miscela 50:50 di due enantiomeri (miscela racemica).