Alogenuri Alchilici
R-Cl
R-Br
R -I
R-F
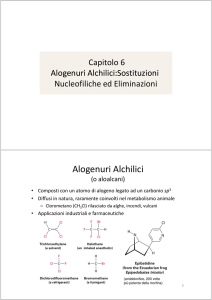
Alogenoalcani
• I composti contenenti un atomo di alogeno
legato covalentemente ad un atomo di
carbonio ibridato sp3 sono chiamati
alogenoalcani o alogenuri alchilici.
alchilici
• Il simbolo generale per un alogenuro
alchilico è R-X dove X può essere Fluoro,
Cloro, Bromo o Iodio
R- F
R-Cl
R- X
R-Br
R-I
Nomenclatura
• Nella nomenclatura IUPAC l’atomo di
alogeno viene visto come un sostituente
dell’alcano.
Br
CH3CH2
I
1-iodoetano
ioduro di etile
2-bromobutano
bromuro di isobutile
• La nomenclatura comune identifica i più
semplici come alogenuri di alchile
considerando le catene alchiliche come
sostituenti degli acidi alogenidrici
Tipi di alogenuri
• Anche per gli alogenuri si usa la
denominazione metilico, primario,
secondario e terziario a seconda del tipo di
atomo di carbonio legato all’atomo di
alogeno
R
R C X
R
alogenuro terziario
R
R C X
H
alogenuro secondario
R C X
H2
alogenuro primario
H3C X
alogenuro metilico
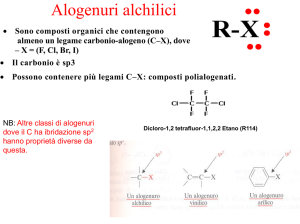
Proprietà
• Il legame C-X è polarizzato:
– A causa della maggiore elettronegatività degli
alogeni rispetto al carbonio.
– L’atomo di alogeno possiede una parziale carica
negativa (δ-) e l’atomo di carbonio una parziale
carica positiva (δ+).
Proprietà
• Gli alogenoalcani hanno punti di
ebollizione maggiori rispetto ai
corrispondenti alcani.
– Questo a causa alle interazioni
dipolo-dipolo che si vengono a creare
tra le molecole degli alogenoalcani.
– All’aumentare della grandezza
dell’alogeno aumentano anche le
interazioni molecolari
– Gli atomi più grandi sono infatti più
polarizzabili
Reattività
• L’atomo di carbonio polarizzato
positivamente è elettrofilo ed è soggetto
all’attacco da parte di anioni ed altre
specie nucleofile.
nucleofile
Nu
• Il nucleofilo sostituirà l'atomo di alogeno
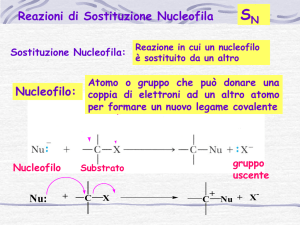
Sostituzione nucleofila
• Nella descrizione della reazione, il reagente
organico (alogenuro) viene detto substrato.
substrato
• L'attacco del nucleofilo promuoverà il distacco
dell’atomo di alogeno che si porterà via gli
elettroni di legame.
• Il risultato sarà la sostituzione dell’atomo di
alogeno, che viene detto gruppo uscente,
uscente con il
nucleofilo.
Nu- +
R X
δ+ δ−
Nu R
+
X-
Sostituzione nucleofila
• I nucleofili possono essere carichi negativamente
come :OHNu- +
Nucleofilo
R X
Nu R
+
X-
Gruppo Uscente
Substrato
• o neutri, come :NH3 e in questo caso di nucleofili
neutri la reazione terminerà con l’espulsione di un
protone
HNu: +
Nucleofilo
R X
Substrato
+
HNu R
+ X-
Gruppo Uscente
Nu R + H+
Sostituzione nucleofila
• A seconda del tipo di nucleofilo usato si
possono formare prodotti diversi
Nucleofilo
Prodotto
-OH
R-OH
Alcool
-OR’
R-OR’
Etere
-SR’
R-SR’
Solfuro
CI-
R-CI
Cloruro alchilico
Br-
R-Br
Bromuro alchilico
NH3
R-+NH3 ⇆ RNH2 + H+
Ammina
Sostituzione nucleofila
• Il meccanismo della reazione dipende da
vari fattori come il tipo di substrato,
substrato il
tipo di nucleofilo,
nucleofilo il tipo di gruppo uscente
ed il tipo di solvente usati.
• I due meccanismi con i quali può avvenire
tale reazione prendono il nome di SN2 e
SN1 dove SN sta per sostituzione
nucleofila
SostituzioneNucleofila
Bimol.MOV
Meccanismo SN2
• Nel meccanismo SN2 la reazione avviene in un unico stadio:
stadio
HO-
H
H
H
C Br δ−
δ+
H H δ−
HO C Br
δ−
H
#
H
HO C
H
+ Br-
H
• Il nucleofilo attacca il substrato polarizzato dalla parte
opposta del gruppo uscente forzando ad uscire l’atomo di
alogeno che se ne va portando con sé gli elettroni di legame.
• Nello stato di transizione il legame Nu-C è parzialmente
formato e quello C-X è parzialmente rotto e la carica
negativa è suddivisa tra i due gruppi, entrante ed uscente.
• Al termine si la completa formazione del legame Nu-C e la
completa rottura di quello C-X.
Meccanismo SN2
• La sigla SN2 sta ad indicare che la reazione una
Sostituzione Nucleofila Bimolecolare.
Bimolecolare
• Nello stadio fondamentale della reazione infatti ci
sono due specie (Substrato e Nucleofilo) che
partecipano alla reazione.
• Poiché la reazione avviene in un unico stadio la
velocità di reazione dipende sia dalla
concentrazione del substrato che dalla
concentrazione del nucleofilo e l’equazione
cinetica è del 2° ordine globale e del 1° ordine
rispetto ad ognuno di essi.
v = k [R-Br ] ⎡⎣OH- ⎤⎦
Diagramma energetico
Punto di attacco
• Una reazione SN2 è spinta dall'attrazione tra la carica
negativa del nucleofilo (in questo caso l'ossigeno carico
negativamente dello ione idrossido) e il centro di carica
positiva dell'elettrofilo (in questo caso la carica
parziale positiva sul carbonio legato al cloro che funge
da gruppo uscente).
Punto di attacco
Tipo di substrato
• Gli alogeno metani (CH3-X) sono i substrati più reattivi,
seguiti dagli alogenuri primari (RCH2-X). La reazione è molto
più lenta per gli alogenuri secondari (R2CH-X) e ancor di più
per i terziari (R3C-X).
• Questo a causa della diminuzione di accessibilità dell’atomo
di carbonio che subisce l’attacco del nucleofilo all’aumentare
del numero di gruppi alchilici legati ad esso.
Ingombro sterico
• All'aumentare dell'ingombro dei sostituenti legati al
carbonio che sta subendo l'attacco nucleofilo diminuisce la
possibilità di accedere al retro del carbonio, con
conseguente diminuzione della velocità della reazione SN2.
SN2QT4.MOV
SN2.MOV
SN2Octane.xyz
Decorso stereochimico
• Nel caso in cui il substrato sia chirale:
HO
H3C
H3C
#
H
C Br
CH2
H3C H
HO C Br
CH2
CH3
CH3
H3C C C Br
H2
H R
H
CH3
+ Br
HO C
H2C
CH3
CH3
HO C C CH3
H2
H
S
La reazione avviene con inversione di configurazione in quanto
il nucleofilo attacca il substrato dalla parte opposta rispetto
al gruppo uscente
Esempio
H
Cl
+ OH*
Cl
Me
HO
H
+ Cl*
H
Et
H
Reagente
(R)
Me
OH
Et
Et
OH
Me
H
Prodotto
(S)
Esempio
CH3SO3
H
Ph
D
H
I
bz
bz
D
OSO2CH3
Reagente
(S)
D
H
+ CH3SO3*
Ph
OSO2CH3
H
D
+ I*
I
D
bz
H
Prodotto
(R)
Meccanismo SN1
• Nel meccanismo SN1 la reazione avviene in due
stadi:
stadi
R
Nu-
R
C X
+
Rδ
δ−
lento
R
R R
C+
R
Nu C
veloce
R
+ X-
R
• Nel primo stadio lento, il gruppo uscente si stacca
portandosi via gli elettroni di legame e generando
un intermedio carbocatione planare (sp2)
• Nel secondo stadio veloce, il nucleofilo reagisce
con il carbocatione portando alla formazione del
prodotto di sostituzione
Meccanismo SN2
• La sigla SN1 sta ad indicare che la reazione una
Sostituzione Nucleofila Monomolecolare.
Monomolecolare
• Allo stadio fondamentale (LENTO) della reazione
infatti partecipa solamente il Substrato che si
dissocia per formare l’intermedio carbocatione.
• La velocità di reazione dipende solo dallo stadio
lento e quindi solo dalla concentrazione del
substrato: l’equazione cinetica è del 1° ordine
rispetto ad esso.
v = k [R-Cl]
Diagramma energetico
Ea2
C)
Ea1
+ Cl- + OH-
Tipo di substrato
• Il processo monomolecolare è veloce su
Substrati terziari, benzilici e allilici che
danno carbocationi stabili mentre è lenta
su substrati secondari; i substrati primari
che non possono dare carbocationi stabili
reagiscono preferenzialmente via SN2
SN1rSN1r-SN1sk
Decorso stereochimico
• Nel caso il substrato sia asimmetrico, si ha
la produzione di un prodotto racemo
perché il carbocatione intermedio è
planare e può subire l’attacco da entrambi i
lati
Esempio
Quali di questi bromoalcani vi aspettate reagisca
via SN1 più velocemente ?
Br
Br
Differenza
• La differenza sostanziale tra una reazione
di sostituzione che segua un meccanismo
SN2 piuttosto che un meccanismo SN1 è
che:
• la SN2 procede in un unico stadio
attraverso uno stato di transizione
• la SN1 procede in due stadi, attraverso un
intermedio carbocatione
SOSITUZIONI
NUCLEOFILE
Confronto
Tipo di substrato
H
H
H
X
R
R
X
H
H
Metilico
Primario
R
R
X
H
Secondario
R
X
R
Terziario
I substrati metilici, primari e
terziari reagiscono più velocemente.
I substrati metilici, primari e molti secondari
reagiscono con il meccanismo SN2
I substrati terziari, ed alcuni secondari attraverso il
meccanismo SN1
Nucleofili
Anioni: I-, Br-, Cl-, F-, OH-, RO-, RS-, R3C-, RCOOMolecole Neutre: R3N, R3P, H2O
Nucleofilo
Reagente
Sostituente
Finale
Br-
HBr
-Br
Cl-
HCl
-Cl
I-
HI
-I
H2O
-OH
OH-
NaOH
-OH
RO-
NaOR
-OR
CN-
NaCN, KCN
-CN
NH3, NR3
-NH2, -NR2
Le SN2 sono favorite da nucleofili anionici
Sostituzione nucleofila
La reazione avviene anche su altri substrati
che portino dei gruppi elettronegativi su
catene alchiliche come
gli alcoli,
alcoli gli eteri,
eteri i tioli.
tioli
δ+
δ−
R OH
Alcol
δ+
δ−
R OR'
Etere
δ−
δ+ R SH
Tiolo
La presenza di buoni gruppi uscenti
sposta il meccanismo a favore della SN1
in quanto sarà più facile che avvenga la
ionizzazione del substrato
Effetto solvente
• I solventi polari protici stabilizzano i composti polari
ed eventuali ioni che si possono formare nel corso
della reazione
– stabilizzano il gruppo uscente;
– stabilizzano il carbocatione che si forma durante il
meccanismo monomolecolare facilitando la dissociazione del
substrato;
– stabilizzano il nucleofilo diminuendone la reattività, in quanto
possono protonarlo o semplicemente solvatarlo
• Aumentando la polarità del solvente e la sua abilità
solvatante, il meccanismo si sposta verso la SN1.
Il processo SN2 è favorito
• Substrati poco ingombrati.
– Su substrati Metilici (CH3X) e Primari (RCH2X)
– Su substrati Secondari (R2CHX) solo con nucleofili
forti
– Mai su substrati Terziari (R3CX)
• Uso di nucleofili forti, anionici.
• Uso di solventi apolari che non favoriscono la
formazione del carbocatione
Il processo SN1 è favorito
• Substrati che portano alla formazione di carbocationi
stabili.
– Su substrati Terziari (R3CX)
– Su substrati Secondari (R2CHX) con nucleofili
deboli
• Uso di nucleofili deboli, spesso neutri.
– Spesso il nucleofilo è lo stesso solvente, come
l’acqua, gli alcoli e gli acidi carbossilici
• Uso di solventi polari protici che stabilizzano il
carbocatione intermedio, il nucleofilo (disattivando
l’attacco via SN2) ed il gruppo uscente.
Esempio
Quali sono i due prodotti di sostituzione attesi in
questa reazione ?
Br
NH2 (1eq)
NaOH
OH
H
N
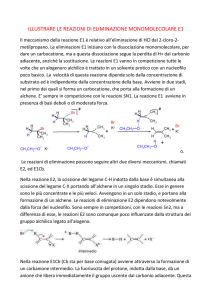
Eliminazioni Nucleofile
Eliminazione ad alchene
• Un alogenoalcano che abbia in β all’atomo di alogeno un
atomo di idrogeno, può reagire con un nucleofilo (che può
anche funzionare da base) anche in modo diverso e cioè
eliminando acido alogenidrico e formando un alchene.
alchene
• Si ha la perdita di H e X da atomi adiacenti e viene quindi
definita: 1,2- o α,β-eliminazione.
• E’ uno dei principali metodi per la sintesi di alcheni
• Questa reazione è in competizione con la sostituzione
nucleofila.
α
H
H3C CH CH CH3
X
β
+ YH3C CH CH CH3 + HY + X-
Meccanismi
• Anche l’eliminazione può avvenire con due
meccanismi diversi:
H C C X
H2 H2
B
-BH)
H
-X*
H
H
E2
H
Eliminazione bimolecolare
R
H C C X
H2
R
-X*
lento
)
H C C R
H2
R
B
-BH)
veloce
H
R
E1
H
Eliminazione monomolecolare
R
Meccanismo E2
• Il meccanismo E2 è un meccanismo concertato in
cui il nucleofilo agisce da base e strappa un
protone aiutando l’uscita dell’alogenuro
H CH2 C X
H2
:B
-BH)
H
H
-X*
H
H
v = k [R − X][B]
• E’ favorita da una forte basicità del reagente e
dalla bassa polarità del solvente
– I solventi polari solvatano e quindi inattivano la base
Meccanismo E1
R
H C C X
H2
R
-X*
lento
)
H C C R
H2
R
B
-BH)
veloce
H
R
H
R
v = k [R − X]
• E’ un processo che avviene in due stadi
• Il primo stadio della E1 è lo stesso della SN1 e porta alla
formazione dello stesso carbocatione intermedio
• Questo nelle eliminazioni si stabilizza espellendo un protone
e formando un legame π anziché addizionando il nucleofilo
• Si formano sempre miscele di prodotti (di sostituzione e di
eliminazione)
Regiochimica
H
H
CH2CH3 - HBr
6%
H
(2)
(2)
Br
H3C
C CH3
H2
H
- HBr
(1)
H (1)
H3C
CH3
94%
H
In entrambi i casi si forma l’alchene più stabile e cioè il più
sostituito o quello delocalizzato
Br
CH2CH3 - HBr
H
87%
H
(2)
(2)
C
H2
C CH3
H2
H (1)
- HBr
(1)
H
H2C
CH3
H
13%
Eliminazione vs.Sostituzione
• In presenza di alogenuri alchilici che reagiscono
con nucleofili si ha sempre competizione fra
sostituzione ed eliminazione che possono avvenire
con due meccanismi diversi
Me
Br
E1/SN1
H
Me C CMe2
- Br*
H
HO*
H )
Me C CMe2
E1
SN1
H
HO*
CMe2
H
Eliminazione
H
Me C CMe2
H OH
Sostituzione
*OH
E2/SN2
H OH
SN2
H
H
Br
Sostituzione
HO*
E2
Br
Eliminazione
Eliminazione vs.Sostituzione
• Alogenuri terziari
– Sostituzione via SN1
– Eliminazione via E1 o E2
• In presenza di nucleofili deboli e solventi
polari la competizione è fra SN1 e E1 e si
ha una miscela di prodotti.
• In presenza di nucleofili forti e solventi
apolari è favorita l’eliminazione con
meccanismo E2.
Eliminazione vs.Sostituzione
• Alogenuri primari
– Sostituzione via SN2
– Eliminazione via E2
– Non può avvenire né la SN1 né la E1 perché non
si può formare il carbocatione
• In presenza di nucleofili molto ingombrati
e fortemente basici si può avere
l’eliminazione con meccanismo E2.
• In presenza di tutti gli altri nucleofili si ha
prevalentemente la sostituzione via SN2.
Eliminazione vs.Sostituzione
• Alogenuri secondari
– Sostituzione via SN1 o SN2
– Eliminazione via E1 o E2
• Si ha sempre una miscela di prodotti.
• La sostituzione è favorita da nucleofili
forti che non siano basi forti (SN2)
• L’eliminazione è favorita dalle basi forti
(E2).
Reazioni biologiche
• Negli ambienti biologici le reazioni di SN avvengono spesso
su un substrato che è un difosfato organico piuttosto che un
alogenuro alchilico.
• Pertanto, il gruppo uscente è lo ione difosfato (PPi)
• La dissociazione di un organodifosfato è una reazione
biologica tipicamente favorita dalla complessazione di un
catione divalente metallico, come Mg2+, che aiuta a
neutralizzare la carica.
O
O
R O P O P O
O
O
2+
Mg
O
dissociazione
R
+
+
O
O P O P O
O
O
2+
Mg
(PPi)
Biosintesi Geraniolo
isopentenil difosfato
PPi
PPi
- PPi
dimetilallil difosfato
C
H
+
C
SN1
+
PPi
H
eliminazione
- H+
geranil difosfato
C
PPi
+
OH2
- PPi
SN1
+
O H
H
- H+
geraniolo
OH
Sintesi Adrenalina
HO H
Gruppo
uscente
HO H
noradrenalina
HO
NH2
HO
HO
+
SN2
HO
NH2
O
N
CH3
S
O
H NH
+ 3
N CH3
H H
adrenalina
N
+
N
O
O
N
NH2
N
S
O
H NH3
O
N
+
OH OH
SAM o S-adenosilmetionina (ione sulfonio)
S-adenosilmonocisteina
OH OH
N
N
Reazioni biologiche di eliminazione
+
B H
:B
H
H
O
CO2-
HO CO2-
HO CO2H
OH
H
OH
H
5-Diidrochinato
O
-
CO2-
H
OH - H2O
H
H OH
O
OH
H
H OH
5-Diidrossichimato
Biosintesi della tirosina
HO
H3N H
+
Tirosina
Reazioni biologiche di eliminazione
3-Idrossibutirril
tioestere
HO H O
H3C
HO H
H3C
SR
C
N
O
SR
- H2O
H
H H
H N
Tioestere crotonile
O
H
+ H+
H N
N
+
H
HO H
H3C
- H+
H3C
O
SR
H
Istidina
(amminoacido nell’enzima)
Biosintesi dei grassi
SR
H
Alogenuri aromatici
• Gli alogenuri vinilici ed arilici non danno reazioni di
sostituzione nucleofila ma le reazioni tipiche dei composti
aromatici.
• Non danno reazioni SN2 perché quando il nucleofilo si
avvicina al carbonio sp2 da retro viene respinto dalla nuvola
elettronica π del doppio legame o dell'anello aromatico.
• Non danno reazioni SN1 perché, il legame carbonio-alogeno
è più corto e più forte poiché l'alogeno è legato ad un
carbonio sp2 ed i carbocationi vinilici ed arilici che si
dovrebbero formare sono altamente instabili.
Cl
Br
Cl
NO2
NO2
OH
2,4-dinitroclorobenzene
p-bromofenolo
clorobenzene