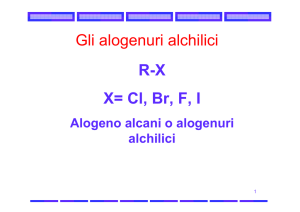
Alogenuri alchilici
1
Reattività di R-X
Legame debole
..
R–X
.. :
X, alta affinità
elettronica,
buon gruppo
uscente, X- o
Xδ∴ R+ o Rδ+
R elettrofilo
attaccabile da
un nucleofilo.
Un nucleofilo
è anche base.
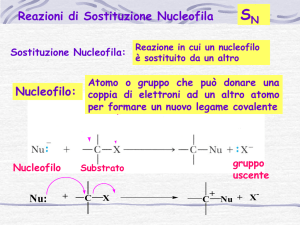
1) Sostituzione Nucleofila
R–X + Nu–
R–Nu + X–
R–X + Nu
R–Nu+ X–
2) β-Eliminazione
β α
H–C–C–X + B–
C=C + HB + X–
Nucleofilo: specie con disponibilità elettronica:
neutro, Nu; carico parzialmente Nuδ– o totalmente Nu– (base)
Elettrofilo: specie con carenza elettronica parziale Eδ+ o totale E+ (acido)
2
Due tipi di reazione
Gli alogenuri alchilici possono reagire con le basi di Lewis
in due modi differenti: sostituzione nucleofila o eliminazione.
H
C
H
δ+
C
δ- X
+ :Y
–
C
C
Y
Sostituzione nucleofila
+ :X
–
Due tipi di reazione
Gli alogenuri alchilici possono reagire con le basi di Lewis
in due modi differenti: sostituzione nucleofila o eliminazione.
H
C
C
+ :Y
–
C
C + H Y + :X
X
β-eliminazione
–
• NUCLEOFILI
5
Sostituzione Nucleofila
–
Y:
δ+
+
R
δ−
X
Y
–
R +: X
il nucleofilo è una base di Lewis (donatore
di coppie di elettroni), può essere carico
negativamente o può essere neutro con
una coppia elettronica disponibile
Nucleofili
.. –
:
HO
..
.. –
:
HS
..
.. –
:
CH3O
..
:N
–
C:
etc.
Nucleofili
.. –
:
HO
..
.. –
:
HS
..
.. –
:
CH3O
..
:N
–
C:
etc.
Non tutti i nucleofili sono anioni. Molti sono neutri.
..
..
: NH3 per esempio
CH3OH
HOH
..
..
Nucleofili
.. –
:
HO
..
.. –
:
HS
..
.. –
:
CH3O
..
:N
–
C:
etc.
Non tutti i nucleofili sono anioni. Molti sono neutri.
..
..
: NH3
CH3OH
HOH
..
..
Tutti i nucleofili, tuttavia, hanno a disposizione
una coppia di elettroni non condivisa e sono
quindi basi di Lewis.
Confronto tra nucleofilicità e basicità
La basicità è una misura di quanto
prontamente un atomo dona la sua coppia
di elettroni al protone (H+) ed è una
proprietà termodinamica.
La nucleofilicità è invece la misura di quanto
prontamente un atomo dona la coppia di
elettroni ad atomi diversi da H+. E’ una
proprietà cinetica
Nucleofilicità
Tipo
Nucleofilo
forte
buono
I-, HS-, RSBr-, HO-,
RO-, CN-, N3NH3, Cl-, F-, RCO2H2O, ROH
RCO2H
medio
debole
debolissimo
Velocità
relativa
>105
104
103
1
10-2
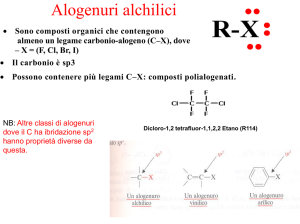
• Gli alogenuri alchilici sono caratterizzati dalla
presenza di un gruppo –X, attaccato
direttamente al carbonio. La sua
elettronegatività non solo fa sì che il legame
C-X sia polarizzato a favore di quest’ultimo
ma comporta anche che tutti i legami C-H,
fino al carbonio in β, siano polarizzati a favore
dei rispettivi carboni.
δ+
δ+
H
H
C
C
H
H
δ+
X
δ−
δ+
13
• Questa situazione spiega la reattività degli alogenuri
alchilici che può essere riassunta in
• 1) sostituzione di X per opera di un nucleofilo
(sostituzione nucleofila)
• 2) allontanamento di un H+ dal carbonio in β con
contemporanea formazione di un doppio legame
carbonio-carbonio e uscita dello ione alogenuro
(eliminazione)
H
H
Nu
C
C
X
H
H
Nu
14
•
•
•
•
Le due diverse reazioni possono avvenire
secondo meccanismi differenti che sono
determinati da
tipo di alogenuri per quanto riguarda sia R
(primario, secondario, terziario) sia X
forza del nucleofilo e sue proprietà basiche
natura del solvente
temperatura
15
• Sia per la sostituzione nucleofila che per la βeliminazione esistono due possibili
meccanismi:
• Sn1
• E1
• Sn2
• E2
16
Il gruppo uscente
Gruppo uscente (GU)…vediamolo più da vicino
In una sostituzione nucleofila il legame che si rompe è
scisso eteroliticamente (cioè i due elettroni del legame si
allontano con uno solo dei due atomi, lasciando l’altro
carente di elettroni) ed il GU si allontana con la coppia di
elettroni formando un anione X:-.
Il GU è una specie stabile, neutra o ionica, ma cosa rende
una specie un buon GU, cioè tale da contribuire a
spostare l’equilibrio verso destra?
È chiaro che X:- è più stabile quando è in grado di
accettare facilmente la coppia di elettroni.
Ma allora un GU è più stabile quanto più è una base
debole.
17
Il gruppo uscente
Caratteristiche generali
•
•
•
•
•
Per quanto detto, nell’esempio già riportato dell’1-bromobutano, la
reazione è reversibile e l’esito dipende da fattori diversi quali il
solvente etc. che vedremo in seguito!
In generale comunque:
lungo la una riga della tavola periodica, la basicità decresce da sinistra
verso destra e pertanto la bontà del GU aumenta
scendendo lungo una colonna della tavola periodica, la basicità
decresce e quindi la bontà del GU aumenta
le basi deboli coniugate degli acidi con pKa < 8 sono ragionevolmente
buoni GU, mentre le basi forti sono di solito dei cattivi GU
l’equilibrio è spostato verso destra quando il GU è una base più
debole del nucleofilo
18
Nucleofilo vs base
• Un confronto utile
Si definisce nucleofilia (con un inglesismo, nucleofilicità) la più o
meno spiccata tendenza delle basi di Lewis a condividere una
coppia di elettroni con un sito elettrofilo.
Ma allora basi e nucleofili sono strutturalmente simili; tuttavia le
prime attaccano i protoni, mentre i secondi attaccano altri atomi
elettrondeficenti.
Generalmente, comunque, una base forte è un nucleofilo forte,
inoltre:
• 1. per due siti nucleofili con lo stesso atomo nucleofilo, più forte è
la base, più forte è il nucleofilo.
2. Procedendo lungo un periodo della tavola periodica, la forza
dei nucleofili diminuisce all’aumentare dell’elettronegatività.
19
Nucleofilo vs base
• Continuiamo il confronto
3. Gli anioni sono nucleofili più forti dei loro acidi coniugati non carichi. Gli
elettroni su un atomo che porta una carica negativa sono meno fortemente
trattenuti e quindi più facilmente condivisi rispetto agli elettroni di una
molecola non carica. Pertanto, gli anioni alcossido sono nucleofili migliori degli
alcoli e gli ioni ammiduro sono nucleofili migliori delle ammine.
4. La forza di molecole non cariche è tanto maggiore quanto più il loro centro
nucleofilo si trova in basso in un dato gruppo della tavola periodica. La facilità
con cui la nuvola elettronica che circonda un atomo può essere distorta si
definisce polarizzabilità dell’atomo. Procedendo dall’alto verso il basso lungo
un gruppo della tavola periodica gli atomi sono via via più grandi e in genere
più polarizzabili e più nucleofili.
5. Procedendo lungo un gruppo della tavola periodica, la forza dei nucleofili
aumenta dall’alto verso il basso.
20
Il solvente
Solitamente i reagenti della sostituzione nucleofila sono
polari e quindi si usano solventi polari per scioglierli.
Esistono solventi polari protici e aprotici.
I solventi polari protici sono in grado di dare legami
idrogeno; il legame idrogeno fa diminuire la disponibilità
degli elettroni non leganti dell’anione e, di conseguenza,
il suo carattere nucleofilo.
Pertanto, ad esempio, nei solventi ossidrilati lo ione
cloruro (anione più piccolo e quindi più solvatato) è un
nucleofilo più debole dello ione bromuro!
I più comuni sono l’H2O, il metanolo CH3OH, l’etanolo
C2H5O, l’acido acetico CH3COOH.
21
Il solvente… e in quelli aprotici?
• In chimica, un solvente aprotico è un solvente la
cui struttura molecolare non presenta un atomo
di idrogeno dissociabile come ione H+.
Anche in questi sono presenti interazione dipolo-dipolo, ma in
questo caso non c’è formazione di legami idrogeno.
Tutti questi solventi hanno un elevato momento dipolare a causa
della presenza di gruppi polari, hanno anche alte costanti
dielettriche e sono molto efficaci come solventi per reazioni
organiche che coinvolgano reagenti o intermedi di reazione ionici.
Quando i composti ionici sono disciolti in questi solventi, gli
anioni non vengono solvatati così fortemente come avverrebbe in
solventi ossidrilati e perciò sono più disponibili per prender parte
alle reazioni di sostituzione nucleofila le cui velocità sono, infatti,
più elevate di quanto lo siano negli alcoli.
22
sostituzione nucleofila
La reazione di sostituzione nucleofila alifatica può procedere con due
meccanismi:
SN1 (sostituzione nucleofila monomolecolare).
SN2 (sostituzione nucleofila bimolecolare)
Meccanismi unimolecolari: sostituzione
nucleofila unimolecolare (SN1)
• Un alogenuro che reagisca con questo meccanismo lo fa in due
stadi, il primo dei quali è lento e consiste nella dissociazione
dell’alogenuro stesso con formazione del carbocatione.
• Nel secondo passaggio, che è veloce, il carbocatione si
combinerà con il nucleofilo per dare il prodotto.
• Poiché lo stadio lento interessa un solo reagente, il
meccanismo è detto unimolecolare, e la velocità globale della
reazione dipende solo dalla concentrazione dell’alogenuro
v= k [RX]
mentre è indifferente sia il tipo di nucleofilo sia la sua
concentrazione.
24
25
26
• Inoltre, poiché si passa attraverso la formazione di un
carbocatione, questo meccanismo sarà quello preferito
dagli alogenuri che formano carbocationi più stabili,
come i terziari.
27
28
29
30
Meccanismi bimolecolari: sostituzione
nucleofila bimolecolare (SN2)
• Quando un alogenuro reagisce con questo
meccanismo lo fa in un unico stadio al quale
partecipa assieme al nucleofilo. La velocità
dipende dunque dalle concentrazioni di entrambi
v= k [RX] [Nu-]
31
• Si ha dunque l’ingresso del nucleofilo
contemporaneo all’allontanamento del gruppo
uscente.
32
• Durante l’attacco i tre sostituenti del carbonio vengono
rovesciati nel senso opposto a quello di entrata del
nucleofilo: la configurazione del carbonio subisce
inversione.
33
• Inoltre, questo meccanismo, in cui il nucleofilo deve
farsi strada attraverso i sostituenti presenti sul
carbonio, è molto sensibile all’ingombro sterico: gli
alogenuri terziari sono quelli che più difficilmente
reagiranno mentre quelli metilici sono quelli più
favoriti.
34
• La SN2 è favorita è favorita da solventi polari
aprotici, come l’acetone, poiché non si legano
agli anioni. Il nucleofilo è così libero di arrivare
“nudo” al carbonio e di reagire con esso. Un
solvente protico, invece, rivestendo il nucleofilo
ne renderebbe difficile l’azione.
δ−
O
S
δ+
CH3
CH3
δ− δ+
CH3-O-H
Nu-
35
Confronto SN1 con SN2
Tendenza alla SN1
metilico
primario
secondario
terziario
Tendenza alla SN2
36
Confronto dei meccanismi
37
Eliminazione
• Oltre alla sostituzione, gli alogenuri alchilici
possono dare la β-eliminazione attraverso due
differenti meccanismi:
• Monomolecolare (E1)
• Bimolecolare (E2)
38
Meccanismi unimolecolari:
eliminazione unimolecolare (E1)
• Anche quando un alogenuro alchilico procede secondo
questo meccanismo, la reazione passa attraverso due
stadi. Il primo, che è quello lento e determina la velocità
della reazione, è identico al primo della SN1 e consiste
nella formazione del carbocatione:
39
• Nel secondo stadio, invece, una base allontana un
idrogeno dal carbonio in β, lasciando il doppietto sul
carbonio stesso. Immediatamente il doppietto si sposta
a formare un doppio legame carbonio-carbonio:
40
• Qualora fossero attaccabili più idrogeni e quindi fossero
possibili più alcheni, vale la regola di Zaytzeff, secondo la
quale si forma prevalentemente l’alchene più sostituito
nella forma trans.
+ CH3O- →
I
18 %
63 %
19 %
41
• Anche in questo meccanismo sono importanti
solo le caratteristiche e la concentrazione
dell’unico composto che partecipa allo stadio
lento della reazione e cioè di RX.
• Come già succedeva con la SN1, questo modo di
reagire sarà preferito da alogenuri che formano
carbocationi più stabili, come terziari e sarà tanto
più veloce quanto meglio il gruppo uscente potrà
ospitare la carica negativa.
42
Meccanismi bimolecolari:
eliminazione bimolecolare (E2)
• Quando un nucleofilo ha buone caratteristiche
basiche, strappa l’idrogeno in β consentendo
così al doppietto che rimane sul carbonio di
formare un doppio legame e di allontanare
l’alogenuro.
43
• La reazione avviene anche in questo caso in un unico passaggio e
la velocità dipende, come nell’SN2, dalle concentrazioni sia del
nucleofilo sia dell’alogenuro:
v= k [RX] [Nu-]
• Vi è dunque, a ulteriore somiglianza con la sostituzione
bimolecolare, un momento in cui il nucleofilo e il gruppo uscente
sono attaccati contemporaneamente alla molecola ma, poiché
l’attacco avviene lontano dal centro di reazione, in questo caso
l’ingombro sterico non è un problema. Anzi, gli alogenuri terziari,
poiché più ricchi di idrogeni attaccabili, risultano più favoriti in
questa reazione.
CH3
B:
CH3
CH3
C
CH3
Br
B:
B:
C
C
Br
Br
H
CH3
CH3
H
H
44
Importanza del gruppo uscente
• Il gruppo uscente è tanto migliore se
ha una minore densità di carica
45
• E’ invece del tutto ininfluente la forza della base che
attacca perché essa non partecipa allo stadio lento.
• E1 e SN1 sono meccanismi che interessano
contemporaneamente gli stessi composti e la prima (E1) è
favorita da temperature più alte, mentre entrambe sono
favorite da solventi polari protici che stabilizzano entrambi
gli ioni che si ottengono dalla dissociazione dell’alogenuro
alchilico.
R+
X-
46
• Inoltre la base e il gruppo uscente si pongono da parti
opposte dello stesso piano determinando così quale
isomero geometrico si ottiene.
CH3
CH2CH3
H
CH3
CH3
B:
C
C
C
C
CH2CH3
CH3CH2
CH3
Br
CH2CH3
cis-3-esene
CH2CH3
H
CH3
B:
C
CH3
CH2CH3
C
C
C
CH3
CH3CH2
CH3
CH2CH3
Br
trans-3-esene
• Anche in questo caso, come nella E1, si
forma sempre l’alchene più sostituito
(Zaytzeff).
47
E adesso?
48
• Come facciamo a prevedere secondo quale
meccanismo reagiranno un certo alogenuro
e un dato nucleofilo?
Si decide tenendo conto, in ordine, di :
• 1) alogenuro alchilico
• 2) nucleofilo/base
• 3) solvente
• 4) temperatura
49
Nucleofilo
scadente
Buon nucleofilo
debolmente
basico
H2O, RSH,
ROH
I-, Br-,
CH3COO-
Base forte non
Base forte
impedita
impedita
stericamente
stericamente
OH-, CH3O-
(CH3)3CO-
Alogenuro
metilico
NON REAGISCE
SN2
SN2
SN2
primario non
impedito
stericamente
NON REAGISCE
SN2
SN2
E2
primario
impedito
stericamente
NON REAGISCE
SN2
E2
E2
secondario
SN1 lenta, E1
SN2
E2
E2
SN1, E1
SN1, E1
E2
E2
SN1
SN1
SN1
SN1
terziario
benzilico o
allilico
50
In linea di massima ricordare che
Un metilico può solo dare SN2
Un primario dà solo meccanismi bimolecolari
Un terziario dà meccanismi unimolecolari con
nucleofili deboli ed E2 con quelli forti
I secondari hanno comportamento che dipende da
nucleofilo e solvente
Un nucleofilo forte, si fa sentire, e spinge verso
meccanismi bimolecolari i secondari e Benzilico e
allilico danno solo SN1
51
Al lavoro, con un po’ di esercizi
Cosa si ottiene da…
CH3
CH3CHCH2Br
+
I-
DMSO
• Alogenuro primario
• Solvente aprotico
• Nucleofilo forte/base debole
• SN2
CH3
CH3CHCH2I
la nucleofilicità degli ioni alogenuro
segue l’ordine I-> Br-> Cl-> F-, opposto
all’ordine di basicità F-> Cl- > Br - > I -.
Sembra che alla base di questo
fenomeno vi siano le differenze delle
energie di solvatazione degli ioni
52
E questo?
Cosa si ottiene da…
Br
CH3CHCH2CH3 + CH3
S-
acetone
• Alogenuro secondario
• Solvente aprotico
• Nucleofilo forte/base debole
• SN2
SCH3
CH3CHCH2CH3
Con inversione
53
E ancora…
• Cosa si ottiene da
Cl
+
CH3OH
CH3OH
• Alogenuro secondario
• Solvente protico
• Nucleofilo debole
• SN1/ E1
OCH3
+
54
Stanchi?
Cosa si ottiene da…
Cl
CH3CCH2CH3
+
OH-
acqua
CH3
• Alogenuro terziario
• Solvente protico
• Nucleofilo forte/base forte
• E2
(CH3)2C=CHCH3 prevalente
CH2=C(CH2CH3)CH3
55
Vediamo questo
Cosa si ottiene da…
Cl
CH3CHCH2CH3
+
CH3OH/H2O T bassa
• Alogenuro secondario
• Solvente protico
• Nucleofilo debole
OH
• SN1
CH3CHCH2CH3
OCH3
+
CH3CHCH2CH3
Con racemizzazione
56
Eh sì, dai, e dopo…
Cosa si ottiene da…
Cl
CH3CHCCH2CH=CH2
+
OH-
acqua
CH3CH3
• Alogenuro terziario
• Solvente protico
• Nucleofilo forte/base forte
• E2
(CH3)2CH (CH3)C=CHCH=CH2
Prevalente. Perché?
(CH3)2C=C(CH3)CH2CH=CH2
57
Veloci che è l’ultimo…
• Cosa si ottiene da
Cl
+
acetone
I-
CH3
• Alogenuro secondario
• Solvente aprotico
• Nucleofilo forte/base debole
• SN2
I
CH3
58
Ci arrabbiamo se ne
arriva ancora uno?
Cosa si ottiene da…
Br
CH3CH2CHCH2CH3 + CH3
O-
CH3OH
• Alogenuro secondario
• Solvente protico
• Nucleofilo forte/base forte
• E2
CH3CH2CH=CHCH3
59
V. Sostituzione vs Eliminazione
C. Unimolecolare: SN1 o E1?
OH2
OH
Br
H2O
∆
base debole
Nu debole
H
OH2
per entrambe, v = k[RBr]
∴ non si controlla il rapporto di SN1 e E1
60
V. Sostituzione vs Eliminazione
D. Sommario
1. bimolecolare: SN2 & E2
Favorite da alta concentrazione di buon Nu o forte B
buon Nu, debole B: I–, Br–, HS–, RS–, NH3, PH3 favorita SN2
buon Nu, forte B: HO–, RO–, H2N–
SN2 & E2
cattivo Nu, forte B: tBuO– (steric. ingombrato) favorita E2
Substrato:
1º RX
2º RX
3º RX
principalmente SN2 (tranne che con tBuO–)
sia SN2 che E2 (ma principalmente E2)
E2 soltanto
la
ramificazione
in β
impedisce SN2
61
V. Sostituzione vs Eliminazione
D. Sommario
2. unimolecolare: SN1 & E1
Ha luogo in assenza di buon Nu o forte B
cattivo Nu, debole B: H2O, ROH, RCO2H
Substrato:
1º RX
2º RX
3º RX
SN1 e E1 (solo con riarrangiamento)
SN1 e E1 (può riarrangiare)
non si controlla
il rapporto
SN1 / E1
62
Sostituzione o Eliminazione?
• La forza del nucleofilo determina l’ordine:
Nucleofilo forte reagirà SN2 o E2.
• Alogenuri primari di solito SN2.
• Alogenuri terziari miscela di SN1, E1 o E2.
• Alta temperatura favorisce l’eliminazione.
• Basi ingombranti favoriscono l’eliminazione.
• Buoni nucleofili, ma basi deboli favoriscono la
sostituzione.
63
E1 o E2?
E1
• Terziario > Secondario
• Base debole
• Solvente ionizzante
• v = k[alogenuro]
• Prodotto di Saytzeff
• Nessuna geometria
richiesta
• Prodotti di
riarrangiamento
•
•
•
•
•
•
•
E2
Terziario > Secondario
Richiesta base forte
Polarità solvente non
importante
v = k[alogenuro][base]
Prodotto di Saytzeff
Gruppi uscenti coplanari
(anti)
Nessun riarrangiamento
64
Riassunto
R-X 3° reagiscono con tutti i meccanismi tranne che con
SN2
Con basi forti: E2
Con nucleofili o basi deboli: SN1 e E1
R-X 1° reagiscono con SN2 e E2
Con nucleofili forti non ingombrati: SN2 (poco reattivi verso
E2)
Con nucleofili forti ingombrati: E2
R-X 2° reagiscono con tutti i meccanismi SN1, SN2, E1, E2
Con basi e nucleofili forti: SN2 e E2
Con basi forti ingombrate: E2
Con nucleofili o basi deboli: SN1 e E1
65