REAZIONI DI ELIMINAZIONE MONOMOLECOLARE E1
In chimica, quando un nucleofilo/base e un alogenuro alchilico reagiscono, sono possibili due processi: la
base può sostituire il gruppo uscente attraverso una reazione SN1 oppure può promuovere l’eliminazione di
HX per fornire un alchene. Ma, quale sarà il prodotto che si ottiene dalla perdita di HX? Le reazioni di
eliminazione portano alla formazione di miscele di alcheni secondo la regola di Zaitsev: se sono possibili più
prodotti di eliminazione si forma in percentuale maggiore l’alchene più sostituito (termodinamicamente più
stabile).
Le reazioni di eliminazione possono seguire 3 distinti meccanismi denominati E2, E1 ed E1cb che
differiscono nei tempi di rottura dei legami C-H e C-X.
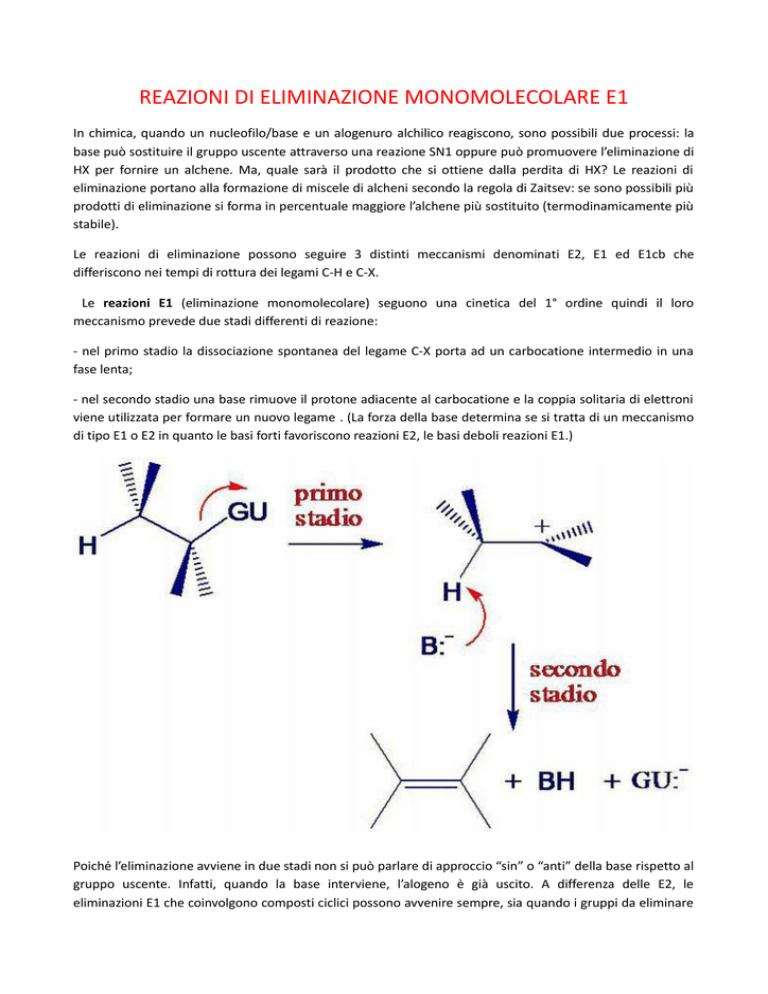
Le reazioni E1 (eliminazione monomolecolare) seguono una cinetica del 1° ordine quindi il loro
meccanismo prevede due stadi differenti di reazione:
- nel primo stadio la dissociazione spontanea del legame C-X porta ad un carbocatione intermedio in una
fase lenta;
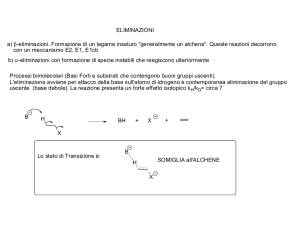
- nel secondo stadio una base rimuove il protone adiacente al carbocatione e la coppia solitaria di elettroni
viene utilizzata per formare un nuovo legame . (La forza della base determina se si tratta di un meccanismo
di tipo E1 o E2 in quanto le basi forti favoriscono reazioni E2, le basi deboli reazioni E1.)
Poiché l’eliminazione avviene in due stadi non si può parlare di approccio “sin” o “anti” della base rispetto al
gruppo uscente. Infatti, quando la base interviene, l’alogeno è già uscito. A differenza delle E2, le
eliminazioni E1 che coinvolgono composti ciclici possono avvenire sempre, sia quando i gruppi da eliminare
(H e X) hanno orientamento “trans” che quando hanno orientamento “cis” e non si trovano nello stesso
piano.
La velocità di una reazione E1 aumenta all’aumentare dei gruppi radicalici sul Carbonio che porta il gruppo
uscente poiché alogenuri più sostituiti creano carbocationi più stabili e quindi l’energia di attivazione è più
bassa e la reazione di conseguenza più veloce. Le reazioni di eliminazione E1 avvengono in presenza di un
alogenuro alchilico terziario (con basi deboli) oppure in presenza di un alogenuro alchilico secondario con
basi deboli e si ottiene una miscela di prodotti SN1 e E1: se si pone il 2-cloro-2-metilpropano in etanolo
acquoso si ottiene una miscela 64:35 di 2-metilpropan-2-olo (SN1)e di 2-metilpropene (E1).
Per quanto riguarda la struttura del substrato nei meccanismi E1, si può dire che gli alogenuri alchilici più
reattivi sono quelli più sostituiti e inoltre migliore è il gruppo uscente, più reattivo è l’alogenuro alchilico. Le
stesse considerazioni valgono per substrati diversi: per esempio gli alcoli in ambiente acido possono essere
disidratati; gli alcoli primari reagiscono con estrema difficoltà, più reattivi sono gli alcoli secondari mentre
quelli primari reagiscono molto facilmente. La reattività della base invece, non assume alcuna importanza in
quanto questa è presente nella fase veloce della reazione; un ambiente basico può indirizzare la reazione
verso un meccanismo E2 oppure E1cb.
Un esempio di reazione E1 è:
Il meccanismo E1cb (eliminazione monomolecolare da base coniugata) descrive una reazione a due stadi
che segue una cinetica non necessariamente definita nell’ordine poiché dipende da qual è lo stadio lento (se
la prima o la seconda fase della reazione). La reazione E1cb avviene attraverso la formazione di un
carbocatione intermedio: l’estrazione del protone da parte della base, forma un anione che libera
immediatamente il gruppo uscente dal carbonio adiacente. Questo tipo di meccanismo è favorito dalla
presenza di substrati che hanno un cattivo gruppo uscente poiché vengono sfavorite le possibili reazioni E1
e E2. Un comune esempio è la condensazione aldolica, quando dopo la formazione del legame fra atomi di
carbonio, una molecola di acqua viene eliminata per formare un composto carbonilico alfa-beta insaturo. In
questo caso, la stabilizzazione è fornita dal gruppo carbonile adiacente.