II VALUTAZIONE TRA PARI: ILLUSTRARE LE REAZIONI DI SOSTITUZIONE NUCLEOFILA
MONOMOLECOLARE SN1. Matricola: 72469
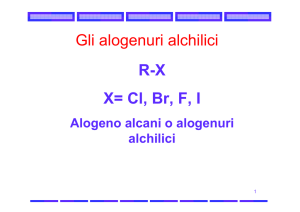
Gli alogenuri alchilici (R-X), sono composti con un atomo di alogeno legato a un carbonio
saturo ibridato sp3, appartengono alla classe degli organoalogenuri ( composti che
contengono uno o più atomi di alogeno). Non si incontrano molto frequentemente ma
dato che sono elettrofili essi quando reagiscono con nucleofili/basi, come lo ione
idrossido, vanno incontro o a sostituzione del gruppo X da parte del nucleofilo o ad
eliminazione di HX per dare uh alchene. La scoperta delle sostituzioni nucleofile avvenne
nel 1896, quando il chimico tedesco Paul Walden scoprì che gli acidi (+)- e (-)-malici
potevano essere convertiti l'uno nell'altro. Le trasformazioni del ciclo di Walden sono
quelle ora definite reazioni di sostituzione nucleofila, perche in ciascuno stadio si
realizza la sostituzione di un nucleofilo ( ione cloruro, Cl-, o ione idrossido, OH-) da parte
di un altro nucleofilo. Queste reazioni sono le più comuni e versatili di tutta la chimica
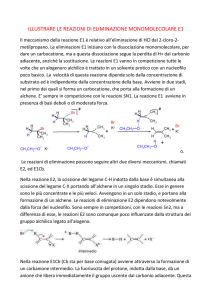
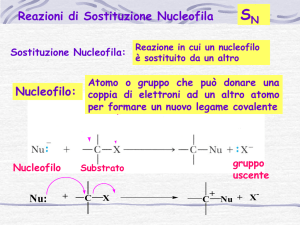
organica: R---X + Nu:- → R---Nu + X:-. La sostituzione nucleofila è un tipo di reazione
chimica che consiste nel distacco dell'alogeno dalla molecola, il quale viene rimpiazzato
da un nucleofilo ( cioè un atomo o gruppo che può donare una coppia di elettroni ad un
altro atomo per formare un nuovo legame covalente ). Ci sono due tipi di sostituzione
nucleofila, SN1 ed SN2; se al distacco dell'alogeno si forma un carbocatione terziario ( il
C ionico è legato a tre altri carboni ) la reazione è SN1. Una reazione SN1, a differenza
delle reazioni SN2, avviene in due stadi: nel primo, più lento, il gruppo uscente acquista
due elettroni dal legame con l'atomo di carbonio e lascia la molecola sotto forma di ione
negativo o di specie neutra. Risulta così formato un carbocatione, che per la riuscita
della reazione deve essere stabilizzato dai gruppi circostanti. Avviene così il secondo
stadio, più veloce, in cui si determinano le reazioni del carbocatione formatosi, con il
nucleofilo o con lo stesso solvente (reazioni di solvolisi ). La velocità della reazione
dipende da una sola specie ( il substrato) così la reazione è detta monomolecolare, ciò
deriva dal fatto che il substrasto subisce una reazione spontanea, senza l'intervento del
nucleofilo. Diversamente dalla reazione SN2 nella quale l'allontanamento del gruppo
uscente e l'ingresso del nucleofilo sono contemporanei, nella reazione SN1 si ha la
perdita spontanea del gruppo uscente prima dell'attacco del nucleofilo, tale perdita
genera un carbocatione come intermedio che poi reagisce con il nucleofilo per dare il
prodotto finale di sostituzione. Più stabile è il carbocatione, più veloce è la reazione SN1.
I carbocationi sono piani, ibridati sp2 e sono specie achirali. Il carbonio carico
positivamente potrà subire l'attacco del nucleofilo, con uguale probabilità, su entrambe
le facce, avremo così una miscela racemica di due enantiomeri. IL processo SN1 è
favorito da:
- molecole che favoriscono la formazione di carbocationi;
-uso di nucleofili deboli, spesso molecole neutre;
-uso di solventi polari che stabilizzano l'intermedio carico.
I solventi polari, infatti, mediante la formazione di legami a idrogeno, assistono l'uscita
del gruppo uscente e stabiliscono le specie ioniche che si formano (carbocatione e
anione).
Un esempio di reazione che procede attraverso un meccanismo SN1 è la reazione del
bromuro di t-butile con lo ione idrossido OH-:
(CH3)3C-Br + OH- → (CH3)3C-OH + BrIl primo stadio della reazione (stadio lento) prevede la formazione del catione t-butilico
(CH3)3C+, il secondo stadio della reazione (stadio veloce) prevede l'attacco nucleofilo
(OH-) al catione t-butilico: