REAZIONE DI SOSTITUZIONE
NUCLEOFILA MONOMOLECOLARE SN1
Quando gli alogenuri alchilici reagiscono con nucleofili vanno incontro a due possibilità:
sostituzione del gruppo X da parte del nucleofilo oppure eliminazione di HX per portare alla
formazione di un alchene. Le sostituzioni nucleofile possono avvenire con due meccanismi
differenti, chiamati reazione SN1 e reazione SN2, dove SN sta a indicare in entrambi i casi
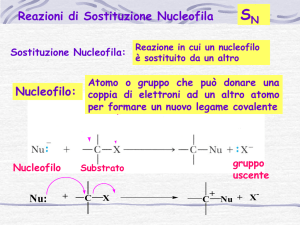
“sostituzione nucleofila”, in quanto in una molecola un nucleofilo, cioè una specie che prende
parte ad una reazione donando un doppietto elettronico, prende il posto di un secondo gruppo
nucleofilo, detto gruppo uscente. In particolare, mi soffermerò sulla descrizione più dettagliata
del meccanismo di reazione SN1.
In generale questo tipo di reazione avviene solamente con i substrati terziari, in ambiente neutro o
acido e con solventi protici, cioè solventi in cui l’idrogeno è legato ad atomi molto elettronegativi,
come l’acqua o gli alcoli. Nel corso di questa reazione un alogeno va a sostituire il gruppo -OH ,
nonostante questo sia un pessimo gruppo uscente poiché non porta alla formazione di anioni
stabili e di conseguenza è poco reattivo. Ciò significa che il meccanismo con cui la reazione deve
decorrere non può essere SN2 , in cui l’allontanamento del gruppo uscente e l’ingresso del
nucleofilo avvengono contemporaneamente, ma deve necessariamente essere SN1. Attraverso
questo tipo di reazione, infatti, si ha la perdita del gruppo uscente prima che il nucleofilo attacchi
l’alogenuro e questo porta alla formazione di un carbocatione come intermedio, il quale nel
secondo stadio della reazione andrà a reagire con il nucleofilo per dare il prodotto finale.
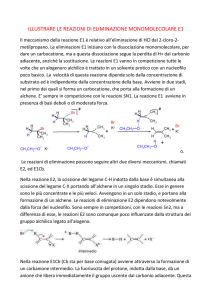
R3C-Br → R3C+ + Br- lenta
R3C+ + OH- → R3C-OH veloce
Reazione del 2-metilpropanolo con acido clorico che dà come prodotto il 2-cloro-2-metilpropano:
Una seconda differenza con il meccanismo SN2 è, dunque, che al contrario di questo, il
meccanismo SN1 avviene in due stadi e ciò spiega perché gli alcoli terziari reagiscono con HBr
molto più velocemente rispetto a quelli secondari e primari: si devono formare come intermedi
carbocationi più stabili e quindi più sostituiti, in modo che la reazione avvenga più velocemente.
Diversamente nel meccanismo SN2 la scala di reattività degli alogenuri è opposta, cioè quelli
terziari sono meno reattivi di quelli secondari, quelli secondari meno reattivi di quelli primari e
quelli primari meno reattivi di quelli metilici, quindi più sono sostituiti e meno sono reattivi.
Inoltre, nel meccanismo SN1 la velocità di reazione dipende esclusivamente dalla concentrazione
del substrato e non da quella del nucleofilo. Questo perché il substrato subisce una reazione
spontanea prima dell’intervento del nucleofilo, da qui la sigla SN1 in cui il numero 1 sta indicare
che la reazione è mononucleare in quanto è solo il substrato a partecipare allo stadio di cui si
misura la velocità.
Poiché si ha come stadio intermedio il carbocatione che è ibridato sp^2 ,piano e achirale, il
carbonio carico positivamente potrà subire l’attacco del nucleofilo con la stesso probabilità su
entrambe le facce. Ciò porta alla formazione di una miscela racemica di due enantiomeri, quindi se
si ha una reazione SN1 su uno solo dei due enantiomeri di un substrato chirale la molecola perderà
momentaneamente la sua chiralità e il prodotto ottenuto sarà inattivo otticamente.
Sia nelle reazioni SN1 che in quelle SN2 i migliori gruppi uscenti sono quelli che portano alla
formazione di anioni più stabili. Ad esempio il cloro è meno stabile del bromo, che a sua volta è
meno stabile dello iodio. Inoltre, vediamo come nelle reazioni SN1 degli alcoli in ambiente acido il
gruppo uscente è neutro.