Alcoli Fenoli e Tioli
Struttura e proprietà
Nomenclatura e nomi comuni
Fonti
Reazioni
Principali aldeidi e chetoni
Alcoli, Fenoli, Tioli, Eteri
Alcoli:
Struttura e proprietà
Nomenclatura
Sintesi
Classificazione
Reazioni
Fenoli
Eteri
Tioli
Alcoli, Fenoli, Tioli, Eteri
Alcoli, Fenoli, Tioli, Eteri
Legami ad Idrogeno Interessanti il Gruppo Alcolico
Alcoli, Fenoli, Tioli, Eteri
Nomenclatura degli alcoli
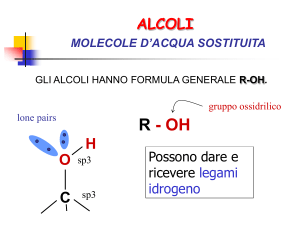
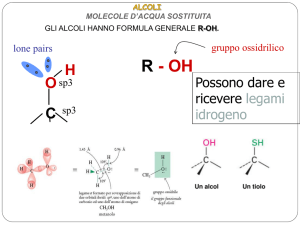
Il gruppo OH è il gruppo funzionale
principale.
• Utilizzare il nome dell’idrocarburo, e
sostituire l’ultima lettera –o con –olo.
• Il carbonio che porta l’ossidrile deve avere
il numero più basso.
• Indicare la posizione dell’ossidrile sulla
catena principale.
• Identificare e numerare ogni catena
laterale o sostituente
L’alcano di base a 4 atomi di
carbonio è il butano.
Sostituire –o con –olo.
Nome dell’alcol –butanolo.
L’OH è sul Carbonio 1, quindi
1-butanolo
Alcoli, Fenoli, Tioli, Eteri
Alcoli, Fenoli, Tioli, Eteri
Alcoli, Fenoli, Tioli, Eteri
Alcoli, Fenoli, Tioli, Eteri
•
Il 90% del metanolo, come primo passaggio, viene ossidato ad aldeide formica la quale successivamente subisce
trasformazione ad acido formico. Il restante 10% del metanolo viene eliminato invariato per via renale (tempo di
emivita: 22 ore circa).
•
Lo step da metanolo a formaldeide può avvenire in due modi:
•
•
nei perossisomi (forma primitiva della catena respiratoria) vari enzimi ossidoreduttasi partendo da diversi substrati
RH2 portano alla formazione di H2O2 (acqua ossigenata o perossido d'idrogeno) che poi, tramite l'enzima catalasi,
ossida il metanolo.
•
RH2 + O2 (by ossidasi)=> R + H2O2 H2O2 + MeOH ( by catalasi)=> HCHO + 2 H2O
•
nel citosol epatico tramite l'enzima ADH (questa ossidazione è in equilibrio reversibile)
•
MeOH + NAD+ <= by ADH => CH2O + NADH + H+
•
Lo step da formaldeide ad acido formico (pKa 3.75, completamente dissociato a formiato) è catalizzato da diversi
enzimi aldeide-deidrogenasi, presenti sia nel citosol sia nei mitocondri della maggior parte delle cellule dei mammiferi.
Questa reazione, irreversibile, sposta "a destra" l'equilibrio reversibile della reazione ADH mediata.
CH2O + NAD+ (by aldeide-deidrogenasi)=> HCOO-H+ + NADH + H+
•
Successivamente il formiato (nella scimmia, usata per l'affinità al genere umano, e presumibilmente nell'uomo) subisce
ossidazione folato-dipendente a CO2. Nel ratto esiste anche un sistema catalisi-perossidativo, e il ratto non subisce
avvelenamento da metanolo o da formiato a meno che non sia reso folato-carente.
•
Il metanolo come tale causa ebbrezza, in seguito ad intossicazione acuta, poi
vertigini, nausea, vomito, dolori addominali, cefalea e depressione del SNC, ma
ben più pericolosi sono i sintomi e i danni causati dai suoi due metaboliti, aldeide
formica e acido formico.
•
Essi causano gravi sintomi quali grave acidosi metabolica, atassia*, vertigine,
dilatazione delle pupille (che divengono poco reattive), congiuntivite, gonfiore del
disco ottico, danni al nervo ottico, al SNC e al fegato. Inoltre sudori freddi,
agitazione furiosa, insufficienza respiratoria ed edema polmonare, convulsioni e
confusione mentale, depressione, coma con ipotermia. La morte sopraggiunge per
paralisi dei muscoli respiratori. I fondamenti biochimici della tossicità del
formiato sul SNC non sono stati ancora chiariti.
•
Acidosi metabolica: nei primati la conversione metanolo => formiato è più rapida
dell'eliminazione del formiato, cosicché nelle 24 ore seguenti l'assunzione di
metanolo si ha un graduale accumulo di acido formico, che causa una diminuzione
del pH plasmatico fino a 6.8 (l'acidosi viene analizzata in laboratorio non dosando
l'acido formico ma misurando la diminuzione di concentrazione di vari anioni
plasmatici.
•
•
Lavanda gastrica (se la si può fare entro due ore dall'assunzione) e/o somministrazione di
NaHCO3 per contrastare l'acidosi e somministrazione di etanolo* (se il tasso ematico del
metanolo e 3,50 mg/dl e se non si manifestano disturbi della visione) per sottrarre al
metanolo l'enzima ADH (si riduce così la formazione dei metaboliti tossici del metanolo). La
concentrazione di etanolo prevede una prima dose di attacco di 700 mg/dl e poi deve
mantenersi pari a 100 mg/dl per tutto il tempo necessario a far scendere la concentrazione
di metanolo sotto i 25 mg/dl.
•
•
Nei casi in cui la concentrazione di metanolo sia prossima o superiore a 100 mg/dl, o nel caso
si manifestino disturbi della visione, allora si ricorrerà a dialisi peritoneale o ad emodialisi,
valide per allontanare non solo il metanolo ma anche i suoi metaboliti.
•
•
Inoltre, per limitare i danni sul SNC, si può bloccare l'ossidazione del metanolo a formiato
somministrando 2-metil-pirazolo (o simili) endovena; si tratta di sostanze efficaci ma
epatotossiche; necessitano di somministrazione immediata dopo l'avvelenamento. ´ Nelle
scimmie sono in fase di sperimentazione trattamenti a base di 5-formil-tetraidroformiato,
sostanza che dovrebbe aumentare il metabolismo del formiato.
Alcoli, Fenoli, Tioli, Eteri
Alcoli, Fenoli, Tioli, Eteri
Alcoli, Fenoli, Tioli, Eteri
Alcoli, Fenoli, Tioli, Eteri
Nel caso di addizione tra alchene e
reagente, entrambi asimmetrici, la
parte elettropositiva del reagente si
addiziona al C del doppio legame
legato al maggior numero di H.
Alcoli, Fenoli, Tioli, Eteri
Il chetoso più semplice è il diidrossiacetone
C H 2O H
C
O
C H 2O H
L’aldoso più semplice è la gliceraldeide
CHO
H C
OH
CH2OH
Diidrossiacetone e gliceraldeide hanno tre atomi di carbonio e sono
detti triosi
Alcoli, Fenoli, Tioli, Eteri
Nomenclatura dei Fenoli
OH
OH
Cl
OH
Fenolo
CH3
p-Metil Fenolo
OH
m-Cloro Fenolo
NO2
NO2
2,4-Dinitro Fenolo
Acidità in Alcoli e Fenoli
Alcoli e fenoli sono acidi deboli in quanto l’ossidrile è in
grado di cedere il protone dando luogo, analogamente
all’acqua, ad uno ione alcossido:
(ROH
RO- + H+ )
Quando si allunga la catena di atomi di C e negli alcoli
soggetti a ingombro sterico come l’alcol t-butilico,
diminuisce l’acidità a causa appunto dell’ingombro sterico
che rende difficile la solvatazione dei corrispondenti ioni
alcossido.
Acidità in Alcoli e Fenoli
I fenoli sono molto più acidi degli alcoli: lo ione fenossido viene
stabilizzato dalla risonanza con delocalizzazione della carica
negativa nelle posizioni orto e para dell’anello.
Questa maggiore stabilità sposta la reazione verso destra
ovvero verso la formazione degli ioni fenossido con
conseguente maggiore acidità dei fenoli rispetto agli alcoli.
°°
°° O
°°°°
°° OH
_
°°
°° O
_
°°
°°
°° O
_
°°
_
°°
Se, l’anello del fenolo è
sostituito con alogeni (più
elettronegativi dell’O) la
acidità aumenta per la
presenza di una parziale
carica negativa sull’alogeno
e parziale carica positiva del
carbonio.
Acidità in Alcoli e Fenoli
_
H
H
H
F
H
C
C
H
_
H
O
Ione etossido
C
_
F
_
+
H
C
_
F
O
Ione 2,2,2-trifluoroetossido
Negli alcoli fluoroderivati, quindi, la polarizzazione della
molecola, dovuta alla forte elettronegatività del fluoro, porta
ad una delocalizzazione della carica negativa (-) sul fluoro con
parziale carica positiva (+) sul C, quindi ad una polarizzazione
del legame CF. il 2,2,2-trifluoroetanolo è circa 3000 volte
più acido dell’etanolo.
In questo modo la carica - dell’O viene parzialmente
neutralizzata dalla carica + del C stabilizzando così l’anione.
Questo fenomeno prende il nome di “Effetto Induttivo”.
Acidità in Alcoli e Fenoli
L’effetto visto con il fluoro è estendibile a tutti i gruppi elettronattrattori che, stabilizzando la base coniugata di un acido, spostano la
reazione verso destra provocando un aumento della acidità.
°°
°° O °°
°° O °°
°° O °°
_
°° O °°
°°
°°_
O
N
+
O
O
N
+
O
O
N
+
+
O
N
-O
O
Ione p-nitrofenossido
Gli alcoli possono comportarsi anche come basi deboli, in quanto possiedono
dei doppietti elettronici non condivisi sull'ossigeno e sono quindi Basi di
Lewis. Vengono protonati dagli acidi forti secondo la reazione:
ROH
+
H+
[ROH]+
H
Ione alchilossonio
Alcoli, Fenoli, Tioli, Eteri
• Considerare ciascuna catena carboniosa
come un gruppo alchilico (desinenza –il).
• Aggiungere la parola Etere.
Alcoli, Fenoli, Tioli, Eteri
• Identificare la catena carboniosa più lunga
ed utilizzarla come nome di base.
• Nominare la catena più corta aggiungendo il
suffisso –ossi.
• Numerare col numero più basso il legame
etereo sulla catena più lunga.
• Utilizzare le regole IUPAC per i sostituenti
Alcoli, Fenoli, Tioli, Eteri
O
CH3
CH3
OH
O
H3C
H
C
CH3
O
O
CH3
CH3
O
1,3,5-trimetossibenzene
trans-2-metossicicloesanolo
CH3
O
H3C
O CH3
Propossibenzene Metossimetilcicloesano
C
H
C
H2
CH3
CH3
2-etossi-3-metilbutano
CH3
H3C
C
H2
CH3
H3C
O
O
CH3
2-metossipropano
CH3
2-etossiottano
Alcoli, Fenoli, Tioli, Eteri
Nomenclatura dei Tioli e dei Solfuri
SH
COOH
CH3CH2SH
SH
Etantiolo
Cicloesantiolo
H3C S
Acido m-mercaptobenzoico
CH3
S
Dimetil solfuro
CH3
Fenil metil solfuro
S
CH3
3-(Metiltio) cicloesene
Alcoli, Fenoli, Tioli, Eteri
Alcoli, Fenoli, Tioli, Eteri