ALCOLI
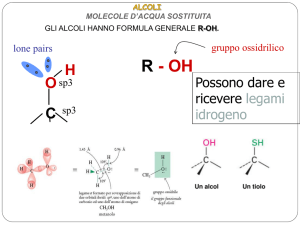
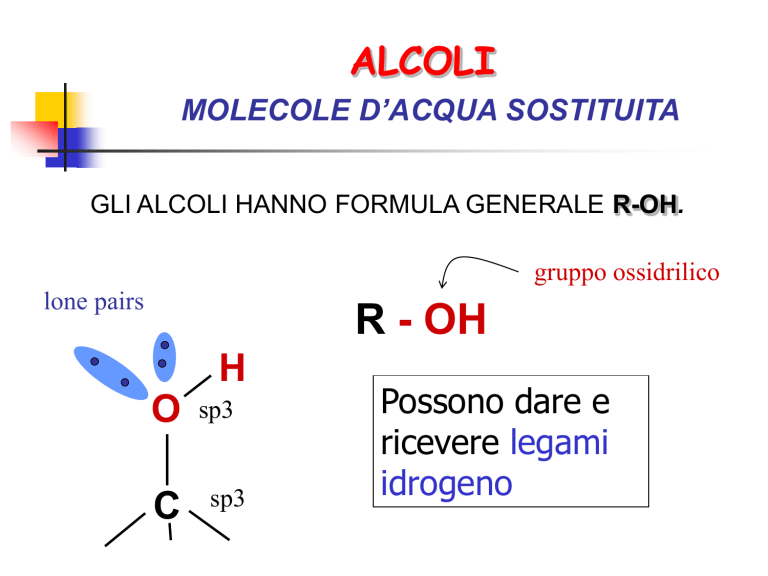
MOLECOLE D’ACQUA SOSTITUITA
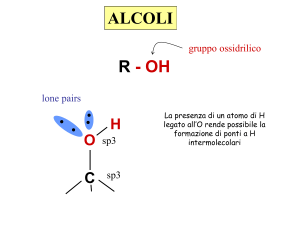
GLI ALCOLI HANNO FORMULA GENERALE R-OH.
gruppo ossidrilico
lone pairs
R - OH
H
O
C
sp3
sp3
Possono dare e
ricevere legami
idrogeno
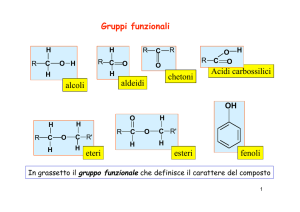
ALCOLI e FENOLI
Se il sostituente è un gruppo aromatico: fenoli.
Se il gruppo e –SH: tioli
NOMENCLATURA
NEL SISTEMA IUPAC -OLO INDICA IL GRUPPO OSSIDRILE
NORMALMENTE SI USA LA PAROLA ALCOOL + NOME DEL
GRUPPO ALCHILICO
Il nome convenzionale degli alcoli alifatici
si costruisce aggiungendo la desinenza -olo
al nome dell’idrocarburo.
Il nome dell’idrocarburo si compone, a sua
volta, identificando la catena lineare più
lunga e numerando i carboni in modo che
nel nome compaiano i numeri più piccoli
possibile.
CLASSIFICAZIONE
I fenoli:
primario
H3C—CH2 —OH
etanolo
secondario
terziario
OH
|
H3C—CH —CH3
OH
|
H3C—C —CH3
|
CH3
2-propanolo
ter-butanolo
2-metil-2-propanolo
PROPRIETA’ FISICHE
I PUNTI DI EBOLLIZIONE E FUSIONE DEGLI ALCOLI SONO MOLTO PIU’
ALTI DEGLI IDROCARBURI CORRISPONDENTI.
IL LEGAME O-H E’ FORTEMENTE POLARIZZATO E L’H HA UNA PARZIALE
CARICA POSITIVA CHE GLI CONSENTE DI STABILIRE INTERAZIONI
DEBOLI DI TIPO PONTE-H CON LE MOLECOLE VICINE.
QUESTO SPIEGA LA MISCIBILITA DEGLI ALCOLI PIU’ LEGGERI CON
L’ACQUA
PUNTI D’EBOLLIZIONE
Caratteristiche deducibili dalla struttura
O
d- H
d+
•L’atomo di ossigeno ha una regione ad alta
densità elettronica (rosso) per la presenza di
due doppietti elettronici solitari.
•Gli atomi di ossigeno alcolici sono basi di Lewis.
•Quindi gli alcoli possono comportarsi sia come
basi che come nucleofili.
•L’atomo di idrogeno della funzione alcolica
mostra una bassa densità elettronica (blu),
quindi ha carattere acido.
•Quindi gli alcoli sono acidi (pKa ~ 16).
•La dissociazione di un protone genera un
alcossido.
•Il gruppo –OH è un cattivo gruppo uscente e
deve essere convertito in un buon gruppo
uscente perché si possa avere una reazione di
sostituzione o di eliminazione.
Gli alcoli sono acidi molto deboli.
In assenza di gruppi elettron-attrattori (che ne aumentano
l’acidità) e di gruppi elettron-repulsori (che ne diminuiscono
l’acidità) i valori di Ka sono intorno a 1·10-15.
H
C H
H
O H
H
H
O
H
pKa 15.5
C H
H
O
H
H O
H
trifluoroetanolo
La presenza dei tre atomi di fluoro stabilizza
l’anione trifluoroetanoato. Il trifluoroetanolo è
un acido più forte dell’etanolo.
F
F
C
F
F
C H
H
O H
F
F
C H
H
O
H
O
H
C
pKa 12.5
H
H O
H
ACIDITÀ DEI FENOLI
I FENOLI HANNO UN COMPORTAMENTO MOLTO PIÙ ACIDO
PERCHÉ L’ANELLO BENZENICO PUO’ DELOCALIZZARE LA
CARICA NEGATIVA DELLO IONE.
SOSTITUENTI ELETTRON ATTRATTORI DEL FENILE
AUMENTANO L’ACIDITA’
SOSTITUENTI ELETTRON-ATTRATTORI NEI FENOLI
Il gruppo NO2 è planare
IONE FENOSSIDO
NaOH NON TRASFORMA UN ALCOL NEL CORRISPONDENTE IONE
ALCOSSIDO, IN QUANTO GLI ALCOSSIDI SONO BASI PIÙ FORTI
DELL'IDROSSIDO.
LA REAZIONE PROCEDE IN SENSO INVERSO.
NaOH TRASFORMA I FENOLI IN IONI FENOSSIDO, POICHE’ SONO BASI
MENO FORTI.
Con Metalli Alcalini
alcoli che i fenoli reagiscono con i metalli alcalini
dando, alcolati e fenati. Queste sono reazioni redox.
2 CH3OH
2 Na
2
2 Na
2 CH3O Na
2
H2
O
O
H
H2
Na
Reazioni di sintesi degli alcoli
Idratazione di alcheni in ambiente acido
Sostituzione nucleofila
REAZIONI DEGLI ALCOLI
VEDI ANCHE ETERI E “CONDENSAZIONE ZUCCHERI”
VEDI ALDEIDI E CHETONI
VEDI ACIDI CARBOSSILICI
Reazione di un alcol primario con acido alogenidrico
Una SN2
Cl+
R
R
R
+
Cl
+
R
Cl
R
H C H
H+
Cl
R
H C H
O
O
H
H
H
Cl-
R
H C H
O
H
H
H2O
Cl
H C R
H
Reazione di un alcol terziario con acido alogenidrico
L’alcol terziario protonato perde una molecola di acqua formando un
carbocatione terziario sp2 che può essere attaccato dallo ione
cloruro da un lato del piano di ibridazione oppure dall’altro lato
R1
R3
La sostituzione nucleofila è SN1
+
R2
R1
R3
R
R C OH
R
R2
R1
+
R3
R
H+
R C
H2O
R
R2
+
+
R1
R1
Cl-
Cl
Cl-
R2 R
3
+
R3
R2
R
R C Cl
R
Cl
gruppo
uscente
nucleofilo
Quanto più debole è un
nucleofilo tanto meglio
si comporterà come
gruppo uscente
Forza del nucleofilo
Alcuni gruppi funzionali attivi come
nucleofili all’interno delle cellule
REAZIONE DI DISIDRATAZIONE
E’ L’INVERSO DELLA IDRATAZIONE DEGLI ALCHENI
È UNA ELIMINAZIONE E PUO’ AVVENIRE CON
MECCANISMO E1 O E2.
LA REAZIONE INIZIA CON LA PROTONAZIONE
DELL’OSSIDRILE OH CHE AGISCE COME BASE
LA FACILITÀ È NELL’ORDINE 3° > 2° > 1°
I FENOLI NON DANNO ELIMINAZIONE E SOSTITUZIONE
ELIMINAZIONE 1 (E1,alcoli terziari)
1. Attacco elettrofilo
2. disidratazione
3. Riarrangiamento e
perdita di un protone
ELIMINAZIONE 1
A VOLTE UN ALCOL PUÒ DARE DUE O
PIÙ ALCHENI, PERCHÉ
IL PROTONE CHE ABBANDONA LA
MOLECOLA DI ALCOL DURANTE LA
DISIDRATAZIONE PUÒ VENIRE DA
QUALSIASI ATOMO DI CARBONIO
ADIACENTE A QUELLO LEGATO AL
GRUPPO OSSIDRILE.
DAL 2-METIL-2-BUTANOLO, AD ESEMPIO,
SI POSSONO FORMARE DUE ALCHENI:
ELIMINAZIONE 2 (E2, alcoli primari)
1.
2.
Animazione:
OSSIDAZIONE
GLI ALCOLI PRIMARI DANNO ALDEIDI E AD ACIDI CARBOSSILICI
QUELLI SECONDARI DANNO CHETONI
La variazione di colore dello ione dicromato nella reazione di
ossidazione degli alcoli (e delle aldeidi) viene sfruttata
nell’esame estemporaneo del tasso di etanolo nell’alito (test
del palloncino)
OH
H C H
Ione dicromato
(rosso-arancio)
Cr2O7-- (H+)
O
C
H
H C H
Cr+++
H C H
H
Ione cromo
(verde)
H
etanolo
Alcol etilico
2-propanolo
etanale
Aldeide acetica
propanone
L’OSSIDAZIONE DEI FENOLI
I FENOLI SI OSSIDANO CON
FACILITÀ.
• CAMPIONI DI FENOLI CHE
RESTANO ESPOSTI ALL'ARIA, COL
TEMPO DIVENTANO MOLTO
SCURI.
• NEL CASO DELL'IDROCHINONE
(1,4-DIIDROSSIBENZENE) LA
REAZIONE PUÒ ESSERE
FACILMENTE CONTROLLATA PER
OTTENERE
1,4-BENZOCHINONE (DETTO
COMUNEMENTE CHINONE)
GLICOLI
GLI ALCOLI CON PIÙ DI UN OSSIDRILE SI CHIAMANO GLICOLI
Preparazione di
nitroglicerina:
(Antigelo)
Dolcificante
POLIFENOLI VEGETALI
DA QUALCHE TEMPO
VENGONO
CONSIDERATI FRA I
PIÙ IMPORTANTI
COMPOSTI
ALIMENTARI PER LA
PREVENZIONE DI
TUTTE LE MALATTIE
CARDIOVASCOLARI
E PER QUELLE DI
TIPO ONCOLOGICO
IN QUANTO
PROTEGGONO I
TESSUTI ED I LIPIDI
DALLA
OSSIDAZIONE.
FLAVONOLI E BIOFLAVONOIDI
TIOLI (mercaptani)
gruppo sulfidrilico
lone pairs
R - SH
H
S
C
sp3
sp3
Non può fare legami idrogeno
La polarità è minore.
S è un buon ligante di metalli
Forma disolfuri
Reazione redox
Tioli liberi
Ossidazione
- 2H
Riduzione
+ 2H
Ponte disolfuro
LA PERMANENTE E’ UN OPERAZIONE DI INGEGNERIA BIOCHIMICA
ETERI
gruppo etere
lone pairs
C
sp3 O
C
R–O–R
sp3
sp3
Gli eteri sono molecole si
comportano da solventi polari
aprotici (mancano atomi di
idrogeno disponibili a formare
ponti ad H)
Per condensazione in
ambiente acido
(ad es. H2SO4)
di due molecole di
etanolo
si ottiene un etere
H OHH
CH3
C
H OHH
2
H2O
C
C
H OHH
2
H+
1a fase: Protonazione dell’alcol
2a fase: Sostituzione
nucleofila
C
CH3
H OHH
(La reazione decorre con
meccanismo SN2)
CH3
CH3
CH3
CH3
C
H OHH
H
C
H+
H
CH3
VEDI “CONDENSAZIONE DEGLI ZUCCHERI”
C
H OH
H
C
H
CH3
dietiletere
(o etere etilico)
Gli eteri devono essere considerati basi di Lewis: in ambien
te acquoso acido sono facilmente protonati ed idrolizzati
H
H
R
C
H+
RH
C
H
protonazione
H O
C H
H
R
O
C H
H
R
H
H
R
C
H
H
R
C
H O
C H
H
R
O
H2O
H
+
H O
H
H+
RH
C
H
O
H
idrolisi
C H
H VEDI “DIGESTIONE DEGLI ZUCCHERI”
R
EPOSSIDI (ETERI)
O
R — R
lone pairs
sp3
gruppo epossido
O
Csp3
C
sp3
Forte tensione di legame
Alta reattività
Reazione tipica degli epossidi:
Sostituzione nucleofila
Meccanismo di reazione in ambiente acido
Nu-H = H2O, R-OH, R-NH2
FINE