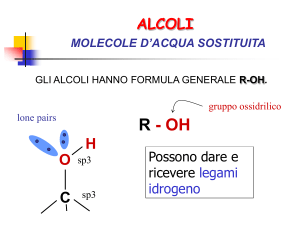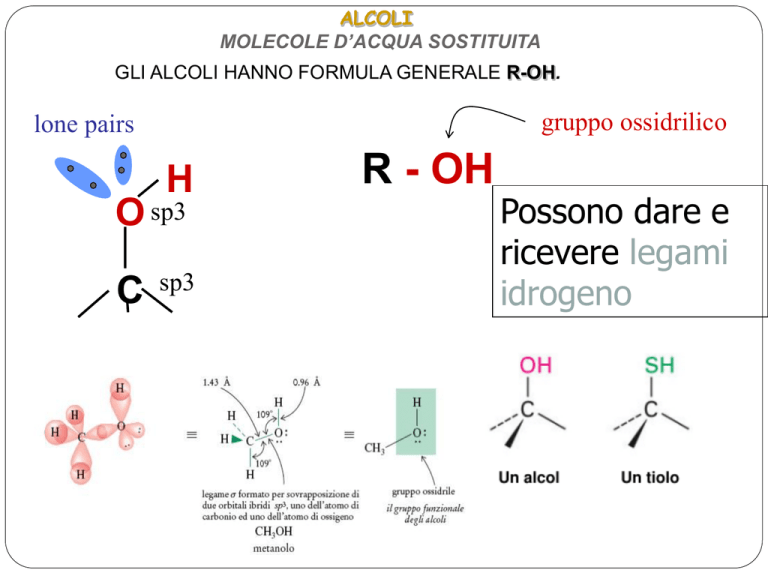
ALCOLI
MOLECOLE D’ACQUA SOSTITUITA
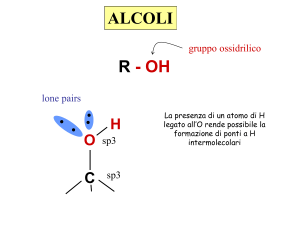
GLI ALCOLI HANNO FORMULA GENERALE R-OH.
gruppo ossidrilico
lone pairs
H
O sp3
C
sp3
R - OH
Possono dare e
ricevere legami
idrogeno
Vari sostituenti
Se il sostituente è un gruppo aromatico:
Fenolo.
Con gruppo SH si hanno: Tioli
Il gruppo Arilico con SH: Tiofenolo
Se il gruppo è
un Insaturo:
NOMENCLATURA
NEL SISTEMA IUPAC -OLO INDICA IL GRUPPO OSSIDRILE
NORMALMENTE SI USA LA PAROLA ALCOOL + NOME DEL GRUPPO
ALCHILICO
•Il nome convenzionale degli alcoli alifatici
si costruisce aggiungendo la desinenza -olo
al nome dell’idrocarburo.
•Il nome dell’idrocarburo si compone, a sua
volta, identificando la catena lineare più
lunga e numerando i carboni in modo che
nel nome compaiano i numeri più piccoli
possibile.
ESEMPI
ALCOOL BENZILICO
POLI OLI
I composti che possiedono due, tre o più gruppi alcolici
(-OH) sono classificati come polioli e il suffisso da
usare sarà -diolo (2 -OH), -triolo (3 -OH) ecc.
OH
OH
OH
OH
OH
CH2
CH2
CH2
CH
CH2
2
3
1
2
1,2-etandiolo
oppure
Glicole etilenico
N.B. I dioli con 2 –OH su due carboni
adiacenti prendono il nome di GLICOLI
1
1,2,3-Propantriolo
oppure
Glicerina o glicerolo
CLASSIFICAZIONE
PROPRIETA’ FISICHE
I PUNTI DI EBOLLIZIONE E FUSIONE DEGLI ALCOLI SONO MOLTO PIU’
ALTI DEGLI IDROCARBURI CORRISPONDENTI.
IL LEGAME O-H E’ FORTEMENTE POLARIZZATO E L’H HA UNA PARZIALE
CARICA POSITIVA CHE GLI CONSENTE DI STABILIRE INTERAZIONI DEBOLI
DI TIPO PONTE-H CON LE MOLECOLE VICINE.
QUESTO SPIEGA LA MISCIBILITA DEGLI ALCOLI PIU’ LEGGERI CON
L’ACQUA
PUNTI D’EBOLLIZIONE
Sintesi degli Alcoli
1.
2.
3.
4.
5.
Idratazione di alcheni (Markovnikov)
Idroborazione-ossidazione di alcheni (antiMarkovnikov)
Idrolisi di alogenuri alchilici ( −OH, H2O)
Reattivi di Grignard su aldeidi, chetoni, esteri
Riduzione con idrogeno di formaldeide, aldeidi, chetoni, acidi
1-Idratazione di alcheni
H
C
C
alkene
+ H2O
+
H OH
C
C
alcohol
2-Idroborazione-ossidazione di alcheni
3 - Idrolisi di alogenuri alchilici ( −OH, H2O)
•
•
•
4 - Reattivi di Grignard su aldeidi;
Chetoni;
esteri
Riduzione con idrogeno di formaldeide, aldeidi, chetoni.
Nei laboratori si può usare come riducente anche idruri quali NaBH4 o LiAlH4
Caratteristiche deducibili dalla struttura
O
d- H
d+
•L’atomo di ossigeno ha una regione ad alta
densità elettronica (rosso) per la presenza di
due doppietti elettronici solitari.
•Gli atomi di ossigeno alcolici sono basi di Lewis.
•Quindi gli alcoli possono comportarsi sia come
basi che come nucleofili.
•L’atomo di idrogeno della funzione alcolica
mostra una bassa densità elettronica (blu),
quindi ha carattere acido.
•Quindi gli alcoli sono acidi (pKa ~ 16).
•La dissociazione di un protone genera un
alcossido.
•Il gruppo –OH è un cattivo gruppo uscente e
deve essere convertito in un buon gruppo
uscente perché si possa avere una reazione di
sostituzione o di eliminazione.
Gli alcoli sono acidi molto deboli.
In assenza di gruppi elettron-attrattori (che ne aumentano l’acidità) e di gruppi
elettron-repulsori (che ne diminuiscono l’acidità) i valori di Ka sono intorno a
1·10-15.
H
H
H
C
H
H
O
H
O
pKa 15.5
H
H
C
H
O
H
O
H
H
La presenza dei tre atomi di fluoro stabilizza
l’anione trifluoroetanoato. Il trifluoroetanolo è un acido più forte dell’etanolo
ACIDITÀ DEI FENOLI
I FENOLI HANNO UN COMPORTAMENTO MOLTO PIÙ ACIDO PERCHÉ L’ANELLO
BENZENICO PUO’ DELOCALIZZARE LA CARICA NEGATIVA DELLO IONE.
SOSTITUENTI ELETTRON ATTRATTORI DEL FENILE AUMENTANO L’ACIDITA’
IONI AlCOSSIDO E FENOSSIDO
NaOH NON TRASFORMA UN ALCOL NEL CORRISPONDENTE IONE ALCOSSIDO, IN
QUANTO GLI ALCOSSIDI SONO BASI PIÙ FORTI DELL'IDROSSIDO. LA REAZIONE
PROCEDE IN SENSO INVERSO.
NaOH TRASFORMA I FENOLI IN IONI FENOSSIDO, POICHE’ SONO BASI MENO FORTI.
REAZIONI DEGLI ALCOLI
Gli alcoli possono inoltre dare altri tre tipi di reazioni
1) Rottura del legame O-H
L’ossigeno può usare i suoi elettroni per comportarsi da nucleofilo,(cioè RO- è un
nucleofilo)
2) Rottura del legame C-O
L’ossigeno è molto elettronegativo ed il legame è polarizzato come negli alogenuri
alchilici, possono quindi avvenire reazioni di SOSTITUZIONI NUCLEOFILE
con reattivi nucleofili.
Comportamento
3) Ossidazione
acido
Trasformando l’alcool in aldeide, chetone o acido
Comportamento
basico
1)Gli alcoli possono poi comportarsi da reattivi nucleofili e reagire con:
Aldeidi
Il C dell’aldeide è
parzialmente positivo
R
d O H
C
O
R'
H
l’ossigeno ha elettroni spaiati
H
O
R
C
R'
OH
R
H
O
semiacetale
R'
OH
O
R
H
C O
R'
H
O
Acidi carbossilici
R
C
O
R'
OH
+ H2O
R
OH
O
O H
R
C O
OH
R'
R
O
H
C
O
O
H
R'
R'
estere
1)Gli alcoli possono anche reagire con acidi inorganici per formare
Esteri di acidi inorganici
2
+
3
+
4
Nitroglicerina
2)Sostituzione nucleofila negli alcoli
1) Negli alcoli il gruppo uscente OH- è una base forte quindi
la sostituzione nucleofila è difficile
si può forzare sull’equilibrio chimico (non facile) usando un catalizzatore
CH3-CH2-OH + H+
CH3-CH2-OH2+
In questo caso il gruppo uscente è una base molto debole ( H2O) e la reazione è facile
CH3-CH2-OH + CH3-CH2-OH + H+
2) Reazione degli alcoli con acidi alogenidrici
CH3-CH2-O-CH2-CH3 + H2O + H+
etere
2) REAZIONE DI DISIDRATAZIONE
E’ L’INVERSO DELLA IDRATAZIONE DEGLI ALCHENI
È UNA ELIMINAZIONE E PUO’ AVVENIRE CON MECCANISMO E1 O E2.
LA REAZIONE INIZIA CON LA PROTONAZIONE DELL’OSSIDRILE OH CHE AGISCE
COME BASE
LA FACILITÀ È NELL’ORDINE 3° > 2° > 1°
I FENOLI NON DANNO ELIMINAZIONE E SOSTITUZIONE
3) REAZIONE DI OSSIDAZIONE
GLI ALCOLI PRIMARI DANNO ALDEIDI E AD ACIDI CARBOSSILICI
QUELLI SECONDARI DANNO CHETONI
3) Esempi di ossidazione
• La variazione di colore dello ione dicromato nella reazione di ossidazione
degli alcoli (e delle aldeidi) viene sfruttata nell’esame estemporaneo del
tasso di etanolo nell’alito (test del palloncino)
Alcol etilico
OH
H
C
H
H
C
H
Ione dicromato
(rosso-arancio)
Cr2O7-- (H+)
H
etanolo
I FENOLI SI OSSIDANO CON
FACILITÀ.
CAMPIONI DI FENOLI CHE RESTANO
ESPOSTI ALL'ARIA, COL TEMPO
DIVENTANO MOLTO SCURI.
Cr+++
Ione cromo
(verde)
Aldeide acetica
O
H
C
H
C
H
etanale
H
GLICOLI
GLI ALCOLI CON PIÙ DI UN OSSIDRILE SI CHIAMANO GLICOLI
Preparazione di
nitroglicerina:
(Antigelo)
Dolcificante
ETERI
Gli eteri sono molecole si comportano da solventi polari aprotici (mancano
atomi di idrogeno disponibili a formare ponti ad H)
Doppietti
elettronici
gruppo etere
C
sp3 O
C
sp3
sp3
R–O–R
POCO REATTIVI
Sono spesso usati come
solventi
Per condensazione in
ambiente acido
(ad es. H2SO4)
di due molecole di
etanolo
si ottiene un etere
H OHH
CH3
C
H OHH
2
H2O
C
C
H OHH
2
H+
1a fase: Protonazione dell’alcol
2a fase: Sostituzione
nucleofila
C
CH3
H OHH
(La reazione decorre con
meccanismo SN2)
CH3
CH3
CH3
CH3
C
H OHH
H
C
H
CH3
H+
C
H OH
H
C
H
CH3
dietiletere
(o etere etilico)
Gli eteri devono essere considerati basi di Lewis: in ambien
te acquoso acido sono facilmente protonati ed idrolizzati
H
H
R
C
H+
RH
C
H
protonazione
H O
C H
H
R
O
C H
H
R
H
H
R
C
H
H
R
C
H O
C H
H
R
O
H2O
H
H
+
H O
C H
H
R
H+
RH
C
H
O
H
idrolisi
EPOSSIDI (ETERI CICLICI)
O
R — R
lone pairs
sp3
gruppo epossido
O
Csp3
C
sp3
Forte tensione di legame
Alta reattività
Gli eteri ciclici con anelli tesi sono più reattivi perché, con l'apertura dell'anello,
hanno sollievo dalla tensione d'anello
Reazione tipica degli epossidi:
Meccanismo di reazione in ambiente acido
Nu-H = H2O, R-OH, R-NH2
N.B. Gli eteri ciclici con 5 o 6 atomi di carbonio sono molto più stabili
FINE