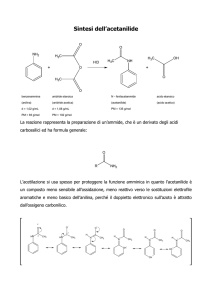
COMPOSTI OSSIGENATI E
SOLFORATI
Eteri; Tioli; Solfuri
R-O-R; R-SH; R-S-R
ETERI
• Gli eteri possono essere considerati come derivati organici
dell’acqua che contengono due gruppi alchilici al posto dei
due atomi di idrogeno legati all’atomo di ossigeno.
• Il simbolo generale è R-O-R’ dove R ed R’ possono essere
due gruppi alchilici o arilici uguali o diversi o un’unica catena
alchilica legata ai due estremi. In questo caso abbiamo un
etere ciclico.
ciclico
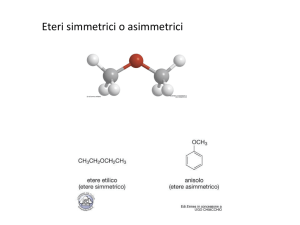
• L’etere più noto è l’etere dietilico usato come anestetico in
medicina e come solvente.
H3C C O C CH3
H2
H2
dietiletere
H3C C O CH3
H2
O
etilmetiletere
tetraidrofurano
Nomenclatura
• Gli eteri semplici vengono denominati sulla base
dei due gruppi organici attaccati all’ossigeno ed
aggiungendo la parola etere.
etere
• Se ci sono più sostituenti la parte eterea è
considerata come un sostituente alcossilico
(alc-ossi).
O
O
O
2-metossipropano
etilfeniletere
O
O
1,4-dimetossibenzene
4-tert-butossicicloesene
Proprietà fisiche
• Gli eteri sono leggermente polari per la presenza
dell’atomo di ossigeno, ma non possono formare
tra di loro legami idrogeno.
idrogeno
• Non hanno punti di ebollizione alti perché possono
dare solo lievi interazioni dipolo-dipolo a causa
dell’ingombro sterico.
Proprietà chimiche
• Gli eteri sono composti relativamente stabili e poco
reattivi,
reattivi e per questo vengono spesso usati come
solventi.
• In alcuni casi reagiscono con l’aria per dare i perossidi
R-O-O-R che possono essere esplosivi ed
estremamente pericolosi.
• Possono subire reazioni di sostituzione nucleofila in
ambiente acido che porta alla loro scissione con un
meccanismo SN1 o SN2 a seconda del substrato e delle
condizioni di reazione (in maniera analoga a quanto
visto per gli alogenuri e per gli alcoli).
H
O
H+
O
+
OH
+ Br-
+
Br
Epossidi
• Gli epossidi sono eteri ciclici che formano un anello a tre
atomi.
• Essi subiscono facilmente l’attacco dei nucleofili che porta a
una SN con apertura dell’anello in quanto l’anello ha una
forte tensione angolare.
Eteri corona
•
Gli eteri corona sono composti ciclici che presentano numerosi
legami eterei.
• Un etere corona lega specificamente alcuni ioni metallici o molecole
organiche, in base alle dimensioni della propria cavità per mezzo di
interazioni elettrostatiche con i doppietti elettronici degli atomi di
ossigeno che puntano all‘interno della cavità dell'etere corona.
• Il complesso corolla-ospite è chiamato composto di inclusione.
inclusione
• Gli eteri corona sono chiamati [X]-corona-Y, dove X è il numero
totale di atomi dell'anello ed Y è il numero di atomi di ossigeno
dell'anello.
[15]-corona-5
[18]-corona-6
O
[12]-corona-4
O
O
O
O
O
O
O
O
O
O
O
O
O
O
TIOLI
• I tioli sono gli analoghi solforati degli
alcoli.
R-S-H
• I tioli vengono anche chiamati mercaptani
perché essi formano complessi stabili con
cationi di metalli pesanti come il mercurio
(captano il mercurio) e l'arsenico.
Nomenclatura
• La nomenclatura dei tioli si ottiene aggiungendo il
suffisso -tiolo al nome dell'idrocarburo
corrispondente privato della vocale finale.
• Se c'è un secondo gruppo funzionale nella
molecola, il gruppo SH viene indicato utilizzando il
prefisso mercapto- prima del nome
dell'idrocarburo corrispondente.
H3C SH
Metantiolo
(metilmercaptano)
HO
SH
Cicloesantiolo
(cicloesilmercaptano)
SH
2-mercaptoetanolo
Tiofenolo
(fenilmercaptano)
SH
Proprietà fisiche
• Poiché lo zolfo è meno elettronegativo
dell'ossigeno, i tioli sono meno efficienti nella
formazione di legami idrogeno.
• Di conseguenza, essi sono caratterizzati da
attrazioni intermolecolari più deboli e perciò
hanno punti di ebollizione considerevolmente più
bassi di quelli degli alcoli.
Usi
• I tioli a basso peso molecolare sono
caratterizzati da un odore forte e pungente,
come quello associato a cipolle, aglio e puzzole.
• Il gas che usiamo nelle nostre abitazioni è
completamente inodore e può causare
esplosioni mortali in caso di perdite non
avvertite. Perciò, a questo gas viene aggiunta
una piccola quantità di un tiolo per conferirgli
un odore tale da permettere di percepire
eventuali perdite.
Acidità
• I tioli sono acidi più forti (pKa = 1O) degli
alcoli e gli ioni tiolato sono basi più deboli
degli ioni alcossido.
• Lo zolfo infatti è più grande dell'ossigeno
e quindi la carica negativa dello ione tiolato
è diffusa su un volume maggiore rendendo
questa specie più stabile dello ione
alcossido.
R
SH
+
H 2O
R
S
+
ione tiolato
H 3O +
Proprietà chimiche
• I tioli si ossidano a disolfuri e la reazione è
reversibile.
SH
Ox
S
S
• Il ponte disolfuro è un gruppo funzionale,
costituito da due atomi di zolfo legati (-S-S-), che
riveste una notevole importanza nella
stabilizzazione della struttura terziaria di molte
proteine.
Ponti Disolfuro
• Nelle proteine la formazione dei
ponti disolfuro avviene per
ossidazione dei gruppi tiolici
dell'amminoacido cisteina.
• Il ponte disolfuro gioca un ruolo
importante nel determinare sia la
struttura che la stabilità dei
capelli e la consistenza delle
unghie, costituiti per gran parte
da catene proteiche di cheratina.
• Queste catene vengono tenute
insieme proprio dalla formazione
di ponti disolfuro.
• La formazione di questi ponti fa
sì che le catene proteiche si
ripieghino parzialmente su sé
stesse, dando così origine al
fenomeno dei capelli ricci.
Proprietà chimiche
• A somiglianza degli alcoli, i mercaptani possono
reagire come nucleofili nei confronti di substrati
elettrofili come ad esempio gli alogenuri o i
derivati degli acidi carbossilici.
H
H3C S H
H3C Br
+
H3C S CH3
+ Br-
H3C S CH3 + HBr
• A differenza degli alcoli invece non possono
essere usati come substrati per reazioni di
sostituzione nucleofila o di eliminazione in quanto
il gruppo -SH è un cattivo gruppo uscente.
SH + Br-
Br + SH
Composti solforati naturali
• I composti solforati alifatici sono ampiamente diffusi in
natura e presentano grande importanza sotto il profilo
biologico. Le catene proteiche degli enzimi comprendono
spesso gruppi tiolici (-SH),
SH la cui importanza è
determinante ai fini dell'attività catalitica dell'enzima.
• Le proprietà tossiche di taluni metalli pesanti sono dovute
proprio alla loro capacità di combinarsi con quei gruppi
tiolici, interferendo in tal modo con i processi che si
svolgono all'interno della cellula vivente.
• I gruppi bisolfuro (-S-S-) caratterizzano con la loro
presenza numerose proteine e ormoni a struttura
polipeptidica, come l'insulina, ed entrano in certi processi
reversibili di tipo ossidoriduttivo che si verificano a livello
delle cellule.
SOLFURI
• Gli analoghi solforati degli eteri si chiamano solfuri o
tioeteri.
tioeteri
• Il nome si costruisce facendo seguire al termine solfuro il
nome dei due gruppi alchilici legati allo zolfo in ordine
alfabetico.
• I tioeteri possono essere anche descritti come alchiltioalchiltio
derivati degli alcani. Si sceglie come gruppo alchiltio- (RS-)
quello contenente il gruppo alchilico a catena più breve.
H3C S CH3
H3C C S CH3
H2
Dimetilsolfuro
Etilmetilsolfuro
H
H3C C CH2 CH3
H3C S CH3
2-(metiltio)butano
• l tioeteri sono liquidi di odore sgradevole che possono
essere ossidati a solfossidi e a solfoni.
H3C S CH3
ox
O
ox
O
H3C S CH3
H3C S CH3
Solfossido
O
Solfone
SOLFURI
•
I solfuri sono eccellenti nucleofili perché la loro nuvola elettronica
è polarizzabile.
Perciò i solfuri reagiscono facilmente con gli alogenuri alchilici
formando i sali di solfonio.
Poiché possiede un gruppo uscente debolmente basico, uno ione
solfonio subisce facilmente reazioni di sostituzione nucleofila.
La S-adenosilmetionina è un sale di solfonio che viene usato come
metilante biologico.
•
•
•
R
NH2
O
N
CH3
S
O
H NH
+ 3
R
NH2
+
N CH3
H H
N
+
O
O
N
N
SN2
NH2
N
S
O
H NH3
O
N
+
OH OH
S-adenosilmetionina (ione sulfonio)
S-adenosilmonocisteina OH OH
N
N