Chimica Organica
Informazione Scientifica sul Farmaco
Capitolo 12
Aldeidi e chetoni
Organic Chemistry, 5th Edition
L. G. Wade, Jr. Prentice Hall
Organic Chemistry, 3rd Edition
Paula Y. Bruice, Prentice Hall
Aldeidi e chetoni
• Aldeidi e chetoni cono caratterizzati dalla presenza del gruppo
carbonilico (C=O)
• Sono composti molto diffusi in natura
• Usati come aromi e additivi, ad esempio vaniglia, cannella.
• Presente nei farmaci
• La formaldeide è usata per i polimeri, ad esempio la Bakelite.
• Reattività chimica elevata, estremamente utile nelle sintesi
organiche
Noretindone:
presente nella pillola contraccettiva perché
2
arresta l’ovulazione
Struttura del carbonile
•
•
Il Carbonio e l’ossigeno sono ibridizzati sp2.
Il legame C=O è più corto, più forte e più polare del legame C=C.
•
Torneremo in seguito sulle caratteristiche elettroniche del gruppo
carbonilico
3
Nomi IUPAC dei chetoni
•
•
•
•
Individuare la catena più lunga che contenga il gruppo carbonilico.
Numerare la catena in modo da dare il numero più piccolo possibile al
carbonile.
Nei chetoni ciclici il carbonile è in posizione 1.
Sostituire la -o con -one.
O
CH3
O
C CH CH3
CH3
O
CH3
3-metil-2-butanone
4-idrossi-3-metil-2-butanone
C CH CH2OH
CH3
Br
3-bromocicloesanone
4
Nomenclatura delle aldeidi
•
•
•
IUPAC: Sostituire la -o con -ale.
Il carbonio aldeidico è il numero 1.
Se il gruppo -CHO è direttamente legato ad un anello, usare il
suffisso -carbaldeide.
CH3
CH2
CH3
O
CH CH2
C H
CHO
3-metilpentanale
2-ciclopentencarbaldeide
5
Quando il carbonile è sostituente
• Quando ci sono gruppi a priorità maggiore, il C=O è sostituente e si
chiama oxo-, mentre il -CHO si chiama formil.
• La priorità delle aldeidi è maggiore di quella dei chetoni.
COOH
CH3
O
CH3
O
C
CH CH2
C H
3-metil-4-ossopentanale
CHO
Acido 3-formilbenzoico
6
Nomi comuni dei chetoni
O
CH3
O
O
C
C
C CH3
CH3
acetofenone
acetone
benzofenone
Nomi comuni delle aldeidi
•
Derivano dai nomi comuni degli acidi corrispondenti.
1 C: acido formico, formaldeide
2 C: acido acetico, acetaldeide
3 C: acido propionico, propionaldeide
4 C: acido butirrico, butirraldeide.
7
Punti di ebollizione
•
•
Più polari degli alcani, quindi punti di ebollizione più alti.
Non possono formare legame idrogeno intermolecolare, per cui
bollono a temperature inferiori rispetto ai corrispondenti alcoli.
8
Solubilità
•
•
•
Buoni solventi per gli alcoli.
Accettori di legami ad idrogeno, ad esempio con O-H o N-H.
Acetone e acetaldeide sono miscibili con l’acqua in tutte le
proporzioni.
d-
d-
O
H
d+
O
H
Legame idrogeno
9
Sintesi (review)
•
•
Ossidazione degli alcoli
alcol 2 + Na2Cr2O7 chetone
alcol 1 + PCC aldeide
Acilazione di Friedel-Crafts
Cloruro acilico/AlCl3 + benzene chetone
CH3COCl
O
C
CH3
AlCl3
10
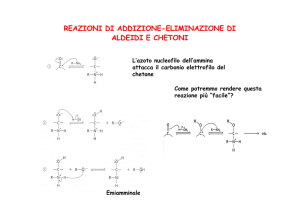
Reattività del carbonile
• La polarizzazione e la mesomeria del carbonile indicano che il
carbonio ha carattere elettrofilo
• Reagisce con i nucleofili
• L’attacco nucleofilo determina la rottura del legame p
• Si forma un prodotto di addizione
dR
O
O
C
C
H
R
O
d+
H
R
C
H
Nu
Nu
11
Addizione nucleofila
•
Un nucleofilo forte attacca il gruppo carbonilico formando uno
ione alcossido, che successivamente viene protonato.
•
Le aldeidi sono più reattive dei chetoni.
12
Addizione di acqua
•
•
•
•
Reazione catalizzata sia dagli acidi che dalle basi
In ambiente acido il nucleofilo è l’acqua.
In ambiente basico il nucleofilo è lo ione idrossido.
Le aldeidi sono più elettrofile.
O
H
C
HO
+ H2O
H
O
CH3
C
CH3
C
H
HO
+ H2O
OH
CH3
H
K = 2000
OH
C
CH3
K = 0.002
13
Addizione di alcoli
•
•
•
•
•
Reazione molto importante per la comprensione della chimica dei
carboidrati
E’ catalizzata dagli acidi.
L’addizione di H+ al carbonile lo rende reattivo nei confronti dei
nucleofili deboli come ROH.
Prima si forma un emiacetale, poi si ha una seconda addizione di
ROH con formazione di un acetale.
Tutti passaggi reversibili.
14
Meccanismo
15
Acetali ciclici
•
L’addizione di un diolo porta alla formazione di un acetale ciclico.
•
Gli zuccheri normalmente si trovano in forma emiacetalica.
OH OH
H O
Carbonio emiacetalico
H
H
H
OH
H
OH
OH
16
Ossidazione delle Aldeidi
Facilmente ossidabili ad acidi carbossilici.
17
Riduzioni dei composti
carbonilici: riducenti
•
•
•
Sodio Boroidruro, NaBH4, riduce C=O, non riduce C=C.
Litio Alluminio Idruro, LiAlH4, molto più reattivo, difficile da
maneggiare.
H2 e catalizzatore, riduce anche C=C.
O
CH3CH2CH2C
OH
H
NaBH4
H2O
CH3CH2OH
HCl
O
CH3CH2CH2CH2
OH
NaBH4
H2O
CH3CH2OH
HCl
18
Acidità degli idrogeni a
•
I composti carbonilici che hanno un idrogeno in posizione a sono
acidi deboli, pKa 15-20.
a
Carbonyl compound
CH3CH2COCH2CH3
CH3COCH3
PhCOCH3
PhCH2COCH3
PhCH2COCH3
Cyclohexanone
CH3CHO
Pka
19,9
18,9
17,7
18,3
15,9
17,8
16,5
19
Acidità degli idrogeni a
Ad esempio il butanale (aldeide butirrica) potrebbe formare 3
diversi anioni, ma solo il primo è stabilizzato dalla risonanza
20
Tautomeria cheto-enolica
La forma carbonilica è in equilibrio con la forma enolica.
L’equilibrio è catalizzato dalle basi o dagli acidi
21
Reazione aldolica
L’anione enolato può reagire con una seconda molecola di aldeide o
chetone formando un aldolo o un chetoalcol
22
Fine del capitolo 12
23