Aldeidi e Chetoni
Nomenclatura delle Aldeidi
O
O
H
H
4,4-dimetilpentanale
O
5-esenale
O
HCCHCH
2-fenilpropanediale
Nomenclatura delle Aldeidi
O
Se nominato
come sostituente
gruppo formile
C
H
Se nominato
come suffisso
carbaldeide
carbossialdeide
Nomenclatura dei Chetoni
O
O
CH3CH2CCH2CH2CH3
CH3CHCH2CCH3
CH3
3-esanone
H3C
4-metil-2-pentanone
O
4-metilcicloesanone
Nomenclatura dei Chetoni
O
O
CH3CH2CCH2CH2CH3
etil propil chetone
CH2CCH2CH3
benzil etil chetone
O
divinil chetone
H2C
CHC CH
CH2
fenone:
O
R C
.
O
C
benzofenone
H3C
O
C
acetofenone
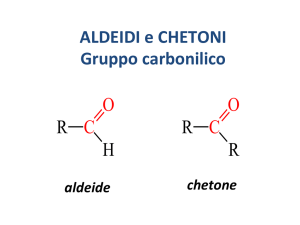
Descrizione elettronica
del gruppo carbonilico
Descrizione elettronica
del gruppo carbonilico
••
•• –
O ••
•• O ••
C
C
+
H3C 1,50
121° 1,22
O
118° C
121°
H 1,09
H
H3C
C
H
2,33 D
H3C
O
C
O
C
H
H3C
2,72 D
HCHO
CH3CHO
C2H5CHO
- 21°
21
49
CH3COCH3
CH3CH2COCH3
CH3COCH2CH2CH3
CH3CH2COCH2CH3
56
80
102
102
2,88 D
H
O
H
O
O
Solubilità
I doppietti elettronici presenti sull’ossigeno
possono formare legami idrogeno con
solventi contenenti I gruppi O-H o N-H.
L’acetone e l’acetaldeide sono miscibili
con l’acqua.
=>
Spettroscopia IR
Very strong C=O stretch around 1710 cm-1.
Conjugation lowers frequency.
Ring strain raises frequency.
Additional C-H stretch for aldehyde: two
absorptions at 2710 cm-1 and 2810 cm-1.
=>
Spettroscopia 1H NMR
=>
Spettroscopia 13C NMR
=>
MS del 2-Butanone
=>
MS della Butirraldeide
=>
Trasposizione di McLafferty
Loss of alkene (even mass number)
Must have -hydrogen
=>
Spettro UV, *
C=O conjugated with another double bond.
Large molar absorptivities (> 5000)
=>
SINTESI ALDEIDI
1. Ossidazione alcoli primari
2. Riduzione esteri
SINTESI CHETONI
1. Ossidazione alcoli secondari
2. Acilazione di Friedel-Crafts
CH3CH2CH2OH + PCC
O
CH3CH2C
DIBAH
CH3CH2CHO
O
H
CH3CH2C
OCH3
propionato di metile
H
propanale
idruro di bisisobutilalluminio DIBAH
[(CH3)2CHCH2]2AlH
(CH3)2CHOH
PCC (CH ) CO
3 2
+ CH3COCl
AlCl3
COCH3
Reazioni delle
Aldeidi e Chetoni
REAZIONI DELLE ALDEIDI E DEI
CHETONI
• Ossidazione
• Riduzione
• Addizione di acqua
• Addizione di cianuro
• Addizione dei derivati dell’ammoniaca
• Addizione di alcoli
• Reazione di Cannizzaro
• Addizione dei reattivi di Grignard
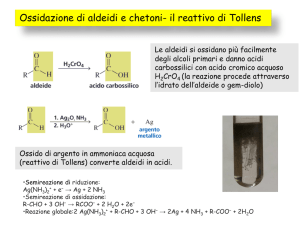
Ossidazione Aldeidi
CH3CH2CH2CH=O
+
KMnO4, CH3CH2CH2COOH
CH3CH2CH2CH=O + Ag+ CH3CH2CH2COO- + Ag
Tollen’s test (AgNO3, NH4OH(aq)
Specchio argento
ADDIZIONE NUCLEOFILA AL CARBONILE
O
C
+
YZ
OY
C
Z
O
Nu-
NuH2
ONu
Nu
+O
Nu
= H2O
C
C
Nu
O
ROH NH3 NH2R
Nu
Nu
OH
H+
Nu
+O
=
OH
C
Nu
Nu
C
O
OR
CR3
H
CN
Riduzione con idruri
O
O
+ NaH
HO
+ NaH + AlCl3
non reagisce
O
O
AlCl3
AlCl3
O
maggiore elettrofilicità
O
AlCl3
H
O
AlCl3
H
LiAlH4
H
OH
H
NaBH4
AlCl3
H
La catalisi acida esalta il carattere
elettrofilo del carbonio
O
O
H
H
O
H
1)
2)
3)
O
C
OH
C
OH
C
ZH
+
OH
C
H
OH
C
ZH
RDS
+
HZ
OH
C
Z
+
H
O
O
C
H
H3C
O
C
H3C
O
C
CH3
C
R'
Nu
Nu
O
C
R'
R
O
O
R
R
R'
Nu
M
P
R
O
M
P
M
P
O
R
R
O
G
G grande
M medio
G
G
A
B
P piccolo
Nu
M
P
M
P
O
R
R
O
G
G
se R è idrogeno B maggiore di A
se R è grande A maggiore di B
M
Nu P
M
Nu P
O
R
R
O
G
A
G
B
Idratazione di aldeidi e chetoni
C
O ••
••
H2O
••
HO
••
C
••
O
••
H
gem-diolo
Costanti di equilibrio per l’idratazione
C=O
idrato
K
%
CH2=O
CH2(OH)2
41
99.96
CH3CH=O
CH3CH(OH)2 0.018
(CH3)3CCH=O (CH3)3CCH(OH)2 0.0041
(CH3)2C=O
50
19
(CH3)2C(OH)2 0.000025 0.14
Effetto dei sostituenti
OH
O
+ H2O
C
R
R'
elettronico:
R
C
R'
OH
I gruppi alchilici riducono
il carattere elettrofilo del carbonile
sterico:
I gruppi alchilici
ingombrano il prodotto
Meccanismo in condizioni basiche
Stadio 1:
H
–
•O•
• •• •
+
C
O ••
••
••
HO
••
C
•• –
O ••
••
Stadio 2:
••
HO
•• –
O ••
••
C
••
H
H
••
HO
••
C
••
OH
••
–
+ •• O ••
••
H
O ••
••
Meccanismo in condizioni acide
Stadio 1:
H
C
O ••
••
+
H
O ••
+
H
H
C
+
OH
••
+
•O•
• •
H
Stadio 2:
H
•O•
• •
H
+
C
+
OH
H
•O
• +
••
H
C
••
OH
••
Stadio 3:
H
••
H
+O
H
H
••
O
H
••
+
H
••
•O
•
H
C
•O
• +
••
OH
••
H
C
••
OH
••
L’equilibrio si sposta verso la forma
idrata quando il carbonile è
destabilizzato
• i gruppi alchilici stabilizzano C=O
• I gruppi elettronattrattori
destabilizzano C=O
OH
O
+ H2O
C
R
R
R
C
OH
R = CH3: K = 0.000025
R = CF3: K = 22,000
R
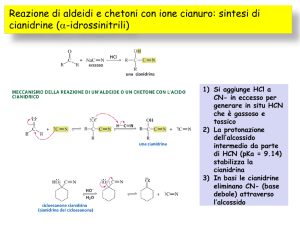
Formazione di Cianidrine
C
O ••
••
+ HCN
•N
•
C
C
••
O
••
H
Formazione di Cianidrine
•N
•
–
C ••
C
O ••
••
•N
•
C
C
•• –
O ••
••
H
•N
•
C
C
•• –
O ••
••
H
O ••
+
H
H
•N
•
C
C
••
O
••
H
• O ••
•
H
Esempio
Cl
Cl
O
Cl
OH
NaCN, acqua
Cl
CH
CHCN
poi H2SO4
2,4-Diclorobenzaldeide
cianidrina (100%)
Esempio
O
CH3CCH3
OH
NaCN, acqua
poi H2SO4
CH3CCH3
CN
(77-78%)
Questa cianidrina è usata per la
sintesi del metacrilonitrile.
O
HO
+ ROH
O
+ ROH
HO
OR
+ R'OH
H
RO
H
OR
emiacetale
OR
RO'
OR
acetale
acetale
emiacetale
O
+
ROH
O
H
OR
HO
OR
O
O
O
H
H
H
HO
ROH
H
OR
H
RO
H
HO
OR
OR - H2O
- H
RO
O
OR
ROH
R
O
R
HO
OR
ROH
O
H
RO
H
H
HO
OR
HO
OR - H2O
- H
RO
Z
O
OR
R
O
R
O
HO
Z
HCN
H2O
ROH
H2SO4
HX
CN
OH
OR
HSO4
X
equilibrio spostato verso
addizione
composto carbonilico
RX + Mg
RMgX
reattivo di Grignard
RMgX
O
alogenuro di alchilmagnesio
O
+ RMgX
R
MgX
H 2O
OH
MgX(OH)
R
O
C
+
+ RMgX
H
OH
C
R
N R
O
H2N R
R =
H
ammoniaca
alchile
ammina
+ H2O
OH
idrossilammina
NH2
idrazina
O
OH
OH
+ H
OH
H2N R
H2N
R
OH2
- H
- H2O
HN
HN
R
HN
R
N
R
R
N
R =
R
H
alchile
immina alchilimmina
OH
NH2
ossima idrazone
Dipendenza della velocità di reazione dell’acetone con
idrossilammina dal pH
REAZIONE DI CANNIZZARO
OSSIDAZIONE-RIDUZIONE DELLE ALDEIDI
SENZA IDROGENI IN ALFA
COO-
CH2OH
CHO
conc. NaOH
+
Br
Br
conc. NaOH
H2C=O
CH3OH + HCOO-
Br