Chimica organica
VII Lezione
1
Reattività degli alogenuri alchilici
R-X
X= F, Cl, Br, I.
Gli alogenuri alchilici sono caratterizzati dalla
presenza di un gruppo –X, attaccato direttamente al
carbonio.
La sua elettronegatività non solo fa sì che il legame
C-X sia polarizzato a favore di quest’ultimo ma
comporta anche che tutti i legami C-H, fino al
carbonio in ß, siano polarizzati a favore dei rispettivi
carboni.
δ+
δ+
H
H
C
C
H
H
δ+
X
δ+
δ-
1
2
Questa situazione spiega la reattività degli
alogenuri alchilici che può essere riassunta in
1) sostituzione di -X per opera di un nucleofilo
(sostituzione nucleofila)
2) allontanamento di un H+ dal carbonio in ß con
contemporanea formazione di un doppio legame
carbonio-carbonio e uscita dello ione alogenuro
(eliminazione)
Nu
H
H
Nu
C
C
X
H
H
2
3
Le due diverse reazioni possono avvenire
secondo meccanismi differenti che sono
determinati da:
tipo di alogenuri per quanto riguarda sia
R (primario, secondario, terziario) sia -X;
forza del nucleofilo e sue proprietà
basiche;
natura del solvente;
temperatura.
3
4
Meccanismi unimolecolari:
eliminazione unimolecolare (E1)
Anche quando un alogenuro alchilico procede
secondo questo meccanismo, la reazione passa
attraverso due stadi. Il primo, che è quello lento e
determina la velocità della reazione, è identico al
primo della SN1 e consiste nella formazione del
carbocatione:
4
5
Meccanismi unimolecolari:
eliminazione unimolecolare (E1)
Nel secondo stadio, invece, un base allontana un
idrogeno dal carbonio in ß, lasciando il doppietto
sul carbonio stesso. Immediatamente il doppietto
si sposta a formare un doppio legame carboniocarbonio:
5
6
Qualora fossero attaccabili più idrogeni e quindi
fossero possibili più alcheni, vale la regola di
Zaitsev, secondo la quale si forma prevalentemente
l’alchene più sostitutito nella forma trans.
o anche : l'alchene che si forma in maggior quantità è
quello che deriva dalla sottrazione dell'idrogeno dal
carbonio β che è legato al minor numero di idrogeni.
I
+ CH3O→
18 %
63 %
19 %
6
7
Anche in questo meccanismo sono
importanti solo le caratteristiche e la
concentrazione dell’unico composto che
partecipa allo stadio lento della reazione e
cioè di RX.
Come già succedeva con la SN1, questo
modo di reagire sarà preferito da alogenuri
che formano carbocationi più stabili, come
terziari, benzilici e allilici e sarà tanto più
veloce quanto meglio il gruppo uscente
potrà ospitare la carica negativa.
7
8
Importanza del gruppo uscente
Il gruppo uscente è tanto migliore quanto
ha una minore densità di carica
L’anione è poco basico
8
9
E’ invece del tutto ininfluente la forza della base che
attacca perché essa non partecipa allo stadio lento.
E1 e SN1 sono meccanismi che interessano
contemporaneamente gli stessi composti e la prima
è favorita da temperature più alte, mentre entrambe
sono favorite da solventi polari protici che
stabilizzano entrambi gli ioni che si ottengono dalla
dissociazione dell’alogenuro alchilico.
R+
X-
9
10
Vediamo la SN1 all’opera…
10
11
Vediamo la E1 all’opera…
11
12
Meccanismi bimolecolari: eliminazione
bimolecolare (E2)
Quando un nucleofilo ha buone caratteristiche
basiche, strappa l’idrogeno in ß consentendo
così al doppietto che rimane sul carbonio di
formare un doppio legame e di allontanare
l’alogenuro.
ß
12
13
La reazione avviene anche in questo caso in un unico
passaggio e la velocità dipende, come nell’SN2, dalle
concentrazioni sia del nucleofilo sia dell’alogenuro:
v= k [RX] [Nu-]
Vi è dunque, a ulteriore somiglianza con la sostituzione
bimolecolare, un momento in cui il nucleofilo e il gruppo
uscente sono attaccati contemporaneamente alla molecola
ma, poiché l’attacco avviene lontano dal centro di reazione,
in questo caso l’ingombro sterico non è un problema. Anzi,
gli alogenuri terziari, poiché più ricchi di idrogeni attaccabili,
risultano più favoriti in questa reazione.
CH3
B:
CH3
CH3
C
CH3
Br
B:
B:
C
C
Br
Br
H
CH3
CH3
H
H
13
14
Inoltre la base e il gruppo uscente si pongono da
parti opposte dello stesso piano determinando così
quale isomero geometrico si ottiene.
CH3
CH2CH3
H
CH3
CH3
B:
C
C
C
CH2CH3
CH3CH2
CH3
Br
CH2CH3
cis-3-esene
CH2CH3
H
CH3
B:
C
CH3
CH2CH3
C
C
C
CH3
CH3CH2
CH3
CH2CH3
C
Br
trans-3-esene
Anche in questo caso, come nella E1, si forma
sempre l’alchene più sostituito (Zaitsev).
14
15
Vediamo la SN2 in azione…
15
16
Vediamo una E2 all’opera…
ß
16
17
Come facciamo a prevedere secondo
quale meccanismo reagiranno un certo
alogenuro e un dato nucleofilo?
Si decide tenendo conto, in ordine, di :
1) alogenuro alchilico
2) nucleofilo/base
3) solvente
4) temperatura
18
17
Gruppi funzionali
Un gruppo funzionale è un atomo o un gruppo di atomi che
determina le proprietà chimiche di un composto organico,
permettendone la classificazione.
19
18
COMPOSTI CARBONILICI
Composti organici caratterizzati dal gruppo funzionale carbonilico.
Il gruppo carbonilico è planare, con angoli di legame di 120°.
Il doppio legame C=O consiste in un legame (sovrapposizione di due orbitali
ibridi sp2) e in un legame (sovrapposizione di due orbitali p).
Le due coppie di elettroni non condivise dell’ossigeno si trovano nei rimanenti
orbitali ibridi sp2.
20
19
21
20
20
22
H3C
H3C
H3C
+
O°°
°°
H3C
°°
O °°
°°
L'Ossigeno è molto
elettronegativo
e conferisce una polarità al
legame C=O.
+ -
Forme di risonanza del carbonile
Per questa polarità, i composti carbonilici sono esposti all'attacco dei nucleofili sul C del
carbonile, a differenza di quanto accade con i C doppio legame (C=C) che, non essendo
23
21
polarizzato, si presta all'attacco degli elettrofili.
Composti naturali e di sintesi
22
24
23
25
24
26
25
27
Nomenclatura
Quando un chetone è un sostituente in catena si riferisce ad esso
come gruppo osso.
O
O
5
1 H
esanale
5-ossoesanale
Mentre quando l’aldeide è il sostituente di un anello ci si riferisce
ad essa come carbaldeide
O
H
cicloesancarbaldeide
26
28
27
29
Proprietà fisiche
Il legame C=O è molto polarizzato:
La polarità delle molecole ne diminuisce la
volatilità rispetto agli alcani corrispondenti
Legami idrogeno:
Le molecole non possono
darli ma possono riceverli
(ad esempio dall’acqua)
28
30
Proprietà fisiche
La polarizzazione del carbonile influenza la solubilità di
aldeidi e chetoni, ed infatti i composti a basso peso
molecolare possono accettare legami idrogeno da altri
gruppi contenenti i gruppi -OH o -NH.
29
31
PCC: piridinio clorocromato
30
32
31
33
GLI ACIDI CARBOSSILICI
R-COOH formula generale
-COOH gruppo funzionale: carbossile
Esempi:
HCOOH acido metanoico o acido formico
CH3COOH acido etanoico o acido acetico
CH3CH2COOH acido propanoico o acido propionico
32
Proprietà fisiche
Il gruppo COOH è molto polare e può
formare legami a idrogeno.
1.
Gli acidi carbossilici hanno temperature
di ebollizione e fusione superiori a tutti i
composti organici con la medesima
lunghezza della catena idrocarburica.
2.
Fino a 4C gli acidi carbossilici sono
solubili in acqua, poi sempre meno
solubili.
33
Proprietà fisiche
Gli acidi carbossilici formano dimeri nei quali le due unità sono
tenute saldamente insieme da due legami idrogeno:
34
Acidità degli acidi carbossilici
Gli acidi carbossilici si dissociano nell'acqua per formare un
anione carbossilato e uno ione idronio.
Occorre ricordare che, quanto più è grande il valore di Ka, o
più piccolo il valore di pKa, tanto più forte è l'acido.
35
Risonanza
Perché gli acidi carbossilici sono tanto più acidi degli alcoli e
dei fenoli?
Soprattutto per la possibilità di delocalizzare per risonanza la
carica, negli anioni che si vengono a formare.
es. l'acido acetico è 1011 volte, cioè cento miliardi di volte, più
acido dell'etanolo.
36
Salificazione
Gli acidi carbossilici reagiscono con le basi forti per formare dei sali.
Esempi per la nomenclatura:
37
40 38
ALDEIDI E CHETONI
Reattività
La reattività è controllata dalla polarizzazione del legame C=O.
La reazione principale è rappresentata dall’addizione di un nucleofilo al
carbonio carbonilico elettrofilo
NOTA: CATALISI ACIDA
Gli acidi (elettrofili) catalizzano la
reazione protonando l’ossigeno
(nucleofilo)
Potenziamento del carattere elettrofilo
del C carbonilico che favorisce l’attacco
di nucleofili deboli
4139
ALDEIDI E CHETONI
Reattività
DIFFERENZA DI REATTIVITÀ TRA ALDEIDI E CHETONI
Le aldeidi sono più reattive dei chetoni per due motivi:
Fattori elettronici
Il gruppo carbonilico è stabilizzato dai gruppi alchilici (R) a cui è legato (effetto
induttivo elettrondonatore).
Un chetone, avendo due gruppi R, è più stabile di una aldeide che ne ha uno solo.
La formaldeide, priva di R, è più reattiva delle altre aldeidi e dei chetoni.
Fattori sterici
In una reazione di addizione si ha un aumento di impedimento sterico al carbonio
carbonilico.
Composti come i chetoni, con gruppi ingombranti legati al carbonile, provocano
impedimento sterico e conseguente minore reattività.
REATTIVITA’
FORMALDEIDE > ALDEIDI > CHETONI
40
42
Reazioni dei composti carbonilici
Idratazione
Addizione di Azoto derivati
Riduzione dai carbonili
Ossidazione
Saggio di Tollens
41
Idratazione (addizione)
L'acqua, come gli alcoli, è un nucleofilo
all'ossigeno e può addizionarsi in modo
reversibile alle aldeidi e ai chetoni.
La formaldeide in acqua esiste prevalentemente
in forma idrata. (un gem-diolo)
42
L’addizione nucleofila di acqua ad un’aldeide in ambiente
alcalino, il cui meccanismo è questo :
H
R C
O
OH-
H
R C OH
O
H
H2O
OH-
R C OH
OH
aldeide idrata
porta alla formazione di una aldeide idrata (gem-diolo)
43
Addizione di acido cianidrico
L'acido cianidrico si addiziona al carbonile delle
aldeidi e dei chetoni per formare le cianidrine
Il carbonio dell’acido cianidrico indissociato non può
comportarsi da nucleofilo, è necessaria una base. 44
Il carbonio non possiede doppietti elettronici non
condivisi.
La base trasforma una parte dell'acido cianidrico
in ione cianuro, che si comporta da nucleofilo sul
carbonio.
OH-
HCN
CN-
45
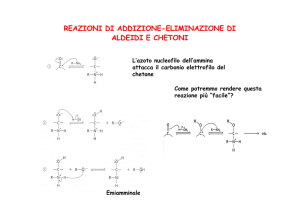
Addizione di Azoto derivati
L'ammoniaca, le ammine e alcuni loro derivati
hanno sull'atomo di azoto un doppietto elettronico
non condiviso e si comportano da nucleofili.
Il prodotto tetraedrico di
addizione che si forma nel
primo passaggio è simile a un
semiacetale.
46
Il saggio di Tollens
Un saggio che distingue le aldeidi dai chetoni in base
alla loro differente ossidabilità è il saggio di Tollens
dello specchio d'argento.
Lo ione argento complessato dall'ammoniaca è
ridotto dalle aldeidi (ma non dai chetoni) ad argento
metallico
Ci si serve di questa reazione per argentare il vetro:
l'aldeide usata è la formaldeide, a causa del suo
basso costo.
49
Tautomerismo Cheto-Enolico
Un carbonio adiacente a un gruppo
carbonilico è chiamato carbonio- a,
e un idrogeno legato ad esso è un
idrogeno- a.
a- hydrogens
O
CH 3 - C- CH 2 - CH 3
a- carbons
50
Tautomerismo Cheto-Enolico
Un composto carbonilico con un
idrogeno-alfa è in equilibrio con un
isomero chiamato enolo (en da
alchene + olo da alcohol)
Può formare lo ione enolato
O
OH
CH3 - C- CH3
Acetone
(keto form)
CH3 - C= CH2
Acetone
(enol form)
51
Tautomeria Cheto-Enolica
Aldeidi e chetoni possono esistere all'equilibrio come miscela
di due forme: chetonica ed enolica.
Le due forme differiscono per la posizione di un protone e di
un doppio legame e vengono dette tautomeri:
2,4-pentanedione: forma enolica
52
stabilizzata da legami H
Tautomerismo Cheto-Enolico
Keto form
Gli equilibri
per aldeidi
O
semplici
CH3 CH
stanno
O
dalla parte
CH3 CCH3
della forma
O
chetonica.
Enol form
% Enol at
Equilibrium
OH
CH2 = CH
6 x 10-5
OH
CH3 C= CH2 6 x 10-7
OH
4 x 10-5
53
Tautomerismo Cheto-Enolico
Il tautomerismo è catalizzato dagli acidi
Step 1: trasferimento di protone da H-A
••
••
O
H- A
CH 3 - C-CH 3
+
A-
••
CH 3 - C-CH 3 +
keto form
fast
+ •• H
O
the conjugate acid
of the ketone
Step 2: trasferimento di protone a A-
+
A-
••
CH3 - C-CH2 - H
••
+ •• H
O
slow
••
OH
CH3 - C= CH2
Enol form
+
H- A
54
Acidità degli H in a
l'anione risultante è stabilizzato per
risonanza
Nell’anione enolato la carica negativa si
distribuisce fra il carbonio in alfa e
l'atomo di ossigeno carbonilico.
55
Acidità degli H in a
56
Scrivere la formula di struttura dei seguenti composti sia con
il metodo normale che con i segmenti:
2,3-diclorobutano; 1,2-dimetil-5-bromopentano; 1,1,4-tricloro-2metilbutano; 3,4-dibromoesano; 2-fluoro-2-iodopentano; 1,1,2tribromoetano; trans-1-cloropropano; trans-1,5-difluoro-2-pentene;
1-bromo-2-etil-1-pentene; cis-1-bromo-3-fluoropropene; cis-1bromo-4-cloro-2-butene; 4-bromo-4-etil-4-ottene
Che cosa significano le sigle: SN1 e SN2?
Quali dei seguenti composti, sottoposti a una reazione di sostituzione
nucleofila, seguiranno con maggiore probabilità la SN1? Quali la SN2?
E quali entrambe?
I
Br
Cl
CH3CHCH2CH2CH2
Cl
CH3
BrCH2CH3
ICH3
CH3CH2CCH2CH3
Br
57
Perché aldeidi e chetoni hanno punti di
ebollizione più alti di alcani ed eteri di pari
massa molecolare ma più bassi di alcooli
sempre di pari massa molecolare?
Attribuire il nome IUPAC ai seguenti composti:
acetaldeide
benzaldeide
3-idrossibutanale
2-metilbenzaldeide
4-ossopentanale
4-idrossi-2-pentenale
cicloesilcarbaldeide
Butan-2-one