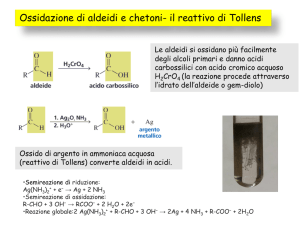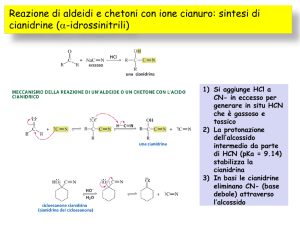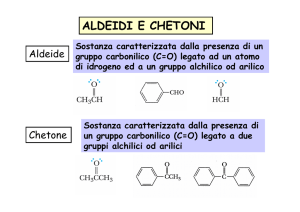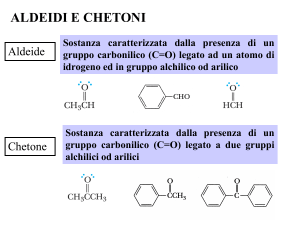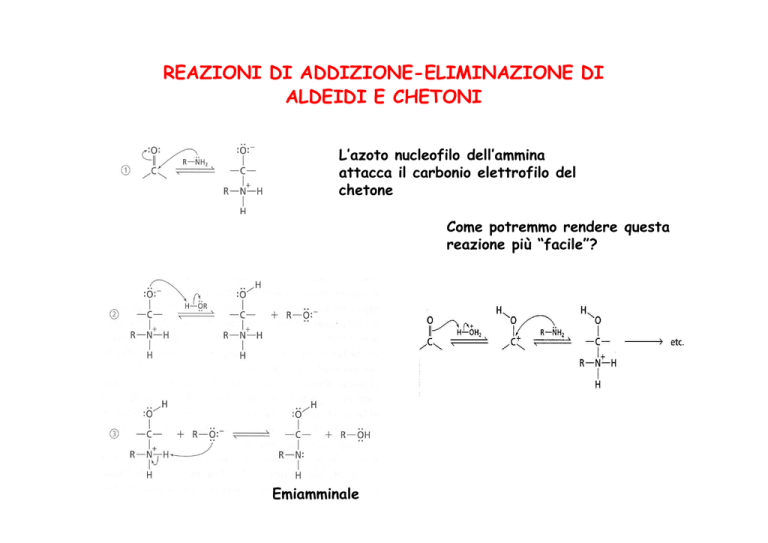
REAZIONI DI ADDIZIONE-ELIMINAZIONE DI
ALDEIDI E CHETONI
L’azoto nucleofilo dell’ammina
attacca il carbonio elettrofilo del
chetone
Come potremmo rendere questa
reazione più “facile”?
Emiamminale
La velocità della reazione però non continua ad aumentare con il decrescere
del pH. Perchè?
Ci chiediamo ora che cosa succede all’emiamminale che si è formato…
Altri reagenti possono
dare reazioni simili?
Immina; è il prodotto finale della reazione
Idrazina
Idrazone
Idrossilammina
Ma anche:
Ossima
Immine, idrazoni ed ossime possono essere idrolizzate
Per rigenerare il composto carbonilico di partenza
Un idrazone (X=NH2)
Che cosa può spostare l’equilibrio
verso l’idrolisi?
Una reazione che coinvolge un chetone (ma non un’aldeide!) e idrazina
con formazione di un idrazone è alla base della reazione di Wolff-Kishner
per trasformare il composto carbonilico in un gruppo metilenico
Stabilizzato per
delocalizzazione
ESEMPIO:
Una immina può essere ridotta ad ammina con un riducente come un idruro.
Idruri che si possono usare sono il NaBH4 o il LiAlH4
La formazione di legami imminici gioca un ruolo importante
nella stabilizzazione di proteine……
La catena laterale di una
lisina viene ossidata
Si forma un’aldeide
Reticolazione
Che cosa succede se invece di far reagire con un aldeide o
un chetone un’ ammina primaria usiamo una secondaria?
Emiamminale
Enammina
Questa formula limite di una enammina da conto del carettere basico o
nucleofilo dell’atomo di carbonio in a
Enammina si protona a ione imminio
Enammina funge da nucleofilo e attacca un alogenuro alchilico
Quest’ultima reazione costituisce un ottimo metodo per alchilare
in alfa un chetone in condizioni molto blande
Come vedremo in seguito l’alchilazione diretta in alfa di un chetone non è
una reazione così semplice
Un’altra classe di composti che da
reazioni di addizione-eliminazione con
aldeidi e chetoni è costituita dalle ilidi
di fosfonio
trifenilfosfoniometilide
Questa reazione è nota
come reazione di Wittig ed
è un metodo molto
importante per ottenere
doppi legami C=C a partire
da aldeidi o chetoni
ossafosfetano
REAZIONI DI ADDIZIONE-ELIMINAZIONE DI
ACIDI CARBOSSILICI E LORO DERIVATI
NOMENCLATURA
Acido benzoico
esanammide
Un estere
benzammide
2-etilesanammide
fenilbutanoato
N-etilesanammide
isopropilbenzoato
metlciclopentancarbossilato
Un gruppo acilico è quello che resta di un acido carbossilico
o di un suo derivato quando si toglie la parte che contiene
l’eteroatomo
Gruppo benzoilico o benzolile
pentanoile
formile
acetile
Un nucleofilo si addiziona al carbonio carbonilico di un derivato di un acido
carbossilico (come nel caso di aldeidi e chetoni) per dare un intermedio
tetraedrico che però può eliminare il gruppo legato all’eteroatomo
Questa reazione è tanto più
veloce tanto migliore è Xcome gruppo uscente
La situazione è molto diversa rispetto a quella che si verifica con aldeidi e chetoni
Il quadro della reattività
Un cloruro acilico
Una anidride
Un tioestere
Un estere
Una ammide
Reattività decrescente rispetto all’addizione nucleofila
Basicità crescente
Reattività decrescente rispetto all’eliminazione del gruppo uscente
Basicità crescente (con concomitante diminuzione crescente delle proprietà di gruppo uscente)
Come mai mancano gli acidi carbossilici?
In un acido carbossilico il sito elettrofilo principale è il
protone che quindi reagirà per primo
In presenza di catalisi acida però…..
In un acido carbossilico neutro il
protone è il sito elettrofilo principale
mentre in un acido carbossilico
proronato il sito elettrofilo è il carbonio
carbonilico
Questo è un metodo semplice
per sintetizzare esteri
Un lattone è un estere ciclico
Un β lattone
un γ lattone
un δ lattone
La formazione di un lattone dal corrispondete idrossiacido avviene
molto facilmente in presenza di tracce di acido
I cloruri degli acidi sono molto importanti perchè permettono di
sintetizzare molto facilmente tutti I derivati (percgè Cl- è un
ottimo gruppo uscente!)
I cloruri degli acidi si ottengono per reazione con cloruro di tionile
A partire dai cloruri si ottengono facilmente sia esteri che ammidi