COMPOSTI CARBONILICI
Aldeidi e Chetoni
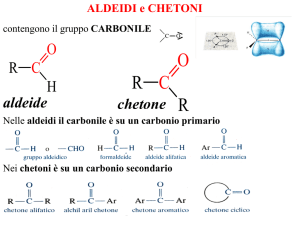
COMPOSTI CARBONILICI
Composti organici caratterizzati dal gruppo funzionale carbonilico.
Il gruppo carbonilico è planare, con angoli di legame di 120°.
Il doppio legame C=O consiste in un legame (sovrapposizione di due orbitali
ibridi sp2) e in un legame (sovrapposizione di due orbitali p).
Le due coppie di elettroni non condivise dell’ossigeno si trovano nei rimanenti
orbitali ibridi sp2.
COMPOSTI CARBONILICI
FORMULA
FAMIGLIA
FORMULA
O
R
R
C
O
Aldeidi
R
C
Esteri
H
O
O
O
C
Chetoni
R
C
R’
O
R
FAMIGLIA
C
OH
R’
Ammidi
NH2
Acidi
Carbossilici
O
R
C
Cl
Cloruri
Acilici
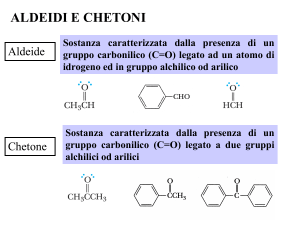
ALDEIDI E CHETONI
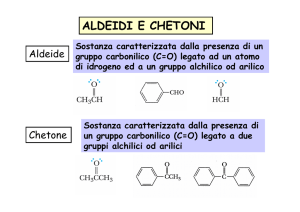
ALDEIDI
CHETONI
Nelle aldeidi, il gruppo carbonilico è
legato ad un atomo di idrogeno e ad
un atomo di carbonio.
Nei chetoni, il gruppo carbossilico è
legato a due atomi di carbonio.
Nella formaldeide, l’aldeide più
semplice, il gruppo carbonilico è
legato a due atomi di idrogeno.
In figura: Etanale o Acetaldeide
In figura: Propanone o Acetone
ALDEIDI E CHETONI
Nomenclatura aldeidi
• Il nome di una aldeide di ottiene dal nome dell’alcano corrispondente (catena
più lunga) sostituendo il suffisso -O con –ALE.
• La numerazione non è necessaria, essendo il gruppo aldeidico sempre
posizionato ad una estremità della catena (posizione 1).
• La presenza di doppi legami è indicata dall’infisso –EN e relativa numerazione.
Per molecole cicliche,
con il gruppo –CHO
direttamente attaccato
all’anello, il nome si
ottiene aggiungendo il
suffisso –CARBALDEIDE
al nome del ciclo.
La nomenclatura IUPAC mantiene
i nomi comuni per la benzaldeide
e la cinnamaldeide.
ALDEIDI E CHETONI
Nomenclatura chetoni
• Il nome di un chetone di ottiene dal nome dell’alcano corrispondente (catena
più lunga) sostituendo la desinenza -O con la desinenza –ONE.
• La catena è numerata a partire dell’estremità che permette di assegnare al
carbonio carbonilico il numero più basso.
• La presenza di doppi legami è indicata dall’infisso –EN e relativa numerazione.
La nomenclatura IUPAC mantiene
i nomi comuni per il benzofenone
e l’acetofenone.
ALDEIDI E CHETONI
Nomenclatura aldeidi e chetoni
Nel caso di aldeidi e chetoni che contengono più di un gruppo funzionale, la
nomenclatura IUPAC segue il seguente ordine di priorità:
ALDEIDI E CHETONI
Nomenclatura aldeidi e chetoni
Aldeidi e chetoni sono spesso indicati con nomi d’uso.
Derivano
dal
corrispondente
acido
carbossilico
cambiando il suffisso –ICO o –OICO in - ALDEIDE
ALDEIDI
CHETONI
Si assegnano ai gruppi alchilici o arilici legati al carbonio
carbonilico i loro nomi seguiti dalla parola CHETONE
ALDEIDI E CHETONI
Dove si trovano? Per cosa si utilizzano?
Sono composti naturali comuni nei sistemi viventi (ormoni) e sono spesso
caratterizzati da odori caratteristici: chetoni pungenti, aldeidi dolciastri.
Sono utilizzati come prodotti cosmetici (abbronzanti, acetone per unghie),
materie plastiche, isolanti, disinfettanti e conservanti (formaldeide).
Benzaldeide o
aldeide benzoica
(olio di mandorla)
vanillina
Aldeide cinnamica (cannella)
ALDEIDI E CHETONI
Dove si trovano? Per cosa si utilizzano?
ALDEIDI E CHETONI
Proprietà fisiche
Elettronegatività O (3.5) > Elettronegatività C (2.5)
Il doppio legame del gruppo carbonilico è polare, con l’ossigeno che porta una
parziale carica negativa e il carbonio una parziale carica positiva.
Nelle reazioni dei gruppi carbonilici quindi C si comporta da elettrofilo
(acido di Lewis) mentre O da nucleofilo (base di Lewis)
ALDEIDI E CHETONI
Proprietà fisiche
Aldeidi e chetoni sono quindi composti polari che presentano
interazioni intermolecolari di tipo dipolo-dipolo
1- PUNTO DI EBOLLIZIONE
Maggiore rispetto a quello di composti non polari di PM paragonabile
Le forze dipolo-dipolo sono più deboli (0,2-0,5 Kcal/mol) del legame idrogeno di
alcoli e acidi carbossilici (2-5 kcal/mol)
ALDEIDI E CHETONI
Proprietà fisiche
Aldeidi e chetoni possono solo accettare legami idrogeno ma non farli
2- SOLUBILITA’ IN ACQUA
Elevata in aldeidi e chetoni a basso PM
La solubilità decresce con l’aumentare del PM in quanto con l’aumento delle
dimensioni tendono a prevalere le proprietà della porzione apolare
ALDEIDI E CHETONI
Reattività
La reattività è controllata dalla polarizzazione del legame C=O.
La reazione principale è rappresentata dall’addizione di un nucleofilo al carbonio
carbonilico elettrofilo
MECCANISMO GENERALE
NOTA: CATALISI ACIDA
Gli acidi (elettrofili) catalizzano la reazione protonando l’ossigeno (nucleofilo)
Potenziamento del carattere elettrofilo del C carbonilico che favorisce l’attacco di nucleofili deboli
ALDEIDI E CHETONI
Reattività
DIFFERENZA DI REATTIVITÀ TRA ALDEIDI E CHETONI
Le aldeidi sono più reattive dei chetoni per due motivi:
Fattori elettronici
Il gruppo carbonilico è stabilizzato dai gruppi alchilici (R) a cui è legato (effetto
induttivo elettrondonatore).
Un chetone, avendo due gruppi R, è più stabile di una aldeide che ne ha uno solo.
La formaldeide, priva di R, è più reattiva delle altre aldeidi e dei chetoni.
Fattori sterici
In una reazione di addizione si ha un aumento di impedimento sterico al carbonio
carbonilico.
Composti come i chetoni, con gruppi ingombranti legati al carbonile, provocano
impedimento sterico e conseguente minore reattività.
REATTIVITA’
FORMALDEIDE > ALDEIDI > CHETONI
ALDEIDI E CHETONI
Reattività
• Reazioni di addizione nucleofila
1 -All’ossigeno (acqua e alcol)
Addizione di alcoli emiacetali ed acetali (carboidrati)
Addizione di acqua aldeide idrata
2 All’azoto (ammine primarie)
Addizione di ammine primarie immine (es retinale)
Tautomeria cheto-enolica
3 Al carbanione
Condensazione aldolica allungamento catena carboniosa
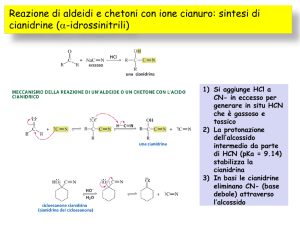
4 Allo ione cianuro
allungamento catena carboniosa in labor
•Riduzione
•Ossidazione passando da aldeide idrata
ALDEIDI E CHETONI
Reattività
1- Addizione di alcoli emiacetali ed acetali (carboidrati)
2- Addizione di ammine primarie immine (retinale)
3- Ossidazione
4- Riduzione
5- Tautomeria cheto-enolica
6- Condensazione aldolica
ALDEIDI E CHETONI
1- Addizione di alcoli
FASE I – Formazione Emiacetali
L’addizione di una molecola di alcol al gruppo carbonilico di una aldeide o di un
chetone forma un semiacetale. La reazione è favorita da una catalisi acida
Il gruppo funzionale dei semiacetali è rappresentato da un carbonio legato ad
un –OH e ad un –OR.
FASE II – Formazione Acetali
Gli emiacetali possono reagire ulteriormente con gli alcoli formando gli acetali e
acqua. La reazione è favorita da una catalisi acida.
Il gruppo funzionale degli acetali è rappresentato da un carbonio legato a due
gruppi –OR.
MECCANISMO GENERALE
ALDEIDI E CHETONI
1- Addizione di alcoli
FASE I – Formazione Semiacetali
Trasferimento di un protone dal
catalizzatore acido all’ossigeno
Addizione del
nucleofilo
(metanolo)
Formazione di un catione stabilizzato
per risonanza (elettrofilo)
Emiacetale
protonato
ALDEIDI E CHETONI
1- Addizione di alcoli
FASE II – Formazione Acetali
Trasferimento di un protone dal
catalizzatore acido al gruppo OH
Formazione di un catione stabilizzato
per risonanza (elettrofilo)
Acetale
protonato
Formazione dello ione ossonio
e successiva perdita di acqua
Attacco del nucleofilo
(metanolo)
ALDEIDI E CHETONI
1- Addizione di alcoli
OSSERVAZIONI
Gli acetali sono composti inerti nei confronti di basi, agenti riducenti e ossidanti
sono usati come protettori di gruppi carbonilici di aldeidi e chetoni durante
reazioni condotte su gruppi funzionali presenti in altre parti della molecola
La reazione di formazione di emiacetali e acetali è particolarmente importante
quando il gruppo -OH e il gruppo C=O sono vicini all’interno della stessa molecola
In questo caso il composto esiste quasi completamente nella forma emiacetalica
ciclica (anello a 5 o 6 membri) che si genera per addizione nucleofila
intramolecolare: il gruppo –OH agisce da nucleofilo sul C carbonilico.
5-Idrossipentanale
ALDEIDI E CHETONI
1- Addizione di alcoli
OSSERVAZIONI
I monosaccaridi hanno gruppi ossidrilici e carbonilici vicini nella stessa molecola
esistono quasi esclusivamente come emiacetali ciclici a 5 o 6 membri
-D-Glucosio
D-Glucosio
-D-Glucosio
-D-Fruttosio
(forma emiacetalica del fruttosio)
D-Fruttosio
ALDEIDI E CHETONI
Reattività
1- Addizione di alcoli emiacetali ed acetali (carboidrati)
2- Addizione di ammine primarie immine (retinale)
3- Ossidazione
4- Riduzione
5- Tautomeria cheto-enolica
6- Condensazione aldolica
ALDEIDI E CHETONI
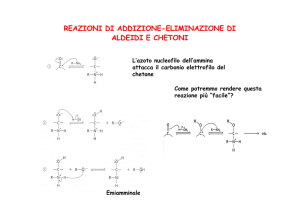
2- Addizione di ammine primarie
Le ammine primarie reagiscono con il gruppo carbonilico di aldeidi e chetoni in
presenza di un catalizzatore acido per dare un prodotto che contiene un doppio
legame carbonio-azoto chiamato immina.
MECCANISMO GENERALE
ALDEIDI E CHETONI
2- Addizione di ammine primarie
STADIO I - Addizione nucleofila dell’ammina
trasferimento di un protone dall’azoto all’ossigeno:
al
carbonile
seguita
da
STADIO II - Protonazione del gruppo OH seguita dalla perdita di acqua, dal
trasferimento di un protone al solvente e dalla formazione del doppio legame:
ALDEIDI E CHETONI
2- Addizione di ammine primarie
IMPORTANZA DELLE IMMINE NELLE REAZIONI BIOCHIMICHE
La vitamina A è essenziale per il funzionamento dei bastoncelli, fotorecettori
preposti alla visione in bianco e nero.
Per ossidazione è trasformata nella sua forma aldeidica attiva, il retinale.
Nella retina umana, il retinale si lega al gruppo amminico dell’opsina sottoforma
di una immina chiamata rodopsina o porpora visiva, pigmento fotosensibile.
ALDEIDI E CHETONI
Reattività
1- Addizione di alcoli emiacetali ed acetali (carboidrati)
2- Addizione di ammine primarie immine (retinale)
3- Ossidazione
4- Riduzione
5- Tautomeria cheto-enolica
6- Condensazione aldolica
ALDEIDI E CHETONI
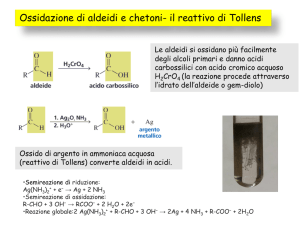
3- Ossidazione
Le aldeidi sono ossidate ad acidi carbossilici da molti agenti ossidanti comuni
come H2CrO4 e O2.
agente
ossidante
Il meccanismo
passa per
l’aldeide idrata
nel nostro
organismo
Saggio di Tollens – prova dello specchio di argento
Ione complesso
argento-ammoniaca
Metodo raramente usato per ossidare
le aldeidi
Reazione ancora usata per argentare
vetri e specchi
ALDEIDI E CHETONI
Reattività
1- Addizione di alcoli emiacetali ed acetali (carboidrati)
2- Addizione di ammine primarie immine (retinale)
3- Ossidazione
4- Riduzione
5- Tautomeria cheto-enolica
6- Condensazione aldolica
ALDEIDI E CHETONI
4- Riduzione
Le aldeidi sono ridotte ad alcol primari ed i chetoni al alcol secondari con idruri
metallici (NaBH4 e LiAlH4) o con H2 (riduzione catalitica).
RIDUZIONE CON IDRURI METALLICI no meccanismo
Lo ione idruro (H-) è un nucleofilo ed è in grado di attaccare il carbonio elettrofilo
del carbonile riducendolo ad alcol.
Trasferimento di uno
ione idruro dall’agente
riducente al C carbonilico
Addizione di un
atomo di idrogeno
derivante dall’acqua
(idrolisi)
Formazione di un
intermedio tetraedrico di
addizione al carbonile
Formazione di un
alcol primario
ALDEIDI E CHETONI
Reattività
1- Addizione di alcoli emiacetali ed acetali (carboidrati)
2- Addizione di ammine primarie immine (retinale)
3- Ossidazione
4- Riduzione
5- Tautomeria cheto-enolica
6- Condensazione aldolica
ALDEIDI E CHETONI
5- Tautomeria cheto-enolica
Aldeidi e chetoni possono esistere all’equilibrio come miscela di due forme:
chetonica ed enolica. L’equilibrio è spostato verso la forma chetonica.
Le due forme sono tra loro isomeri costituzionali e differiscono
localizzazione di un atomo di idrogeno e di un doppio legame (tautomeri).
Forma chetonica
Condizione per l’esistenza all’equilibrio
delle forme chetonica ed enolica è la
presenza di un atomo di idrogeno
(detto idrogeno in ) legato al carbonio
in adiacente al carbonile
Forma enolica
idrogeno in
carbonio in
nella
ALDEIDI E CHETONI
Reattività
1- Addizione di alcoli emiacetali ed acetali (carboidrati)
2- Addizione di ammine primarie immine (retinale)
3- Ossidazione
4- Riduzione
5- Tautomeria cheto-enolica
6- Condensazione aldolica
ALDEIDI E CHETONI
6- Condensazione aldolica
ACIDITA’ DEGLI IDROGENI IN
E FORMAZIONE DI ANIONI ENOLATO
un legame C-H è poco polare e
un atomo di H legato a un C ha
bassissima acidità.
C e H hanno elettronegatività paragonabili
Diversamente accade agli idrogeni in α di un gruppo carbonilico che sono
considerevolmente più acidi degli H alchilici. Perché??
1- Effetto induttivo elettron-attrattore del
gruppo carbonilico che indebolisce il legame CH e ne promuove la ionizzazione.
+
ANIONE ENOLATO
-
2La
carica
negativa
presente
sull’anione enolato è delocalizzata per
risonanza, distribuendosi fra il carbonio
in alfa e l'atomo di ossigeno carbonilico.
ALDEIDI E CHETONI
7- Condensazione aldolica
Reazione in cui gli anioni enolato agiscono come nucleofili nell’addizione al
carbonile portando alla formazione di nuovi legami C-C.
I prodotti che derivano dalle reazioni di condensazione aldolica sono
comunemente chiamati aldoli, perché presentano funzionalità sia alcolica che
aldeidica.
MECCANISMO GENERALE
Composto
carbonilico
(elettrofilo)
Anione
enolato
(nucleofilo)
Nuovo legame C-C
ALDEIDI E CHETONI
7- Condensazione aldolica
STADIO I - Rimozione di un idrogeno in tramite una base forte e formazione di
un anione enolato.
STADIO II – Addizione nucleofila dell’anione enolato ad un carbonio carbonilico di
un’altra aldeide (o chetone) e formazione di un intermedio tetraedrico di
addizione al carbonile.
ALDEIDI E CHETONI
7- Condensazione aldolica
STADIO III – Reazione dell’intermedio con un donatore di protoni (acqua),
formazione dell’aldolo e rigenerazione del catalizzatore (OH-).
STADIO IV – L’aldolo prodotto ha ancora protoni acidi in α e quindi può generarsi
nuovamente l’anione enolato corrispondente.
Questo può dare luogo ad una ulteriore condensazione con un’altra molecola di
aldeide (o chetone), ottenendo trimeri o oligomeri.