ALDEIDI E CHETONI
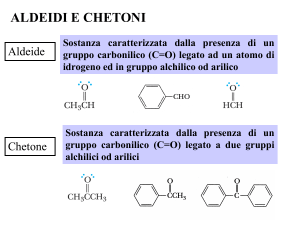
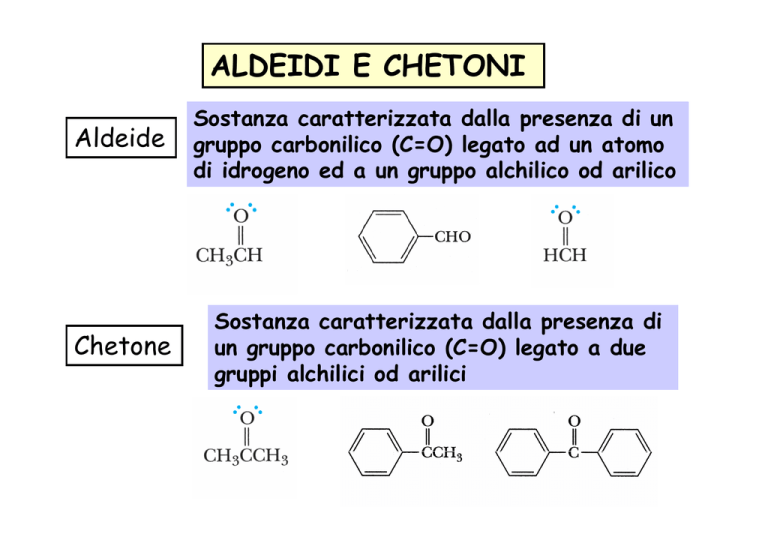
Aldeide
Sostanza caratterizzata dalla presenza di un
gruppo carbonilico (C=O) legato ad un atomo
di idrogeno ed a un gruppo alchilico od arilico
Chetone
Sostanza caratterizzata dalla presenza di
un gruppo carbonilico (C=O) legato a due
gruppi alchilici od arilici
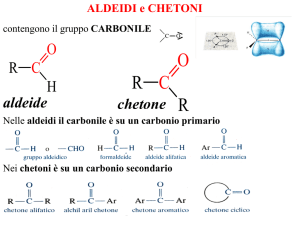
Il gruppo carbonilico
120°
R
120°
σ
R
C σ O
σ
R
C
R
O
120°
R
R
C
π
σ
O
Nomenclatura delle Aldeidi
Il nome dell’aldeide si ricava cambiando il suffisso
dell’alcano in
metanale
(formaldeide)
2-propenale
-ale
etanale
(acetaldeide)
–o
3-metilbutanale
ciclopentancarbaldeide
benzaldeide
Nomenclatura dei Chetoni
Il nome del chetone si ricava cambiando il
suffisso
–o
Propanone
(acetone)
dell’alcano in
-one
5-metil-3-esanone
Acetofenone
2-metilcicloesanone
Benzofenone
Regole per assegnare il nome IUPAC a
composti con più gruppi funzionali diversi
Ordine di precedenza crescente di sei gruppi funzionali
Proprietà fisiche di aldeidi e chetoni
Il gruppo carbonilico è polarizzato, il che rende aldeidi e
chetoni molecole polari aventi, quindi, dei punti di ebollizione
più alti di composti non polari di pari peso molecolare.
Il gruppo carbonilico è polarizzato in
ragione della differenza di
elettronegatività tra carbonio ed
ossigeno.
Alla stessa conclusione si
arriva evidenziando che il
carbonile è l’ibrido di due
strutture limite di
risonanza
Reazioni dei composti carbonilici
Il carbonio carbonilico, avente una parziale carica positiva (δ+),
è un centro elettrofilo, in grado di reagire con i nucleofili
δ+
δ-
Carbonio con geometria
trigonale planare, ibridato
sp2
Carbonio tetraedrico,
ibridato sp3
Questa reazione
reazione prende
prende ilil nome
nome di
di
Questa
ADDIZIONE NUCLEOFILA
NUCLEOFILA AL
AL CARBONILE
CARBONILE
ADDIZIONE
SINTESI DI
EMIACETALI
Addizione di alcoli (nucleofili
all’ossigeno) ad aldeidi o chetoni
EMIACETALE
da una aldeide
da un chetone
Il gruppo
funzionale
caratteristico
di un
emiacetale
Meccanismo della formazione di emiacetali
1° stadio: addizione dell’alcool al carbonile
+
2° stadio: equilibrio rapido di protonazione-deprotonazione
+
emiacetale
Gli emiacetali possono ulteriormente reagire con una molecola
di alcol a dare gli ACETALI più una molecola di H2O
E’ necessaria la catalisi acida !
ACETALE
Il gruppo
funzionale
caratteristico
di un acetale
da una aldeide
da un chetone
Stadio 1
Stadio 2
Stadio 3
Stadio 4
Meccanismo di
reazione per la
formazione di
acetali
La reazione complessiva per la formazione di acetali
è una reazione di equilibrio
Un eccesso di alcol spinge
l’equilibrio verso la
formazione dell’acetale
La rimozione dell’acqua favorisce
la formazione dell’acetale
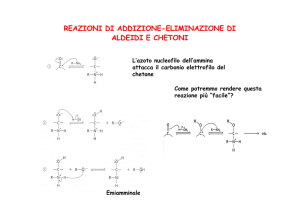
Addizione di ammoniaca e ammine (nucleofili all’azoto)
Immina
Immina
Meccanismo di formazione di una immina
Stadio 1
Stadio 2
Un esempio dell’importanza delle immine nei
sistemi biologici
Rodopsina
11-cis-retinale
(Porpora visiva)
(vitamina A)
Proteina opsina
(legata alla retina)
Composti organomagnesiaci (reattivi di Grignard)
1-clorobutano
Cloruro di n-butilmagnesio
La differenza di
elettronegatività tra il C e il
Mg è 1.3; il legame è
fortemente polarizzato
Carattere di CARBANIONE (C nucleofilo)
I reattivi di Grignard sono anche basi molto forti
(l’atomo basico è il carbonio)
Base più forte
Acido più forte Acido più debole
Base più debole
Tutti i seguenti composti sono acidi nei confronti dei reattivi
di Grignard (cioè, riescono a cedere loro un protone)
I reattivi di Grignard si addizionano facilmente ai
composti carbonilici
Addizione alla
alla formaldeide
formaldeide
Addizione
Alcol primario
primario
Alcol
Alcol primario
Addizione ad
ad una
una aldeide
aldeide
Addizione
Alcol
Alcol
secondario
secondario
Alcol secondario
Addizione ad
ad un
un chetone
chetone
Addizione
Alcol terziario
terziario
Alcol
Alcol terziario
Addizione ad
ad anidride
anidride
Addizione
carbonica
carbonica
Acido
Acido
carbossilico
carbossilico
Acido carbossilico
Addizione all’epossido
all’epossido
Addizione
Alcol primario
primario
Alcol
con due
due atomi
atomi di
di
con
carbonio in
in più
più
carbonio
Forma chetonica ed enolica dei composti
carbonilici
Questo è un equilibrio cheto-enolico
forma chetonica
Più stabile
forma enolica (”en” + ”olo”)
tautomeri
Questo equilibrio è detto anche
TAUTOMERIA CHETO-ENOLICA
La posizione dell’equilibrio per quattro aldeidi e chetoni
Forma
chetonica
Forma
enolica
% all’equilibrio di forma enolica
La tautomeria cheto-enolica è catalizzata dagli acidi
Stadio 1
Stadio 2
Idrogeni in α
Carboni in α
Racemizzazione al carbonio in α al carbonile
Conversione di un enantiomero
puro in una miscela racemica
Racemizzazione
acido
(R)-3-fenil-2-butanone
acido
Enolo achirale
(S)-3-fenil-2-butanone
Questo meccanismo di racemizzazione avviene solamente
agli stereocentri in α che legano almeno un idrogeno
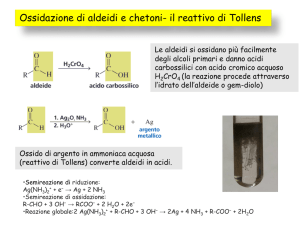
Ossidazione delle
delle
Ossidazione
aldeidi
aldeidi
acido esanoico
esanale
alcol primario
Acidi carbossilici
carbossilici
Acidi
aldeide
acido carbossilico
I chetoni, a differenza delle aldeidi, non sono
facilmente ossidati
Il reattivo di Tollens come
ossidante tipico delle aldeidi
Precipita come
specchio di argento
(Ag metallico)
Riduzione di aldeidi e chetoni
Riduzione delle
delle aldeidi
aldeidi
Riduzione
Alcoli primari
primari
Alcoli
riducente
Riduzione dei
dei chetoni
chetoni
Riduzione
Alcoli secondari
secondari
Alcoli
Riduzione con idruri metallici
Sodio boroidruro
metanolo
Litio alluminio idruro
ione idruro
Sali
dell’
acido
borico
Meccanismo della riduzione con idruri
Altre
tre
volte
1)
H che proviene dall’acqua
Sali dell’acido borico
2)
Tetra-alchilborato
H che proviene dal riducente
LiAlH4 è un riducente molto più forte di NaBH4
Amminazione riduttiva di aldeidi e chetoni
Formazione di una immina seguita
dalla sua riduzione ad ammina
chetone
immina
ammina