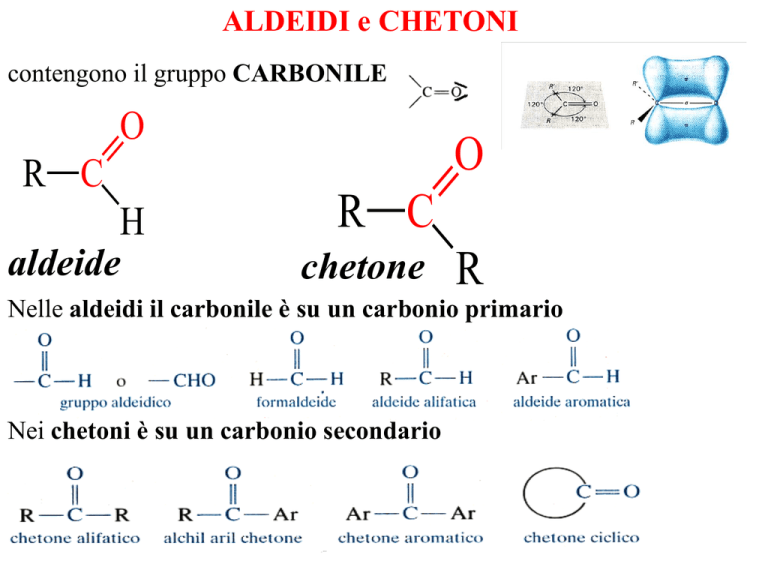
ALDEIDI e CHETONI
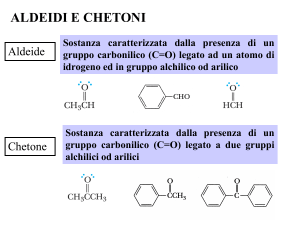
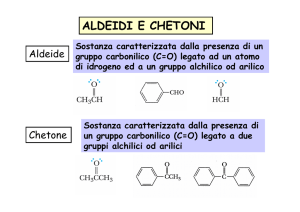
contengono il gruppo CARBONILE
O
R C
H
aldeide
O
R C
chetone
R
Nelle aldeidi il carbonile è su un carbonio primario
Nei chetoni è su un carbonio secondario
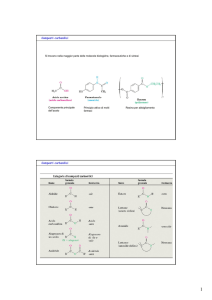
Nomenclatura
Nelle aldeidi la desinenza e’ -ale
Nomenclatura
Nei chetoni la desinenza e’ -one
Il gruppo sostituente RCO- è chiamato alcanoile o acile
Continuo Nomenclatura
Quando un chetone è un sostituente in
catena si riferisce ad esso
come gruppo osso.
Mentre quando l’aldeide è il
sostituente di un anello ci si riferisce
ad essa come carbaldeide
O
O
5
1 H
esanale
5-ossoesanale
O
H
cicloesancarbaldeide
Se il gruppo carbonilico viene
considerato il sostituente in una
catena ci si riferisce come gruppo
acilico ed il nome è formato dal
suffisso -il.
H3C
Composti naturali
1. Preparazione di Aldeidi e Chetoni
Reazioni di ossido-riduzione
•Ossidazione degli alcoli con sali di
Cr(VI) con uso di Clorocromato di
piridinio C5H5N+H·CrO3Cl- PCC
Aldeide da alcool primario
N.B.
Chetone da alcool secondario
alcol 1° aldeide carbossile
alcol 2° chetone X
alcol 3° X
OH
-1
H C H
H C H
H
etanolo
Cr2O7--
(H+)
Cr+++
O
+1
H
C
H C H
H
etanale
Gli alcoli primari si ossidano ad aldeidi.
Per ulteriore azione degli ossidanti,
le aldeidi si convertono in acidi carbossilici
+3
OH
C
O +1 H
C
O
H C H
H C H
H
H
etanale
ac. etanoico
2. Preparazione di Aldeidi e Chetoni
• Riduzione dei derivati degli acidi (cloruri acilici, esteri) con riducenti vari ,
generalmente: Idrogeno e catalizzatori; idruri metallici con opportuni solventi.
A. Riduzione degli esteri con alcoli con idruri di Al
– Esteri → Aldeidi con diisobutilalluminio idruro (DIBAH)
B. Trattando un cloruro acilico con H2 e un catalizzatore
parzialmente disattivato si ottiene un'aldeide.. Tale
reazione viene definita sintesi di Rosenmund. Si usa H2
con Pd e solfato di bario e chinolina.
H2 con Pd
C. Acilazione di Friedel-Crafts
Sostituzione elettrofila sul benzene
‒ Areni → Arilchetoni
Calore
Proprietà Fisiche
MODERATA POLARITÀ Dovuta al gruppo C=O
C
O
PUNTO DI EBOLLIZIONE
• Basso rispetto a quella degli alcoli corrispondenti per l’incapacità (ad ecc. del
metanale) di formare forti legami ad idrogeno.
• Alto rispetto a quella degli eteri corrispondenti e agli alcani a causa della
maggiore polarità.
N.B. Il gruppo C=O è polare e può formare legami ad idrogeno con acqua e con altri
gruppi carbonilici
SOLUBILITÀ
La solubilità in acqua dei termini a più basso peso molecolare, riflette il carattere polare
del gruppo funzionale.
Essa decresce con l’aumentare della catena di R e R’
Proprietà fisiche di aldeidi semplici e chetoni
Strutture molecolari
Polarizzazione del carbonile
O
R C
O
R C
R
Risonanza fra due forme limite
R
+
N.B.Aldeidi e chetoni sono tra i composti più
reattivi della chimica organica
Reattività del gruppo carbonilico:
addizione nucleofila
• Le reazioni di addizione nucleofila hanno un ruolo importante in questa classe
di composti.
-
C
+
O
R
R'
O
R
C
R'
Z
-
Z
:Z può avere una carica negativa (es. ione cianuro) o
può più semplicemente disporre di una coppia di
elettroni in grado di interagire con la carica positiva al
carbonio carbonilico.
L’interazione tra la carica (+) sul carbonio e quella (-) o
(-) del nucleofilo porta alla formazione di un legame
(freccia).
Meccanismo di reazione
•Il carbonio può fare solo quattro legami pertanto la formazione
del nuovo legame deve corrispondere alla dismissione di uno dei
precedenti
•L’ossigeno che è l’elemento più elettronegativo attira gli elettroni di uno dei due
legami col carbonio e prende quindi una carica
negativa mentre Z che ha fornito gli elettroni
per il legame Z-C cede la carica negativa o
prende una carica positiva se disponeva solo di
una coppia di elettroni
O
R
C
R'
Z
•Lo zwitterione (ione recante contemporaneamente una carica positiva ed una negativa)
non è stabile e reagisce con l’acqua neutralizzando le sue cariche
In particolare
•Gli ALCOLI sono nucleofili (a causa
delle coppie di elettroni all’ossigeno) e
pertanto reagiscono con le aldeidi.
•Il prodotto finale prende il nome di emi-acetale. Questi sono molto importanti nella chimica
dei carboidrati
Più reattiva un aldeide o un chetone??
Nu:
Nu:
Le aldeidi sono più reattive perché i sostituenti alchilici sono
gruppi donatori che diminuiscono la parziale carica positiva
sul carbonio carbonilico.
La minore reattività dei chetoni deriva anche da un maggior
ingombro sterico.
Addizione nucleofila
• Gli acidi catalizzano l’addizione nucleofila per protonazione dell’ossigeno
• Addizione di alcoli: semiacetali ed acetali
•Acetali
•In presenza di un eccesso di alcol i
semiacetali reagiscono ulteriormente
fornendo gli acetali.
L'ossidrile del semiacetale viene sostituito da un gruppo alcossile. Negli acetali due
funzioni eteree sono presenti sullo stesso atomo di carbonio.
Il meccanismo consiste nei due stadi seguenti
Semiacetali ciclici
Composti con un gruppo aldeidico e un ossidrile a distanza appropriata all’interno della
stessa molecola sono in equilibrio col semiacetale ciclico che si forma per addizione
nucleofíla intramolecolare.
L'ossidrile si trova in
posizione favorevole per
poter agire da nucleofilo
sul carbonio con un
meccanismo specifico:
I composti nei quali l'ossidrile dista quattro o
cinque atomi di carbonio dal gruppo aldeidico
hanno una forte tendenza a formare semiacetali
ed acetali ciclici, perché gli anelli a cinque e a sei
termini sono privi di tensioni quindi stabili.
Emiacetali nei carboidrati
•Il glucosio è un aldo esoso (contiene un gruppo
aldeidico e diversi gruppi alcolici:
•Esso esiste nella forma aperta solo in piccolissima
quantità
•Invece, con l’-OH in posizione 5 si ha reazione di
emiacetalizzazione con formazione di un anello a
sei atomi.
L’aldeide a catena aperta rappresenta circa l’1%.
Semiacetali non ciclici
Per i derivati non-ciclici, la
formazione di emiacetali dà
luogo ad un prodotto instabile
che facilmente si decompone
riformando l’aldeide e l’alcol.
Sotto appropriate condizioni
tuttavia, la reazione può
procedere con la formazione di
un acetale
Un semplice esempio di
questa reazione:
Lo stesso avviene nel caso dei
chetoni solo che i prodotti sono
chiamati rispettivamente
semichetali e chetali
Riepilogo
Aldeide o Chetone
K2Cr2O7
LiAlH4
Riduzione
Ossidazione
se
aldeide
se
se
chetone aldeide
ROH
Emi- formazione
se
chetone
se
aldeide
se
chetone
Emiacetale
Acido
carbossilico
No
reazione
Alcol
primario
Alcol
seconderio
Emichetale
Reagisce
con alcol
Acetale
Chetale
Altre Reazioni
A.
B.
C.
Ossidazione
D. Addizione di HCN
F. Condensazione aldolica
Addizione di H2
E. Addizione dei reattivi di
Addizione di Azoto derivati. Grignerd.
G. Alogenazione
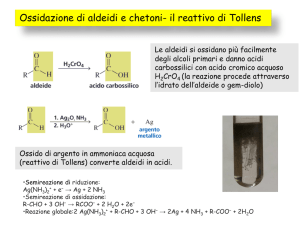
A. Ossidazione
Conversione delle aldeidi ad acidi carbossilici
B. Addizione di H2
Test di Tollen’s
L’argento precipita formando uno specchio
In un processo opposto alla ossidazione, aldeidi e chetoni si riducono ai rispettivi alcoli
La reazione può avvenire con idrogenazione catalitica o mediante attacco nucleofilo da parte di idruri
metallici (es. NaBH4 ed il più efficace LiAlH4)
La riduzione aggiunge
essenzialmente una molecola di
idrogeno al doppio legame C=O
C. Addizione di Azoto derivati.
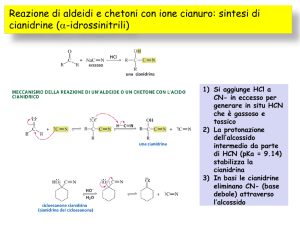
1. Addizione di acido cianidrico
L'acido cianidrico si addiziona al
carbonile delle aldeidi e dei chetoni per
formare le cianidrine
2.
Addizione di Ammoniaca e derivati
Aldeidi e chetoni reagendo con ammoniaca e
ammine primarie formano le immine(aldoimmine
e chetoimmine)
Le immine derivate dell’ammoniaca sono estremamente reattive e possono polimerizzare
dato che l’azoto resta parzialmente nucleofilo.
Il meccanismo della sintesi delle immine avviene in due tempi
1°
2°
Continuazione dell’addizione di Azoto derivati.
• Con idrossilammina si ottengono ossime:
•Con idrazina (NH2-NH2) si ottengono idrazoni e
con fenilidrazina, fenilidrazoni
N.B.nella reazione di formazione del fenilidrazone il doppietto che opera l'attacco
nucleofilo sul gruppo carbonilico è quello dell'azoto non direttamente legato all'anello.
Il doppietto dell'azoto legato all'anello è risonante sull’anello.
• Con acido cianidrico si ottengono le cianidrine
composti molto importanti, in quanto le ritroviamo come
intermedi nella sintesi degli amminoacidi
D. Addizione dei reattivi di Grignard.
I reattivi di Grigrard reagiscono con aldeidi e chetoni con una addizione nucleofila
formando alcoli superiori.
F. Condensazione aldolica
Le aldeidi, se trattate in ambiente acquoso moderatamente basico, danno condensazione
aldolica, cioè due aldeidi condensano tra di loro per formare le beta idrossi aldeidi
chiamate aldoli.
Meccanismo della condensazione aldolica
Il primo passaggio della reazione è la tautomeria cheto enolica catalizzata dalle basi
che produce enolati.
N.B.Tautomeria Cheto-Enolica
Poi una reazione di addizione nucleofila al carbonile
di un’altra aldeide con formazione di un alcossido che
nell’ultimo passaggio si protona formando l’aldolo.
L’aldolo per riscaldamento
si può disidratare a
dare un alchene, in cui
il doppio legame è
coniugato con quello
carbonilico
Riepilogo
1)
H
H aC C
H
H
H
OH-
C C
C C
O
H2O
H
H
H
H
O
O
H
Nella prima tappa si produce un anione enolato ...
H
2) H C C
H
H
H
H H H
H C C C C
C C
O
O
H O H
H
H
…che nella tappa successiva compie un attacco nucleofilo su
una seconda molecola di aldeide.
H H H
3)
H
H C C C C
H O H
O
H
H2O
OH-
H H H
H
H C C C C
H OH H
O
Nell’ultima tappa della reazione si forma una b-idrossialdeide.
O
Riepilogo Reazioni delle Aldeidi e dei Chetoni
Idratazione
Sintesi semiacetali
Sintesi Cianidrine
Sintesi acetali
Sintesi alcooli
Riduzione ad alcooli
Sintesi di immine
Riduzione ad idrocarburi
Sintesi di immine
FINE