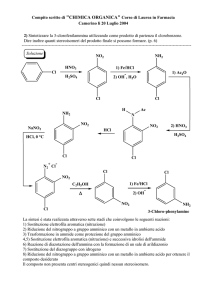
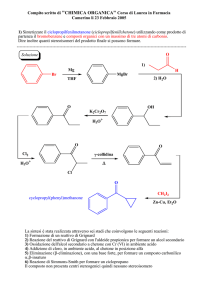
H
H
Etilene: il legame σ
H
Nodo
H
H
H
C
C
H
Interazione σ*
negativa
H
orbitale molecolare di antilegame
E
H
H
C
C
H
H
∆E σ
orbitale molecolare di legame
H
H
C
H
C
H
Interazione
positiva
H
H
Etilene: il legame π
H
H
Nodo
H
C
H
C
H
H
Interazione π*
negativa
Orbitale molecolare di legame
E
H
H
C
C
H
H
∆E π
Orbitale molecolare di antilegame
H
H
C
C H
H
Interazione π
positiva
H
Butadiene: orbitali π
H
H
H
H
H
π4
π3
E
π2
π1
-
+
-
+
-
+
+
-
-
+
-
+
+
+
+
-
-
-
-
+
+
+
+
+
+
-
-
-
-
+
-
Debole interazione π
Tre nodi
π4
Due nodi
π3
Un nodo
π2
Nessun nodo π1
Legame π
Legame π
H
1.34 Å
H
1.09 Å
H
1.47 Å
122.9°
H
H
119.5°
H
Butadiene: stabilità dei conformeri s-cis e s-trans
H
Ea= 3.9 kcal/mol
H
H
H
H
H
H
H
H
H
H
H
s-cis
s-trans
∆H° = -2.8 kcal mol-1
La stabilità del butadiene è confermata dal suo calore
di idrogenazione
Alcheni non coniugati
CH3CH2CH=CH2 + H2
CH2=CHCH2CH2CH=CH2 + H2
CH2=CHCH2CH=CH2 + H2
Pt
Pt
Pt
CH3CH2CH2CH3
∆ H° = - 30.3 kcal mol-1
CH3(CH2)4CH3
∆ H° = - 60.5 kcal mol-1
CH3(CH2)3CH3
∆ H° = - 60.8 kcal mol-1
CH3CH2CH2CH3
∆ H° = - 57.1 kcal mol-1
1,3-Butadiene
CH2=CHCH=CH2 + H2
Pt
Il calore di idrogenazione del butadiene
2 CH 3CH 2CH=CH2
E
∆E = - 3.5 kcal mol -1
+ 2 H2
∆Ε = - 60.6 kcal mol-1
2 CH 3CH2 CH 2CH3
CH 2=CHCH=CH2 +
CH3 CH 2CH2CH3 *
+ 2 H2
∆Ε = - 57.1 kcal mol-1
Benzene: geometria e struttura elettronica
1.09 Å
1.39 Å
120°
H
H
120°
120°
legame π
H
H
H1s -Csp2
H
H
H
Csp2 -Csp2
H
Le formule di risonanza del benzene
Kekulé
Dewar
Il sogno di Kekulé sulla struttura del benzene
During my stay in Ghent, I lived in elegant bachelor quarters in the main thoroughfare. My
study, however, faced a narrow side alley and no daylight penetrated it...I was sitting writing on
my textbook, but the work did not progress; my thoughts were elsewhere. I turned my chair to
the fire and dozed. Again the atoms were gamboling before my eyes. This time the smaller
groups kept modestly in the background. My mental eye, rendered more acute by the repeated
visions of the kind, could now distinguish larger structures of manifold conformation; long rows
sometimes more closely fitted together all twining and twisting in snake-like motion. But look!
What was that? One of the snakes had seized hold of its own tail, and the form whirled
mockingly before my eyes. As if by a flash of lightning I awoke; and this time also I spent the
rest of the night in working out the consequences of the hypothesis.
Le formule a salsiccia di Kekulé
August Kekulé, Bulletin de la Société Chimique de France, 3, 98 (1865)
... per chiarezza rappresento le formule grafiche di diverse sostanze. L'idea che queste formule rappresentano è ora ben
nota... Ho mantenuto la formulazione che avevo già adottato nel 1859 presentando per la prima volta il mio punto di vista
sulla struttura atomica delle molecole.... Devo far notare che per la catena chiusa C6A6 ho voluto mantenere la linea
orizzontale e usare le frecce per indicare le estremità che si saturano tra loro....i punti delle prime due formule indicano le
affinità non saturate....
Il benzene è molto meno reattivo dell'etilene
Riduzione:
CH2=CH2
H2/Pd
CH3CH3
25 °C
H2/Pd
Reagisce molto lentamente
25 °C
Ossidazione:
CH2=CH2
KMnO4
25 °C
HO
KMnO4
OH
Non reagisce
25 °C
Bromurazione:
CH 2=CH2
Br2
CCl 4
Br2
CCl4
Br
Br
Non reagisce
Il calore di idrogenazione del 1,3,5-cicloesatriene
+ H2
+ 2 H2
+ 3 H2
catalizzatore
∆ H° = - 28.6 kcal mol-1
catalizzatore
∆ H° = - 54.9 kcal mol-1
catalizzatore
∆ H° = 3 ( ∆ H° di idrogenazione di
∆ H° = ?
) + 3 (correzione per la risonanza nel
= (3 x -28.6) + (3 x 2.3) kcal mol-1
= -85.8 + 6.9 kcal mol-1
= -78.9 kcal mol-1
)
Il calore di idrogenazione del benzene
1,3,5-cicloesatriene
+ 3 H2
1,3-cicloesadiene
+ 2 H2
benzene
3 H2 +
Energia di risonanza =
29.6 kcal mol-1
cicloesano
-78.9 kcal mol-1
(teorico)
+ H2
-54.9 kcal mol-1
-28.6 kcal
-49.3 kcal mol-1
mol-1
cicloesano
Benzene: orbitali molecolari
Ψ6
E
Ψ4
Ψ5
Ψ2
Ψ3
Ψ1
Livelli di energia degli orbitali molecolari
del benzene e dell' 1,3,5-esatriene
E
Orbitali molecolari di antilegame
Orbitali molecolari di legame
più stabile
meno stabile
L'alta stabilità del benzene è associata all'occupazione
completa degli orbitali di legame.
Regola di Hückel *
Ogni poliene ciclico, completamente coniugato e planare è aromatico se possiede :
(4n + 2) elettroni π
dove n = 0, 1, 2.....
Erich Armand Arthur Joseph
Hückel
• Erich Hückel nacque a
Charlottenburg (Berlino) e morì
a Marburg nel 1980 dove fu
professore di fisica. Sviluppò
insieme a Debye una importante
teoria degli elettroliti forti, nota
ora come teoria di DebyeHückel. Successivamente
formulò una teoria del legame
C=C, fondata sulla meccanica
quantistica, la famosa teoria di
Hückel.
Idrocarburi aromatici polinucleari: naftalene
1.42 Å
1.37 Å
1.40 Å
1.21°
1.39 Å
Idrocarburi aromatici polinucleari:
antracene e fenantrene
Antracene
Fenantrene
Eterocicli aromatici
Tiofene
Pirrolo
S
N
H
L'atomo di S contribuisce con un
doppietto al sestetto aromatico
L'atomo di N contribuisce con un
doppietto al sestetto aromatico
Piridina
N
L'atomo di N contribuisce con un
elettrone al sestetto aromatico ed ha
anche un doppietto non condiviso
Anioni aromatici
H
t-BuOK
-
H
H
Ciclopentadiene
(pka = 15)
Anione ciclopentadienile
(6 elettroni π)
Strutture di risonanza dell'anione ciclopentadienile
H
H
H
H
H
Cationi aromatici
H
H
Br
H
H
Br2, ∆
Br-
cicloeptatriene
bromuro di cicloeptatrienile
Strutture di risonanza del catione cicloeptatrienile
ecc.
ossia
Anche il catione ciclopropenile è aromatico
+
Energie di coniugazione derivate dai calori di combustione (kcal/mole)
(valori approssimati)
Composto
Benzene
Difenile
Naftalene
Azulene
Antracene
Fenantrene
Struttura
-
Energia di
825
789
36
1585
1514
71
1311
1250
61
1312
1279
33
1796
1712
84
1798
1705
93
− ∆Hcalc ∆H
oss. coniugazione
Nomenclatura: derivati del benzene monosostituiti
Me
toluene
NO2
nitrobenzene
CHO
benzencarbaldeide
(benzaldeide)
CH=CH2
etenilbenzene
(stirene)
C(Me) 3
(1,1-dimetiletil)benzene
(tert-butilbenzene)
OH
OMe
benzenolo
(fenolo)
metossibenzene
(anisolo)
COMe
1-feniletanone
(acetofenone )
F
fluorobenzene
NH2
benzenammina
(anilina)
COOH
acido benzencarbossilico
(acido benzoico)
fenile
Nomenclatura: isomeri orto, meta, para
X
X
X
Y
Y
Y
isomero orto
isomero meta
isomero para
Me
Me
Me
Me
Me
Me
o-xilene
CH2
gruppo benzilico
p-xilene
m-xilene
gruppi tolilici:
Me
orto
meta Me
Me para
Nomenclatura: derivati del benzene di- e trisostituiti
Me
Br
CH=CH2
OH
Br
I
Br
Br
Cl
Br
1-bromo-3-clorobenzene
1-iodo-2-metilbenzene
(e non 1-bromo-5-clorobenzene)
(o-iodotoluene)
Me
2,4,6-tribromofenolo
1-bromo-3-etenilbenzene
(m-bromostirene)
Me
NO2
Me
NO2
Br
Me
Me
NO2
1-bromo-2,3-dimetilbenzene
1,2,4,-trinitrobenzene
1,3,5-trimetilbenzene
(mesitilene)
Addizione elettrofila e sostituzione elettrofila.
Confronto tra etilene e benzene.
H2C=CH2
+
Br2
BrCH2CH2 Br
∆Η° = -29.2 kcal mol-1
H
+
Br
Br2
∆Η° ~ 2 kcal mol-1
H
Br
Br
+
Br2
FeBr3
+
HBr
∆Η° = -10.8 kcal mol-1
Le reazioni elettrofile sul benzene
E
E
meccanismo SEAr:
somma-eliminazione
- H+
H
H
+
+
E+
Y
C
E
H
B
A
H
Y
D
D
E
B
A
C
coordinata
di reazione
meccanismo E2:
non permesso
Meccanismo della sostituzione elettrofila
Intermedio di Wheeland
Attacco elettrofilo
+
E+
H
E
E
H
H
Perdita del protone
+
E
H+
E
H
Il catione benzenonio
E
H
sp3
E
H
La reazione di sostituzione elettrofila
E
δ+
E
δ+
H
E
δ+
Hδ
E
+
H
Ea
catione intermedio
non aromatico
lento
+ E+
veloce
∆Η°
aromatico
E
+ H+
aromatico
coordinata di reazione
Le più importanti reazioni di Sostituzione Elettrofila
solfonazione
SO3H + H2O
bromurazione
H2SO4 conc.
Br2, FeBr3
acido benzensolfonico
bromobenzene
alchilazione
CH2CH3
clorurazione
Cl2, FeCl3
CH3CH2Cl
AlCl3
etilbenzene
CCH3
acetofenone
Cl + HCl
clorobenzene
acilazione
O
Br + HBr
nitrazione
D2SO4
HNO3
CH3COCl
H2SO4
AlCl3
deuterazione
D
monodeuterobenzene
NO 2
nitrobenzene
Tre casi tipici di Sostituzione Elettrofila
OH
Substrato fortemente attivato:
Condizioni di reazione blande
OH
OH
NO2
HNO3
+
H2 O
25°C
NO2
o-nitrofenolo
p-nitrofenolo
Substrato debolmente attivato:
Condizioni di reazione normali
CH 3
CH3
CH3
NO2
HNO3
+
H2SO4
50°C
o-nitrotoluene
Substrato fortemente disattivato:
Condizioni di reazione forti
nitrobenzene
p-nitrotoluene
NO2
NO2
HNO3
H2SO4
95°C
NO2
NO2
m-dinitrobenzene
Velocità relative e orientamenti in alcune reazioni dei composti
benzenici monosostituiti C6H5-R
Percentuale dell'isomero
R
velocità relativa
orto
meta
para
OH
1000
40
<2
58
CH3
25
58
4
38
H
1
CH2Cl
0.71
32
15.5
52.5
I
0.18
41
<0.2
59
Cl
0.033
31
<0.2
69
CO2Et
0.0037
24
72
4
CF3
2.6 x 10-5
6
91
3
NO2
6 x 10-8
5
93
2
N(CH3)3
1.2 x 10-8
0
89
11
Effetti dei sostituenti
Orientanti in o, p
Attivanti
Orientanti in m
Attivanti
-NH2 , -NHCOR, -OH,
-OR, alchile, fenile
non esistono
Orientanti in o, p
Disattivanti
Orientanti in m
Disattivanti
F, Cl, Br, I
+
-NO2, -CF3, -NR3
-COOH, -COOR, -COR
-SO3H, -CN
I gruppi attivanti stabilizzano lo stato di transizione e l'intermedio,
quelli disattivanti li destabilizzano.
S gruppo attivante: la reazione è più veloce rispetto al benzene.
S
S
S
+ E+
δ
+
+
+
δ
S rilascia
elettroni all'anello
E
H
Stato di transizione
stabilizzato
E
H
Addotto σ
stabilizzato
S gruppo disattivante: la reazione è più lenta rispetto al benzene.
S
S
+ E+
+
+
δ
δ
S attira
elettroni dall'anello
S
+
E
H
Stato di transizione
destabilizzato
E
H
Addotto σ
destabilizzato
Formule di risonanza nei derivati benzenici sostituiti con gruppi attivanti.
H
H
N
H
H
H
H
H
N
N
H
H
N
H
H
H
H
H
O
O
O
O
H
H
H
Iperconiugazione
CH3
CH 2 H +
CH2 H+
CH 2 H +
H
H
H
Risonanza nei derivati benzenici sostituiti con gruppi disattivanti.
O
O
O
C
C
C
OH
O
O
C
C
OH
N
O
H
O
C
OH
OH
OH
H
H
O
OH
O
2+
N
O
O
N
O
O
N
H
O
O
H
H
N
O
Alogenobenzeni
X = Cl, F, Br, I
X
Effetto induttivo
(prevalente)
X
X
X
H
H
Effetto mesomero
H
Sostituzioni o, m, p del toluene
CH3
CH3
CH3
CH 3
E
E
E
E+
H
H
Catione
più stabile
H
Struttura di risonanza
più stabile
CH3
E+
CH3
CH3
CH3
CH 3
E
E
H
H
CH3
E
Catione
meno stabile
H
CH 3
CH3
Catione
più stabile
E+
H
E
H
E
Struttura di risonanza
più stabile
H
E
Sostituzioni o, m, p dell' anilina
NH 2
NH 2
+
E
NH 2
E
NH 2
E
E
H
H
NH2
E
H
H
Catione
stabilizzato
Struttura di risonanza
più importante
NH2
NH 2
NH2
NH 2
E
E
H
H
E
E+
H
NH 2
NH2
NH 2
NH 2
NH2
Catione
stabilizzato
E+
H
E
H
E
H
E
Struttura di risonanza
più importante
H
E
Profilo energetico della reazione alle posizioni orto, meta
e para del toluene e dell'anilina in confronto con il benzene.
E
I stato di transizione
Catione intermedio
II stato di transizione
benzene
meta
orto, para
Coordinata di reazione
Sostituzioni o, m, p del trifluorometilbenzene
CF3
CF3
E+
CF3
E
H
CF3
E
E
H
H
Catione
destabilizzato
Struttura di risonanza
a maggiore energia
CF3
CF3
E
H
E+
CF3
CF3
CF3
CF3
E
E
H
H
Catione meno
destabilizzato
CF3
CF3
Catione
destabilizzato
E+
H
E
H
E
Struttura di risonanza
a maggiore energia
H
E
Sostituzioni o, m, p del nitrobenzene
O
O
N
E+
NO 2
NO 2
E
H
NO2
E
H
E
H
Catione molto
destabilizzato
Struttura di risonanza
a energia maggiore
O
O
N
NO2
E+
O
NO2
NO2
E
E
E
H
H
H
Catione
destabilizzato
O
N
NO 2
NO 2
NO 2
Catione molto
destabilizzato
E+
H
E
H
E
Struttura di risonanza
a maggiore energia
H
E
Profilo energetico della reazione alle posizioni orto, meta e para
del trifluorometilbenzene e del nitrobenzene.
E
I stato di transizione
Catione intermedio
II stato di transizione
orto, para
meta
benzene
Coordinata di reazione
Sostituzioni o, m, p di un alogenobenzene.
X
E+
X
X
X
E
E
E
H
H
X
E
H
H
Catione
stabilizzato
Struttura di risonanza
più importante
X
E
E
E
H
H
E+
X
X
X
X
H
X
X
X
X
Catione
stabilizzato
E+
H
E
H
E
H
E
Struttura di risonanza
più importante
H
E
Rapporti di sostituzione orto/para
Alchilbenzeni : effetto sterico
o/p =
CH3
CH2 CH 3
1.6
0.9
H3 C
CH3
CH
0.5
CH 3
H3C
C
0.2
CH 3
Rapporti di sostituzione orto/para
Alogenobenzeni : effetto elettronico
o/p =
F
Cl
Br
I
0.1
0.4
0.6
0.7
La sostituzione elettrofila dei composti benzenici disostituiti:
alcuni esempi.
CH 3
CH3
CH3
OCH3
COOH
CH3
CH3
CH3
CH3
CF3
NHCOCH3
NO2
NHCOCH 3
CH3
Cl
Cl
COOH
COOH
Bromurazione
Br
Br2, FeBr3
Bromobenzene
L'acido di Lewis attiva il bromo
Br Br
Br Br
FeBr3
Il bromo attivato si lega al benzene
+
Br Br FeBr3
FeBr3
_
Br Br
Br + FeBr4
FeBr3
H
Si forma il bromobenzene
Br +
H
Br
H
FeBr3
+
Br
FeBr3
+ HBr
La bromurazione è una reazione esotermica
Forza (∆H°)di legame
A-B (kcal mol -1)
A
F
Cl
Br
I
F
Cl
Br
I
C 6 H5
F
Cl
Br
I
∆HPh-H
=
∆HBr-Br
=
rottura dei legami =
111 kcal mol-1
46 kcal mol-1
157 kcal mol-1
B
F
Cl
Br
I
C 6 H5
C 6 H5
C 6 H5
C 6 H5
H
H
H
H
H
∆H°
37
58
46
36
126
96
81
65
111
136
103
88
71
∆HH-Br
=
∆H Ph-Br
=
formazione dei legami =
∆H della reazione = 157-169 kcal mol-1 = -12 kcal mol-1
89 kcal mol-1
81 kcal mol-1
169 kcal mol-1
Fluorurazione, clorurazione, iodurazione
F
F2
La reazione è molto esotermica
e non è controllabile.
Cl
Cl2
∆H° = - 30 kcal mol-1
La reazione è esotermica (come
la bromurazione) e controllabile.
I
I2
∆H° = - 114 kcal mol-1
∆H° = + 11 kcal mol -1
La reazione è endotermica e non
avviene spontaneamente.
Alogenazione con acidi ipoalogenosi:
HOCl
+
HOBr
HOI
+
+
H2 O Cl
H2 O
+
Cl+
+
+
H2O Br
H2 O
+
Br+
+
H2O I
H2 O
+
I+
H
+
H
2
X = Cl, Br, I
+
H
+
HO-X
H+
+ I2
+ H 2O 2
+
+
2 H2 O I
+
H2O I
I
+
H3 O+
L' anilina e il fenolo sono tanto reattivi da
polialogenarsi con facilità.
NH2
NH2
Cl2
Cl
Cl
HCl acq.
Cl
OH
OH
Br2
Br
Br
H2 O
Br
La monoalogenazione si può ottenere
utilizzando condizioni blande.
OH
OH
Br
Br2
+
CHCl3, 0 °C
CH3
CH3
80%
HBr
Monoalogenazione dell'anilina
NH2
NHCOMe
NHCOMe
Cl
Cl 2
(MeCO)2O
+
Cl
NH2
NH2
Cl
+
+
H3 O
Cl
NHCOMe
Monoalogenazione del fenolo
OH
OCOMe
OCOMe
Br
(MeCO)2O
Br2
+
Br
OH
OH
Br
+
H3 O+
Br
OCOMe
La risonanza incrociata riduce l'effetto
elettrondonatore del sostituente.
O
O
..
HN CMe
HN CMe
O
O
O
HN CMe
HN CMe
HN CMe
Alogenazione radicalica
CH2 Cl
CH3
CHCl2
CCl3
Cl 2
Cl 2
Cl 2
hv
hv
hv
cloruro di benzile
cloruro di benzale
benzotricloruro
Meccanismo dell' alogenazione radicalica
Cl2
hν
CH3
2 Cl
CH2
+
Cl
CH2
+
HCl
+
Cl
CH 2Cl
+ Cl2
Radicale benzile
CH 2
CH2
CH2
CH 2
La bromurazione radicalica è più selettiva
della clorurazione radicalica.
CH2 CH 3
CHBrCH3
Br2
+
hv
95%
CH2 CH 3
CH2 CH 2Br
5%
CHClCH 3
Cl2
CH2CH2 Cl
+
hv
55%
45%
Nitrazione
L'acido solforico protona l'acido nitrico
O
O
+
N OH
+
H OSO 3H
HO
O
+
N
H
HSO4
O
e forma la specie elettrofila: lo ione nitronio
O
HO
H
H 2O
N
+
O
N
O
O
che reagisce con il benzene e forma il nitrobenzene
+
H
O
N
O
NO2
HSO4
+
NO2
H
nitobenzene
H 2SO4
Esempi di nitrazione
Me
Me
Me
Me
+
Me
Me
HNO3
+
- H2O
NO 2
NO 2
NO2
NO 2
+
HNO3
(fumante)
HCl
+
95 °C
NO 2
H 2O
80%
NHCOMe
+
NHCOMe
NHCOMe
HNO3
NO2
MeCO2H
+
H2SO4, 25 °C
20%
NO2
80%
La nitrazione diretta dell' anilina porta ad
una miscela dei tre isomeri
NH 2
NH3
H2 SO4
HNO3
specie predominante disattivata:
si nitra in meta lentamente
specie minoritaria attivata:
si nitra in orto/para velocemente
NH 3
NH3
NH 3
NO2
+
+
NO2
NO2
Solfonazione
SO3H
Reagente:
H2SO4:
+
H 2SO4
170-180 °C
+
95%
SO 3H
SO3:
+
SO 3
90%
H 2O
O
La specie elettrofila è SO3
O
S
O
O
O
S
O
O
O
+
S
+
O
O
O
S
+
Dall’acido solforico si genera l’anidride solforica
2 H2 SO4
SO 3
+
H 3O+
+ HSO4
-
che reagisce con il benzene a dare l’acido benzensolfonico
OH
O
H
H
O
S
S
O
O
+
O
O
O
S
O
O
Nitrazione: è una reazione irreversibile
Il I stato di transizione ha
E
energia molto inferiore a
quella del II
NO2
H
C6 H6 + HNO 3
C6H 5NO2
coordinata di reazione
Solfonazione: è una reazione reversibile
I due stati di transizione
hanno energia quasi uguale
E
SO3 H
C6H6 + SO 3
C6 H5SO3 H
coordinata di reazione
Desolfonazione
SO3 H
H2O/H2SO4 catalitico
100 °C
SO3 + H 2O
H2 SO4
H
+ SO3
(reazione esotermica)
Alchilazione di Friedel-Craft
H
CH3CH2Cl
+
+
28%
Etilbenzene
attivazione dell' alogenoalcano
RCH 2 X
CH2CH3
AlCl3, 25 °C
+δ
-δ
RCH 2--X--AlX3
AlX3
attacco elettrofilo
+δ R
H2C
-δ
X AlX3
CH 2R
+
-
AlX4
H
formazione dell'alchilbenzene
H
CH2R
X
AlX3
+
CH2 R
HX
+
AlX3
HCl
Charles Friedel e James Mason Crafts
•
•
COMPTES
RENDUS
DES SÉANCES
DE L'ACADÉMIE DES
SCIENCES.
SÉANCE DU LUNDI 11 JUIN
1877.
PRÉSIDENCE DE M. PELIGOT.
CHIMIE ORGANIQUE. - Sur une nouvelle méthode
générale de synthèse d'hydrocarbures, d'acétones, etc.;
par MM. C. Friedel et J.-M. Crafts.
Nous avons été conduits, dans un travail
que nous avons entrepris ensemble, à
étudier l'action de l'aluminium métallique
sur divers chlorures organiques.
....la réaction principale au lieu d'être due
au métal, comme nous l'avions supposé
tout d'abord, devrait en réalité être
attribuée au chlorure métallique.
Nous avons pensé qu'en mélangeant un
hydrocarbure avec le chlorure
organique mis en contact avec le
chlorure d'aluminium nous réussirions
à obtenir une réaction ayant pour
résultat de combiner le radical
hydrocarboné du chlorure à
l'hydrocarbure moins de l'hydrogène.
C'est en effet ce qui s'opère avec une grande
facilité. Ayant mélangé d'abord du chlorure
d'amyle avec un excès notable de benzine, et
ayant ajouté du chlorure d'aluminium par
petites portions, nous avons vu se produire à
froid une réaction régulière accompagnée
d'un dégagement d'acide chlorhydrique ; il
se forme bientôt deux couches.. Il a été facile
d'extraire un liquide bouillant entre 185 et
190 degrés et ayant la composition et les
propriétés de l'amylbenzyne. Cette dernière
s'est formée par une réaction qui peut être
exprimée empiriquement par l'équation
C6H6 + C5H11Cl = HCl 1+ C6H5C5H1.
L'alchilazione può provocare l'isomerizzazione della catena.
H 3C
CH
CH 2CH 2CH3
CH3 CH2CH2 Cl
CH 3
+
AlCl3 , 5 h
propilbenzene
isopropilbenzene
a - 6 °C
60%
40%
a 35 °C
40%
60%
spostamento 1,2 di
un idruro
Cl
CH 3CH2CH2
Cl
Al Cl
Cl
Cl
δ+
CH3CH3CH2
Cl
δ−
CH 3
Al Cl
Cl
-
CH AlCl4
CH3
coppia ionica
carbocatione secondario
Alchilazione con alcoli e alcheni
H3C
OH
+ CH3CH2CHCH3
CH2CH3
CH
BF3, 60 °C
35%
H
HF, 0°C
+
60%
+
CH2
CH2
CH2CH3
AlCl3, HCl
20 °C
60%
Clorometilazione
CH 2Cl
+
CH 2O
+
ZnCl2, 60 °C
HCl
+
H2O
79%
attivazione della formaldeide
ZnCl2
+
CH2
CH2O
O
ZnCl2
H 2C
O
ZnCl2
attacco elettrofilo e formazione dell’alogenuro benzilico
CH3
CH3
CH2
CH3
O
CH 3
CH2 O ZnCl
+ HCl
ZnCl2
CH3
CH2 Cl
CH 3
Acilazione di Friedel-Crafts
H3 C
O
+
CH3
O
1. AlCl3 (1.1 eq.)
2. H2 O, H+
+
HCl
Cl
61%
1-feniletanone
(acetofenone)
H3 C
O
CH3
+
O
O
1. AlCl3 (2.4 eq.)
2. H2O, H+
+ HCl + CH3CO2H
CH3
O
85%
1-feniletanone
(acetofenone)
Acilazione di Friedel-Crafts: meccanismo
• attivazione di alogenuri acilici
O
AlCl 3
O
RC X + AlCl3
O
−δ
+δ
RC X AlCl3
RC X
• attivazione di anidridi
Ione acilio:
RC
O
RC
O
AlCl 3
O
O
O
RC O CR + AlCl3
O
RC O CR
O
O
+δ
RC O CR
−δ AlCl
3
• attacco elettrofilo e formazione del derivato chetonico
O
H
+
RC
CR
O
H
Cl 3Al
O
- H+
CR
AlCl3
O
CR H2 O
- Al(OH)3
- HCl
O
CR
Acilazione e riduzione evitano l'isomerizzazione della catena
O
O
+
CH3 CH 2CCl
CH2 CH 2CH3
CCH2 CH 3
H2NNH2, KOH
AlCl3
glicol dietilenico, ∆
cloruro
di propanoile
1-fenil-1-propanone
65%
propilbenzene
82%
Le reazioni di Friedel-Crafts intramolecolari
Cl
AlCl3, CS2 e CH3NO2
25¡C, 72h; - HCl
H
O
O
+
O
C
AlCl3
∆
O
HO
anidride
succinica
acido 4-fenilbutanoico, 90%
C
O
AlCl3
C
CS2, ∆
C
O
toluene
∆
acido 4-fenil4-ossobutanoico
SOCl2
HO
Zn(Hg), HCl
Cl
O
cloruro di
4-fenilbutanoile
O
1-osso-1,2,3,4tetraidronaftalene
(α−tetralone, 80%)
La formilazione
Sintesi di Gattermann-Koch (1897)
CH 3
CH3
+
CO
+
HCl
Cu2Cl2, AlCl3
20 °C
CHO
p-tolualdeide
50-55%
• attivazione del monossido di carbonio
HCl
+
CO
+
HC
AlCl 3
O
HC
O
• attacco elettrofilo e formazione della benzaldeide
CHO
+
HC
O
+
H+
DDT
Il DDT (Dicloro-Difenil-Tricloroetano) si ottiene per reazione del clorobenzene con la
tricloroacetaldeide. La condensazione è catalizzata dall'acido solforico. Considera i processi di
alchilazione dei composti aromatici e scrivi un meccanismo plausibile per questa reazione!
La prima sintesi è del 1873, ma soltanto nel 1939 ne sono state scoperte le proprietà insetticide.
E' stato l'insetticida clorurato più usato, soprattutto negli anni '40 e '50. Fu impiegato in quantità
massicce durante la seconda guerra mondiale e intere città italiane vennero cosparse di DDT per
controllare malaria e tifo. Ancor oggi è un agente efficace contro le zanzare. Di per se stesso il
DDT non è molto tossico per l'uomo, ma la sua emivita varia nell'acqua da un mese a quindici
anni e nel suolo è praticamente indistruttibile. Per questo si accumula nella catena alimentare,
anche perché è stabile nei tessuti adiposi. L'accusa di essere responsabile, come altri pesticidi, di
inquinare gravemente l'ambiente ha portato molti Stati a bandire il DDT (Svezia e Norvegia nel
1970, Regno Unito nel 1984). Anche negli USA è proibito dal 1972, ma viene fabbricato ed
esportato nei Paesi tropicali del Terzo Mondo dove viene tuttora usato. In questi Paesi il pericolo
della malaria è considerato più grave dei rischi del DDT.
Sostituzione nucleofila aromatica
Il meccanismo SN1 non è possibile
Cl
+
-
Cl
catione fenile non stabilizzato ( la lacuna
elettronica si trova nell’orbitali sp2)
Il meccanismo SN2 è di regola difficile
Cl
OH
NaOH, H2O
+
350 °C
Br
C6 H5CH2NH2
160-200 °C
C6 H5S-Na+
160-200 °C
NaCl
CN + CuBr
S
+
NaBr
Meccanismo della SNAr
X
X
Nu
Nu
X
Nu
X
-
-X
E
X
C6H5 X + Nu
-
Nu
Nu
Nu
-
Il primo stadio di transizione ha energia
più elevata del secondo. L'addizione del
nucleofilo è lo stadio lento.
C6H5 Nu + X
Coordinata di reazione
I gruppi elettron-attrattori facilitano la SNAr
Cl
OH
NO2
NO2
Na2CO3, H2O
+
100 °C
NO2
NaCl
NO2
90%
Cl
NH 2
NO2
NO2
NO 2
NH3 , ∆
+
NO 2
85%
NH4 Cl
I gruppi elettron-attrattori in orto e/o para stabilizzano
l'anione intermedio
Cl
O
N+
Nu-
+
O
Nu
Cl
Nu
NO 2
NO2
O
Cl
Nu
O
N+
O
NO 2
Cl
N+
N+
O
O
Cl O
Nu
NO2
N+
NO2
O
Nu
Cl O
N+
NO2
O
O
I gruppi elettron-attrattori in meta non stabilizzano
l'anione intermedio e la reazione è più difficile
Cl
NuO2 N
Nu
O 2N
Cl
NO2
Nu
NO 2
O2 N
Nu
Cl
NO 2
O2N
Cl
NO2
Gli alogenuri benzilici sono molto reattivi
CH2 Br
CH2 OCH3
-
+
CH 3O
+
-
Br
Meccanismo SN1
CH2+
CH 2X
CH 2Nu
CH2
Nu
-
Meccanismo SN2
Xδ−
CH2X
Nu
-
H
H
Nuδ−
CH2 Nu
Gli alogenuri di benzale sono precursori delle aldeidi
CH3
CHO
CHBr2
H2 O, CaCO3
2 Br2, hv
110-150 °C
∆
Br
Br
Br
65%
Meccanismo:
CHBr2
OH
CHBr
CHBr
-
- Br
Br
Br
-
- Br
H 2O
-H
CHO
+
+
Br
Br
HBr
orbitali sp2: debole
sovrapposizione
Sostituzione nucleofila via arino
Cl
NH2
1. KNH2 /NH3 liquida
+
+
2. H , H2O
KCl
Meccanismo
X
X
-X
-
NH 2
H
NH2
- NH3
benzino
anione
fenile
NH2
H-NH2
- NH2
-
NH2
H
Sostituzione nucleofila tramite arino su alogenuri
non simmetrici
OCH3
OCH3
CH 3
OCH 3
CH 3
NH3
CH 3
NH2
OCH 3
Br
NH3
CH3
NaNH2
OCH3
OCH3
CH3
CH3
NH3
NH2
Ossidazione delle catene laterali dei composti benzenici
CH3
+
3/2 O2
Co(OAc)3
Mn(OAc)2
+ H2 O
150-250 °C
27 atm
CH3
COOH
+ 3 O2
H3C
COOH
Co3+
130-145 °C
HOOC
+
2 H2 O
CH3
CH
CH3
COOH
+
KMnO4
L'ossidante attacca la posizione benzilica
Ar
oss.
CH 3R
Ar CHR
OH
CH 3
oss.
Ar C
O
COOH
Oss.
R
oss.
Ar COOH
CH2CH2 CH3
Oss.
Il nucleo fenilico è resistente all' ossidazione
O
CH2
Oss.
difenilmetano
CH
trifenilmetano
C
benzofenone
Oss.
OH
C
trifenilcarbinolo
Ossidazione del gruppo CH3 a CHO
CH 3
CH(OCOCH 3)2
Br
CrO3, Ac2O, AcOH
H2SO4, 5-10 °C
Br
CHO
HCl/H2 O
Br
Idrogenazione dei composti aromatici
+
3 H2
Pt (allumina)
35 atm
200-225 °C
(fase liquida)
OH
OH
+
3 H2
Ni (Raney)
H2, 100 °C, 100 atm
Reattività dei gruppi funzionali
nell' idrogenazione catalitica
RCOCl
RCHO
RNO2
RNH2
RCHO
RCH2OH
RCH=CHR
RCH2CH2R
RCN
RCH2NH2
C6H6
C6H12
Difficoltà
crescente
Reattività dei gruppi funzionali nella riduzione con LiAlH4
RCHO
RCH2OH
RCOCl
RCH2OH
RCOOR'
RCH2OH + R'OH
RCONR'2
RCH2NR’2
RCN
RCH2NH2
RNO2
RNH2
RCH=CHR
non si riduce
C6H6
non si riduce
Difficoltà
crescente
Riduzione dei nitrocomposti aromatici
NO2
N
H
O
N
OH
NH2
2[H]
2[H]
2[H]
-H2O
-H2O
-H2O
nitrobenzene
N-fenilidrossilammina
nitrosobenzene
anilina
NH2
NO2
+
3 H2
350 °C
+
Ni, 25 °C
30 atm
NO2
NH2
Sn, HCl
50-100 °C
NO2
NH2
Fe, HCl
100 °C
2 H2 O
Riduzione di nitrocomposti aromatici con sulfuri
NO2
NO2
NH4 SH
HNO3/H2SO4
∆
NO2
C2H5OH/H2O
NH2
Riduzione parziale di nitrocomposti
NO2
NO2
NO2
NO2
Zn, NH4Cl
NHOH
H2 O
Zn, NaOH
H2O
SnCl2, NaOH
NH NH
N=N
H2 O
glucosio, NaOH
100 °C
O
-
N N
Nitrosobenzene e sue reazioni di condensazione
OH
HN
N
O
K2Cr2O7
H2SO4, 0 °C
NH2
N
O
piridina
+
- H 2O
Br
N N
Cl
O
N N
+
Br
N
OH
O
HN
+
Cl
-
NaOH
- H2 O
Ammine aromatiche: basicità
Lo ione anilinio ha approssimativamente la stessa acidità dell'acido acetico ( pKa 4.8 )
Base
Acido coniugato
NH3
NH2
+
H2O
pKa 15.7
+
OH
-
ione anilinio
pKa 4,6
Lo ione metilammonio è un acido molto più debole dello ione anilinio
CH3 NH2
+
H2O
CH 3 NH3
ione metilammonio
pKa 10,5
+
-
OH
La salificazione rende più solubili in acqua le ammine aromatiche
NH2
NH3
+
H3O+
+
H2O
solubile
NH2
NH2
O
CH3 C NH 2
cicloesilammina
Kb = 5x10-4
anilina
Kb = 4.1x10-10
acetammide
Kb = 10-16(approx.)
La basicità delle ammine aromatiche è modulata dai sostituenti
NH2
NHCH 3
pKb 9.4
pKb 9.2
NH2
NH2
NH2
CH3
OCH3
pKb 8.9
pKb 8.8
NH2
NH2
NO2
Cl
pKb 10.2
NO2
pKb 11.4
pKb 13.0
Preparazione delle ammine aromatiche
NO2
NH2
SnCl2, HCl
CHO
CHO
m-nitrobenzaldeide
m-amminobenzaldeide
NO2
NH2
H2, Ni
CH3OH, 70 atm
70 °C
CH(OCH3 )2
CH(OCH3 )2
m-nitrobenzaldeide
dimetilacetale
NO2
m-amminobenzaldeide
dimetilacetale
C2H5OH, 80 °C
CH 3
NO2
2,4-dinitrotoluene
NH2
Fe, HCl
CH3
NH2
2,4-diamminotoluene
Preparazione delle ammine aromatiche per
sostituzione nucleofila
Cl
NH 2
NO 2
+
2 NH 3
NO 2
MeCO2NH4
NO 2
NO 2
2,4-dinitroanilina
70%
2,4-dinitroclorobenzene
F
F
NaNH2, NH3
Cl
o-fluoroclorobenzene
- 33 °C
NH 2
m-fluoroanilina
83%
Preparazione di ammine aromatiche da chetoni e acidi
Me
Beckmann
C N OH
NHCOMe
NH2
H 2O
PCl5
etere, 25 °C
OMe
Hofmann
OMe
CONH2
OMe
80%
NH2
Br2, KOH
70-75 C°
Br
Br
90%
Schmidt
CO2 H
Me
+
NH2
NH3
H2 SO4
Me
70%
Curtius
CON 3
NH2
1. HCl
I
2. NaOH
I
85%
Nitrosazione delle ammine secondarie e terziarie
N2O3
2 NaNO2
+ 2 HCl
+
H2 O
lenta
2 HONO
NO+ +
specie elettrofila
H2O
Ammina secondaria
N
Me
+
Me
HONO
N+
NO
H
H
Me
N
NO
Ammina terziaria
Me
N
Me HONO
Me
+
N NO
Me
Me
N+
H
ON
Me
Me
-H
N
+
Me
ON
Diazotazione delle ammine aromatiche primarie
NH2
N
N:
NaNO2
H+, H2O, 0 °C
R
R
ione arendiazonio
Meccanismo della diazotazione
ArNH 2
+
H
+
Ar N N
+
NO
O
H
Ar N
N
OH
+ H+
Ar N
- H+
Ar N
N
O
tautom.
H
N
+
OH2
+
Ar N N: +
H2O
Il catione benzendiazonio
N
N
X
N
N
X
N
N
X
N
N
X
Sintesi di composti aromatici tramite sali di arendiazonio
Ar H
idrocarburo aromatico
HNO2/H2SO4
nitrocomposto aromatico
Ar NO 2
Fe/HCl
ammina aromatica primaria
Ar NH 2
NaNO2 /HCl
Ar N2 X
HBF4 , ∆
Ar
F
Fluoruro
arilico
CuCl
Ar
Cl
Cloruro
arilico
CuBr
Ar
Br
Bromuro
arilico
sale di arendiazonio
KI
Ar
I
Ioduro
arilico
CuCN
Ar
CN
Cianuro
arilico
H 2O, ∆
H 3PO4
Ar OH
Ar H
Fenolo
Arene
NaNO2
Ar
NO 2
Nitrobenzene
Fenoli dai sali di diazonio
OH
N2 HSO4
NH2
H2SO4
H2SO4/NaNO2
H2O
Br
Br
H2O
100 °C
Br
80%
N
OH
N
H2O
∆
- N2
R
- H+
R
R
catione arile
orbitali p
catione arile:
orbitali sp2
La reazione di Schiemann: fluoruri arilici
COOH
COOH
N2 +Cl
+
COOH
N2 +BF 4
HBF 4
F
120 °C
+
N2
+
BF3
+
N2
+
BF3
80%
CH3
CH3
CH 3
1. NaNO2 /H+ , 0 C
NH2
2. HBF 4
calore
N2 + BF4
F
70%
Ioduri arilici da sali di diazonio
NH2
N2
NaNO2, HCl acq.
I
KI
7 °C
25 °C
+
N2
+
N2
75%
NO2
NO2
NO2
H2SO4/NaNO3
KI
H2O/0-5 °C
NH2
N2
I
80%
Le reazioni di Sandmeyer
-
N2 + X
X
CuX, ∆
+
• X = Cl, Br, I, CN, NO2
• Il meccanismo della reazione è radicalico
N2
Traugott Sandmeyer
(1854, Wettingen, Svizzera - 1922, Zollikon, Zurigo)
E' curioso che uno dei chimici più noti e importanti, scopritore di una reazione che tutti conoscono e usano,
non fece regolari studi chimici e non ebbe mai la laurea.
Studiò da meccanico e costruì per il dipartimento chimico del Politecnico di Zurigo apparecchi di vario tipo.
I suoi primi esperimenti furono effettuati nella sua cucina. Cominciò a collaborare con il professor V. Meyer
e scoprì insieme a lui il tiofene nel 1882. Ne pubblicò con V. Meyer la sintesi dall'acetilene e zolfo nel 1884.
Il nome di Sandmeyer entra nella storia della chimica nel 1884 con la pubblicazione della reazione con la
quale un gruppo amminico aromatico può essere sostituito da alogeno o da cianuro.
Continuò a lavorare per la ricerca (collaborando tra gli altri con A. Hantzsch) e con l'industria (Geigy e
BASF) mettendo a punto una valida sintesi dell'indaco e dell'isatina, di coloranti del trifenilmetano e azoici.
66 brevetti portano il suo nome.
Lo schema pubblicato da Sandmeyer su Ber. Dtsch. Chem. Ges. nel 1884.
Reazione di nitrazione
N2+ BF4
NH2
1. HCl, NaNO2, 0 °C
2. HBF4
-
NO2
NaNO2 , Cu
+
75%
N2
Reazione di clorurazione, bromurazione, iodurazione
CH3
CH 3
NH 2
HCl, NaNO2, 0°C
N 2+ X
CH 3
-
Cl
CuCl, 60 °C
+
80%
Cl
1. HBr, NaNO2, 0 °C
2. CuBr, 100 °C
Cl
+
NH 2
Br
75%
CH3
CH3
1. HBr, NaNO2, 0 °C
2. CuCN, KCN, 50 °C
NH2
+
CN
80%
N2
N2
N2
Eliminazione riducente del gruppo diazo
N2 +
H
H3PO2
+
CH3
CH3
CH 3
H2SO4, NaNO2
Br
NH 2
N2
C2H5OH
H2O, 0-5 °C
Br
N 2+
∆
+
Br
N2
Due sintesi del 1, 3, 5-tribromobenzene
NO2
NH2
H2, Pd
O2N
NO2
+
NH2
N2
NH2
1. NaNO2, H+, H2O
HNO3
oleum, ∆
2. CuBr, 100 °C
Br
NH2
Br
Br
C2H5OH
- N2
Br2 , H2O
N2 + HSO4
NH2
Br
Br
Br
Br
H2SO4/NaNO2
+
0-5 °C
Br
-
Br
N2
Arilidrazine dai sali di diazonio
N
NH 2
N Cl
NH2
-
HN
1. Na2SO3, H2O
NaNO2/HCl
CF3
H2O, 0 °C
CF 3
2. H+, H2O, 100 °C
3. NaOH
CF3
La copulazione azoica delle ammine aromatiche primarie
N
+
N
N
N NH
-H
NH2
+
N
N NH 2
prodotto cinetico
(a pH >4)
N
N
NH2
prodotto termodinamico
(a pH <4)
La copulazione azoica delle ammine aromatiche terziarie
N
N Cl
-
+
N(CH3 )2
H + , H2 O
pH = 3-5
H
N(CH3)2 Cl
N N
- HCl
4-dimetilamminoazobenzene
(giallo burro)
N N
N(CH3 )2
-
La copulazione azoica con i fenoli
pH acidi: molto lento
OH
Ar N
N
+
OH
OH
ArN N
ArN
H
N
pH basici: molto veloce
O
Ar N
N
+
O
ArN
O
N
H
ArN
N
Velocità della diazocopulazione di ammine terziarie
e fenoli in funzione del pH
v
fenoli
arilammine
1
3
5
7
9
11
13
pH
OH
NH2
favorito a pH 5-7
favorito a pH 8-10
SO3H
HO3 S
"Acido H"
I coloranti azoici
N N
N N
N N
N N
N N
N N
N N
N N
Arancio
Rosso
Blu
Violetto-Blu
Violetto
Nero-Violetto
Nero
I coloranti azoici: l'indicatore metilarancio
H3C
N 2+
N
CH3
+
SO3 H
+
CH3
-
Na O3 S
N N
N
CH3
giallo λmax = 460 nm
NaOH
+
-
Na O 3S
CH3
N N
H
HCl
+
-
Na O 3S
N
CH3
rosso λmax = 520 nm
CH3
N
H
N
N
CH3
I coloranti azoici per uso alimentare
HO
OH
H3 CO
NaO3 S
N N
NaO3 S
SO3 Na
N N
CH3
Rosso F,D&C n.40
(rosso allura)
(non consentito in Italia)
SO3Na
SO 3Na
Rosso F,D&C n.2 (E-123)
(amaranto)
HO
NaO3 S
OH
N N
NaO3 S
SO3 Na
Giallo F,D&C n.6 (E-110)
(giallo tramonto)
N N
N
NaO2 C
N
Giallo F,D&C n.5 (E-102)
(tartrazina)
SO3 Na
I coloranti anionici tingono le fibre con gruppi basici
H
N
NH3
O
O
N
H
COO
-
CONH
NH CO
H3N
NH CO
n
lana: polipeptide
non colorate
fibra tessile
COO - Na+
COO - Na+
NH3 +
O2 N
O2N
NH2 +
SO 3 -
SO 3-Na+
N N
N
N
H 2N
H2 N
rosa
rosso
COO
-
Fenoli
OH
OH
OH
OH
OH
OH
OH
OH
OH
OH
fenolo
1,2-benzendiolo
(catecolo)
OH
HO
1,3-benzendiolo
(resorcinolo)
1,4-benzendiolo
(idrochinone)
OH
OH
CH3
COOH
OH
1,3,5-benzentriolo
(floroglucinolo)
p-cresolo
acido p-idrossi
benzoico
1,2,3-benzentriolo
(pirogallolo)
L' equilibrio cheto-enolico dei fenoli
OH
OH
OH
Forma enolica
Fenolo
:OH
OH
O
H
2,4-Cicloesadienone
H
Forma chetonica
I fenoli sono meno basici degli alcoli
H
O
H
OH
+
H+
pKa= 7
CH 3O
H
CH 3OH
H
+
H+
pKa= 2
I fenoli sono più acidi degli alcoli
OH
pKa= 10
OH
pKa= 18
L'acidità dei fenoli
OH
pKa = 10
- H+
O
O
O
O
ione fenossido
OH
OH
OH
NO2
CH3
p-cresolo
pKa = 10.5
NO2
2,4-dinitrofenolo
pKa = 4
O2N
NO 2
NO2
2,4,6-trinitrofenolo
(acido picrico)
pKa = 0.25
La formazione di sali aumenta la solubilità in acqua
OH
O - Na+
H2O
+
poco solubile in acqua
90 g/l
+
NaOH
solubile in acqua
H2 O
Preparazione dei fenoli
Dagli alogeni arilici attivati
CN
CN
CN
H3 O+
NaOH
NO2
H2O, ∆
Cl
NO2
NO2
ONa
OH
Per fusione alcalina dei solfonati di sodio
CH 3
CH 3
CH 3
H3O+
NaOH/ KOH
300-330 °C
SO 3Na
ONa
OH
Per decomposizione dei sali di diazonio
NO2
NO 2
NO2
NaNO2/HCl
NH2
H2 O
H2 SO4 /H2 O
N 2+Cl
∆
OH
Eteri fenolici
Sintesi di Williamson
O(CH2)2 CH3
OH
+
CH3 (CH2) 2Br
NaOH, H2 O
Br
Br
Sintesi con diazometano
OH
OCH 3
NO2
NO2
CH2N 2
etere
CH3
CH3
Scissione con HBr
OCH3
OH
HBr 48%
+
∆
Cl
Cl
CH3 Br
Acido 2,4-diclorofenossiacetico
OH
OH
+
Cl
80-100 °C
2 Cl 2
- 2 HCl
OCH 2COOH
Cl
Cl
1. NaOH
2. HCl
Cl
Cl2
+
CH 3CO2H
H
+
ClCH 2CO2H
+
HCl
2,4-D
(defoliante,
agente arancione)
Acido 2,4,5-triclorofenossiacetico
Cl
OCH2 CO2 H
OH
1. NaOH,150 °C
Cl
2. H+, H2O
Cl
ClCH2 CO2H
Cl
Cl
Cl
Cl
NaOH, H2O, ∆
Cl
Cl
Cl
(reazione secondaria)
Cl
O
Cl
Cl
O
Cl
2,3,7,8-tetraclorodibenzo-p-diossina
(Diossina)
2,4,5-T
(defoliante)
Esteri fenolici: reazione di Schotten-Baumann
OH
OCOCH2CH3
O
+
CH3 CH 2CCl
NaOH, H2O
Cl
+
HCl
Cl
COOH
COOH
OH
OCOCH3
(CH3CO)2O
H+ ∆
aspirina
OCOCH3
OH
(CH3CO)2O
(CH3 CO)2 O
CH3CO2H
NaOH
NH2
OH
NH2
NHCOCH3
La trasposizione di Fries
O
O
Me
AlCl3
Me
O
AlCl2
O
O
+
- MeCO
AlCl3
- Cl
O
AlCl2
O
O
Me
-
H+
AlCl2
OH
H2O
+
O
+
MeC=O
Me
O
OH
Me
+
O
Me
La carbossilazione di Kolbe
OH
O
CO2 Na
CO2 Na
H
125 °C
O- Na+
OH
NaOH
+ O
C
O
O
O
C
O
Na
Acidi carbossilici aromatici
COOH
ac. benzoico
pKa = 4.20
COOH
COOH
CH 3
Cl
ac. p-toluico
pKa = 4.35
ac. p-clorobenzoico
pKa = 4.05
COOH
CH2 COOH
COOH
COOH
NO 2
ac. p-nitrobenzoico
pKa = 3.40
ac. ftalico
pKa1 = 4.20
pKa2 = 5.30
ac. fenilacetico
pKa = 4.30
Preparazione degli acidi carbossilici aromatici
3 Cl2
CH 3
CCl3
hν
1. NaHCO3, H2O
COOH
+
2. H3O
Na2Cr2O7
O2 N
CH3
H2SO4, H2O, ∆
O 2N
Cl
Cl
KMnO4
CH 3
N 2+ Cl
NH2
COOH
H2 O ∆
-
CN
HNO3
Cl
COOH
CuCN
Cl
CO2 H
H3 O+ ∆
Cl
Cl
Idrocarburi polinucleari
Naftalene
1
2
3
4
5
Antracene
8
1
9
7
2
6
3
5
4
10
Fenantrene
3
9
2
1
10
La sostituzione elettrofila del naftalene
NO2
Br
Br
+
1-bromonaftalene
99%
1-nitronaftalene
HNO3 /H2 SO4
2-bromonaftalene
1%
Br2, MeCO2H/H2O
MeCOCl/AlCl3, C6H5NO2 25 °C
MeCOCl/AlCl3, CS2/15 °C
COMe
COMe
COMe
+
1-acetonaftalene
75%
2-acetonaftalene
25%
SEAr del naftalene
E
H
E
E
E+
H
E
E
H
H
E
H
E
E
H
H
E
E
E+
H
H
H
Solfonazione del naftalene
SO 3H
prodotto cinetico
H2SO4
T<90 °C
96%
H2SO4
165 °C
SO3 H
H2SO4
T > 145 °C
prodotto termodinamico
85%
interazione sterica
H
SO3H
H
SO3H
H
minore
interazione
sterica
Diagramma di energia per la solfonazione del naftalene
E
a 80 °C la reazione ha questo andamento
reazione a 160 °C
SO 3 H
a 80 °C prevale il prodotto
cinetico
a 160 °C prevale il prodotto
termodinamico
S O3H
+ SO 3
Coordinata di reazione
Alcuni derivati naftalenici importanti
NO2
N 2+
NH2
rid.
HNO2
1. CuCN
2. H3O+
H3O+/∆
COOH
COCH3
OH
NaBrO
NaOH/∆
SO3 H
Alcuni composti naftalenici importanti
Reazione di Bucherer
SO 3H
OH
NH2
(NH4 )2 SO3 H
H 3O +
∆
CN
CuCN
CuNO2
NO 2
N2
CuCl
Cl
La seconda sostituzione elettrofila del naftalene: gruppi attivanti
OH
OH
OH
NO2
HNO3, H2SO4
+
- H 2O
(molto)
NO2
(poco)
NO2
NHCOCH3
HNO3 ,
MeCO2H
NHCOCH3
Quando la reazione avviene sotto controllo termodinamico
CH3
CH3
H2 SO4 , ∆
HO3 S
La seconda sostituzione elettrofila del naftalene: gruppi disattivanti
NO2
NO 2
NO2
HNO3 , H2SO4
NO2
+
NO 2
COOH
COOH
Cl2
Cl
+
Cl
Le quantità dei due isomeri sono dello stesso ordine di grandezza.
COOH
Ossidazione dei derivati naftalenici
O
CO2H
V2O5, SiO2
CO2 H
NO2
HO2 C
HO2 C
NO2
[O]
C
∆
O
− Η2 Ο
C
O
NH2
[H]
[O]
COOH
COOH
Riduzione del naftalene
Ni, 250 °C
H2 50 atm
Ni, 200 °C
H2 10 atm
tetralina
+
isomero cis
oppure
Pt, H2, 1 atm
25 °C MeCO2H
decalina
isomero trans
Gli idrocarburi aromatici sono tossici!!!!
Benzene: Cancerogeno, DL50930 mg/Kg (nel topo)
Toluene: DL50 5000 mg/Kg (nel topo)
Steam cracking
•
Una tecnica che consente di ottenere benzene e altri idrocarburi
aromatici è lo Steam Cracking di tagli petroliferi. In breve si tratta di
vaporizzare mediante preriscaldamento l'alimentazione, mescolarla con
vapor d'acqua e passarla in un forno.
•
Si ottiene una miscela di prodotti che dipende dall'alimentazione, dalla
temperatura (tra 700 e 900°C) e dal tempo di residenza (tra 0.1 e 0.5
secondi). Tra i prodotti vi è il cosiddetto RPG (raw pyrolysis gas) che è
una miscela di benzene, toluene, o-, m- e p-xilene e idrocarburi
alifatici C5-C10. Un taglio molto usato per l'alimentazione è la nafta.
•
Il benzene viene separato con varie tecniche dagli altri idrocarburi.
Steam cracking della nafta
Steam cracking della nafta
50
45
40
35
30
25
Serie1
20
15
10
5
0
etene
RPG
metano
propene
butene
olio comb.
idrogeno
Il benzo[a]pirene è cancerogeno!
idratasi
ossidasi
O
DNA
O
ossidasi
HO
HO
OH
OH
O
7,8-Diidrobenzo[a]pirentrans-7,8-diolo
N
N
DNA
cancerogeno
NH
N
NH
HO
HO
OH
Alcune classi di composti solforati
CH3SH
Metilmercaptano
Metantiolo
CH3CH2SCH3CH2
Dietilsolfuro (dietiltioetere)
Eiltioetano
C6H5SSC6H5
Difenildisolfuro
Fenilditiobenzene
(CH3)3S+ BrS
Bromuro di trimetilsolfonio
C6H 5 C
C6H 5
Tiobenzofenone
SCH 3
S-Metil-ditioacetato
S
CH 3
C
Alcuni composti solforati ossidati
O
C 2H 5
S
OH
Acido etansolfinico
O
H 3C
S
OH
Acido metansolfonico
O
O
H 3C
S
Cl
Cloruro di metansolfonile
Et
Etil-metil-solfossido
C6H5
Difenilsolfone
O
O
H3 C
S
O
C6H 5
S
O
Ottenimento dei mercaptani
EtBr
+
NaSH
EtSH
NH 2
EtBr
+
S C
Et
+
S C
NH 2
NH2
-
Br
+
NaOH
NH2
etere
NaBr
EtSH + NH 2CN
bromuro di S-etil-isotiouronio
tiourea
Br
MgBr
Mg
etere
SMgBr
S
SH
H+/H2O
Ottenimento dei tiofenoli
SO2Cl
Me
Me
ClSO3H
Me
SH
Zn
Me
HCl
Me
S
-S
S
N2
+
SCOEt
calore, -N2
Me
S
OH
Me
S
-
C
Me
C
O + EtOH
HO
OEt
S
OH
EtO
SH
S
Me
C
KS
OEt
etilxantato di potassio
-
H+
CS2 + EtOK
Me
Me
Solfuri e disolfuri
C2H5SH
C2H5SNa
+
+
NaSH
C2H5SNa
+
H 2S
C2H5Br
(C2H5)2S
+
NaBr
I2
SH
S S
Ossidazione dei mercaptani e dei solfuri
O
R SH
R S OH
R S OH
acido solfenico
acido solfinico
O
R S OH
O
acido solfonico
Me
S
Me
H2O2, MeCO2H
25 °C
Me
S O
Me
dimetilsolfossido
H2O2, MeCO2H
25 °C
Me
Me
O
S
O
dimetilsolfone
Solfossidi
CH3 CH2
S
CH2 CH 3
N2O4/CHCl3
0 °C
O
S
Cl
COOH
O
CH3 CH 2
-
S
+
O
S
+
CH2Cl2/0 °C
CH 2CH 3
-
Chiralità dei solfossidi
R"
R'
S
O
O
S
R"
R'
L’inversione ad ombrello non avviene a temperatura ambiente
Solfoni
-
-
O
CH3
S CH 3
oppure
CH3
S CH3
H2O2/AcOH
O
CH3
2+
S CH 3
-
O
MeCONH
S
NHCOMe
CrO3, MeCO2H
20 °C
O
MeCONH
S
O
NHCOMe
Acidi solfonici
SO 3H
SO 2Cl
+
PCl5
170-180°C
15 h
Acido benzensolfonio
pKa= -6.5
NH 2
1.
2. H3O+
O
S NH
O
N-fenilbenzensolfonammide
NaOH/H2O
I detergenti contenenti il gruppo -SO3-Na+
CH 3
CH3 (CH2) 9 CH
SO 3Na
Alchilbenzensolfonato lineare (biodegradabile)
CH3 (CH2 )10 CH 2OH
alcool laurilico
+
H2 SO4
CH3 (CH 2)10CH2 OSO3 H
monoestere solforico
Na2CO3
CH 3(CH2 )10 CH 2OSO 3-Na+
laurilsolfato di sodio