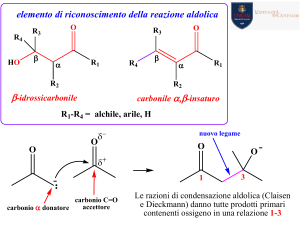
Gli α-amminoacidi (AA).
Acidi carbossilici con un gruppo amminico in posizione 2
Il carbonio α è uno stereocentro in tutti gli AA
con la sola eccezione della Glicina
Il gruppo R differenzia i vari AA
*
Forme enantiomeriche degli amminoacidi
?
Gli stereoisomeri D, L sono riferiti alla D, L Gliceraldeide
Forma zwitterionica (dianionica a carica opposta); pH del punto isoelettrico (pI)
Minima solubilità in acqua (precipitazione) perché la carica totale è nulla.
Massima solubilità in acqua
Metodi di sintesi degli amminoacidi - 1
Ammoniaca + α – alogeno acido (carbossilico)
NH2
Br
OH
Br2 / PBr3
NH3 / H2O
OH
OH
25 °C
O
O
Alanina (D,L)
O
Sintesi di Gabriel (via ftalimmide di potassio)
O
O
O
EtOOC
NK
_
N
=
COOEt
Br
EtOOC
N-CH
H
COOEt
O
O
O
O
COOH
H3O+
H3O+
COOH
+
N-CH
calore
COOH
O
COOH
NH2-CH2-COOH
Metodi di sintesi degli amminoacidi – 2
O
O
COOEt
COOEt
EtONa
N-C-H
N-C-R
R-X
COOEt
COOEt
O
O
alchilazione
Idrogeno “acido”
H3O+ / Calore
Acido Ftalico
+
NH2-CH-COOH
R
Sintesi di Strecker
HCN
NH3
CH3-CH-CH2-CHO
CH3
H3O+
H2O
CH3-CH-CH2-C=NH
CH3
H
CH3-CH-CH2-CH-COOH
CH3
NH2
D,L - Leucina
CH3-CH-CH2-CH-CN
CH3
NH2
Formazione del legame peptidico
(legame ammidico tra due amminoacidi)
Se la sintesi non viene “indirizzata” in modo opportuno si ottiene anche Ala-Ser,
Ser-Ser, Ala-Ala. !!
Gruppi protettivi dell’-NH2 e gruppi attivanti dell’acido (Esteri)
Il gruppo carbobenzossi (Cbz) dal Benzilcloroformiato
O
+
Cl
O
NH2-CH-COOH
R
formazione
O
Cbz-amminoacido
NH-CH-COOH
O
+ HCl
R
sblocco
CH3
HO
H2 / Pd
O
NH2-CH-COOH
NH-CH-COOH
R
Acido carbammico
R
CO2
Gruppi protettivi dell’-NH2 e gruppi attivanti dell’acido (Esteri)
Il gruppo terz-butossicarbonile (Boc) dal di-terz-butildicarbonato
O
O
(CH3)3C-O-C-O-C-O-C(CH3)3
+
NH2-CH-COOH
R
formazione
(CH3)3C-O-CO-NH-CH-COOH
(Boc-amminoacido)
R
sblocco
CF3-COOH
NH2-CH-COOH + CO2 + CH2=C(CH3)2
R
Gruppi protettivi dell’-NH2 e gruppi attivanti dell’acido (Esteri)
Gruppi attivanti che facilitano la formazione del legame peptidico (ammidico):
sequenza per la sintesi di polipeptidi
NH2-CH-COOH
Cbz-NH-CH-CO-OAr
Cbz-NH-CH-COOH
R
R
R
F
F
OAr =
O
NO2 ;
O
F
O2N
F
F
Cbz-NH-CH-CO-OAr + NH2-CH-COOH
Cbz-NH-CH-CO-NH-CH-COOH
R
R
R
attivazione
Cbz-NH-CH-CO-NH-CH-CO-OAr
R
R
R
sblocco
NH2-CH-CO-NH-CH-COOH
R
R
Sintesi di Merrifield: sintesi in fase solida di polipeptidi
Resina: polimero composto da stirene e divinil-benzene
Resina stirene-divinilbenzene
La resina viene funzionalizzata per clorometilazione (introduzione di gruppi –CH2Cl)
P
P
P
P
P
P
Struttura delle proteine: struttura primaria (sequenza di A.A.)
Struttura delle proteine: struttura secondaria.
(effetto dei legami ad idrogeno)
Struttura delle proteine: struttura secondaria.
(effetto dei legami ad idrogeno)
Struttura delle proteine: struttura terziaria.
(superavvolgimento per effetti idrofobici e
formazione legami disolfuro)
Vedere sul testo la struttura terziaria della mioglobina ( pg 561)
Struttura delle proteine: struttura quaternaria.
(aggregati di proteine)
Vedere sul testo la struttura quaternaria della emoglobina ( pg 563)
Analisi delle proteine: analisi della sequenza degli amminoacidi
Rottura della catena polipeptidica con bromuro di cianogeno; rottura specifica dove
È presente una metionina
Degradazione di Edman: riconoscimento dell’amminoacido N-terminale