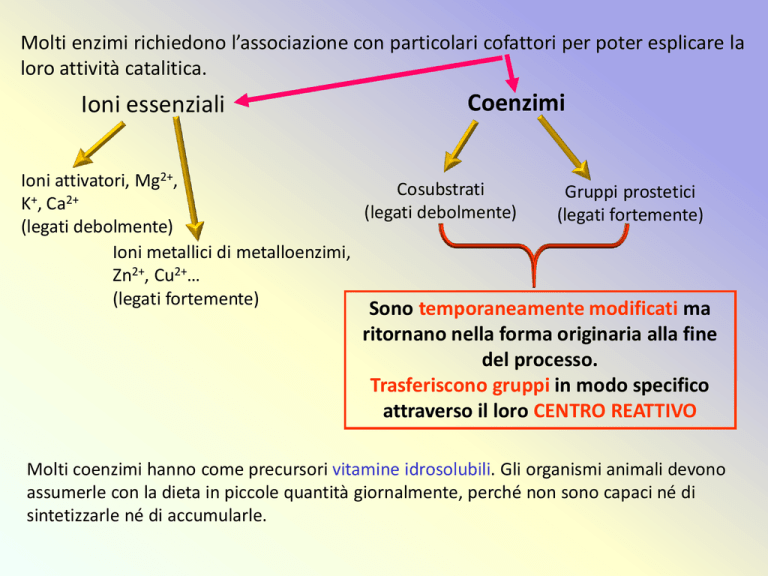
Molti enzimi richiedono l’associazione con particolari cofattori per poter esplicare la
loro attività catalitica.
Ioni essenziali
Coenzimi
Ioni attivatori, Mg2+,
Cosubstrati
+
2+
K , Ca
(legati debolmente)
(legati debolmente)
Ioni metallici di metalloenzimi,
Zn2+, Cu2+…
(legati fortemente)
Gruppi prostetici
(legati fortemente)
Sono temporaneamente modificati ma
ritornano nella forma originaria alla fine
del processo.
Trasferiscono gruppi in modo specifico
attraverso il loro CENTRO REATTIVO
Molti coenzimi hanno come precursori vitamine idrosolubili. Gli organismi animali devono
assumerle con la dieta in piccole quantità giornalmente, perché non sono capaci né di
sintetizzarle né di accumularle.
NAD, FAD, UBICHINONE: sono COENZIMI che
coadiuvano l’azione di enzimi che catalizzano
reazioni di ossidoriduzione (ossidoriduttasi,
deidrogenasi)
Coenzimi nicotinammidici
NAD+ (NICOTINAMMIDE ADENINA DINUCLEOTIDE)
NADP+ (NICOTINAMMIDE ADENINA DINUCLEOTIDE FOSFATO)
Derivano dall’acido nicotinico (niacina) o dalla nicotinammide
(vitamina B3)
Niacina
Ac. nicotinico
Sono coinvolti nelle reazioni di ossido-riduzione catalizzate dalle
DEIDROGENASI, trasferiscono 2 elettroni e 1 protone dal o al
substrato sotto forma di ione idruro
:HSono associati al sito attivo dell’enzima attraverso interazioni
elettrostatiche (debolmente)
NAD+
(ossidato)
4
:H- + H+
+
NADH (NADPH) (ridotto)
+ H+
(OPO32-)
NADP+
ossidato
fosfato in posizione 2
L’attacco dello ione idruro può
avvenire sopra (A) o sotto (B) il
piano dell’anello nicotinammidico
SPETTRO DI ASSORBIMENTO DEL NAD
OSSIDATO
RIDOTTO
La misura dell’assorbimento a 340 nm consente di seguire il decorso
di molte reazioni catalizzate dalle deidrogenasi NAD(P)+ dipendenti.
Uno ione idruro :H- è trasferito dal C-4
del NADH al C-2 del piruvato
+
H+
Piruvato
Lattato
deidrogenasi
L-lattato
Uno ione H+ è trasferito da un residuo di His del sito
attivo dell’enzima sull’ossigeno carbonilico che
diventa un ossidrile
COENZIMI FLAVINICI
FAD (FLAVINA ADENINA DINUCLEOTIDE)
FMN (FLAVINA MONONUCLEOTIDE)
Derivano dalla riboflavina (vitamina B2)
7
7,8-dimetil-isoallossazina
8
10
Ribitolo legato in N-10
Sono saldamente associati (in qualche caso anche covalentemente)
al sito attivo di DEIDROGENASI chiamate flavoproteine.
Partecipano a reazioni di ossidoriduzione in cui possono accettare o
rilasciare 2 elettroni e 2 protoni (due atomi di idrogeno)
Forma completamente ossidata
5
+H+
+
e-
1
Centri reattivi:
N-5 e N-1
.+
-
+H+ + e-
Semichinone
Forma completamente
ridotta
+ H+ + H:Accetta 1 atomo di idrogeno alla
volta oppure 2 insieme
UBICHINONE (COENZIMA Q): benzochinone con 4 sostituenti uno dei quali è
una lunga catena isoprenoide (6-10 unità).
Si solubilizza nel doppio strato lipidico delle membrane e essendo un forte agente
ossidante ha un ruolo chiave nel trasporto di elettroni attraverso i complessi della
catena respiratoria mitocondriale.
O
e
CH3O
CH3
2H , 2e-
CH
3 2 CH
(CH
O
CH3
O
CH33OO
2)nH CH
+
1H+, 1e-
O
OH
CH2)nH CH3O
C
coenzymeCHQ •
CH3
semichinone
e
CH3
3
CH
e3O+
2 H+
O
OH
CH3O
(CH2 CH
C
CH2)nH
CH3O
O
coenzyme Q
1H+, 1e
CH3
(CH2 CH
OH
C
CH2)nH
coenzyme Q •
e + 2 H+
CH3
CH3O
(CH2 CH
C
CH2)nH CH3O
coenzyme QH2
OH
Ossido-riduzione in 2 tappe
CH3
oppure
in un’unica tappa
CH
di gruppi acilici in reazioni di ossidazione di
COENZIMA A (HS-CoA) Trasferimento
molecole energetiche e di biosintesi di carboidrati e lipidi.
Deriva dalla vitamina B3 (ac. pantotenico)
β-mercaptoetilammina
Centro reattivo: gruppo tiolico –SH con cui
forma il legame tioestere con i gruppi
acilici che trasferisce.
3’-P-ADP (3’-fosfoadenosinaO
difosfato)
ll
H3C―C―S―CoA Acetil-CoA
Legame tioestere ad alta energia di idrolisi: ΔG0’ -31,5 kJ/mol
Quando si forma un legame tioestere viene conservata energia
metabolica che può essere utilizzata per promuovere altri processi.
TIAMINA PIROFOSFATO (TPP)
Deriva dalla tiamina (vitamina B1)
È il gruppo prostetico delle decarbossilasi (decarbossilazione degli α-chetoacidi). È
anche il gruppo prostetico delle transchetolasi (trasferimento di un gruppo a 2
atomi di carbonio contenente una funzione C=O)
Protone dissociabile
Centro reattivo: C-2 dell’anello
tiazolico
2
+
Il carbonio 2 dell’anello tiazolico è molto
acido a causa dell’effetto elettronattrativo
esercitato dall’N con carica positiva e dallo
zolfo in 1
R3
2
R1
+
R2
Piruvato
α-chetoacido
H+ rimosso da un
residuo basico
dell’enzima Enz-B:
TPP
(carbanione
dipolare)
Idrossietil-TPP
Enz-B―H
+
carbanione stabilizzato da
risonanza
BIOTINA
Sintetizzata dai batteri intestinali e poi assorbita
H 1 3 H
Centro
reattivo
H
-CH2-CH2-CH2-CH2-COOH
Biotina
Lys-Enz.
È il gruppo prostetico di enzimi che catalizzano reazioni di
carbossilazione ATP-dipendenti.
Si lega al sito attivo attraverso un legame carboammidico con
un residuo di Lys dell’enzima.
Legame
fosfoanidridico
ad alta energia
La biotina
attacca la CO2
Nel sito
attivo
dell’enzima
si produce
CO2
D. Voet – C. W. Pratt – J. G. Voet, FONDAMENTI DI BIOCHIMICA, Zanichelli editore S.p.A. Copyright © 2013
16 | 14












