FACOLTA’ DI MEDICINA E CHIRURGIA
CORSO DI LAUREA SPECIALISTICA IN MEDICINA E CHIRURGIA
TRATTAMENTO CHIRURGICO DEI TUMORI STROMALI DEL
TRATTO
GASTRO-ENTERICO:
ONCOLOGICI
FATTORI
PROGNOSTICI
PRE E POST “IMATINIB ERA”.
CANDIDATO: POLDI DAVIDE MATRICOLA 598788
RELATORE: PROFESSOR ANDREONI BRUNO
CORRELATORE: PROFESSOR CHIAPPA ANTONIO COSTANZO
ANNO ACCADEMICO 2005-2006
INTRODUZIONE
Quando si parla di tumori stromali gastro-intestinali (GIST) si fa
riferimento a una particolare forma di neoplasia che in anni recenti ha
destato grande interesse tra i patologi e nella comunità degli oncologi
per la possibilità di utilizzo di una terapia target mirata a cui i GIST
sono particolarmente sensibili.
I GIST presentano un’ incidenza di 1,5/2 casi ogni 100.000: le sedi di
insorgenza nel tratto gastrointestinale presentano percentuali che
variano dal 50-60% nello stomaco, 30% nell’intestino tenue e 10%
complessivamente nel grosso intestino e nel retto. Meno frequente è il
riscontro
al
di
fuori
del
tratto
gastrointestinale:
peritoneo,
retroperitoneo, cavità addominale, omento.
I GIST insorgono generalmente dopo i 50 anni, in media a 55 anni, e
sono raramente riscontrati nei giovani adulti. Essi rappresentano il
2,2% delle neoplasie gastriche, il 14% delle neoplasie del piccolo
intestino e lo 0,1% di quelle del grosso intestino.
La sede di insorgenza non è di per sé predittiva del comportamento
della neoplasia, anche se quelle gastriche sono più frequentemente a
basso rischio di malignità.
Istogenesi e meccanismi di alterazione di KIT nei GIST
Opinione condivisa dalla maggior parte dei patologi è che i GIST
originino dalle cellule interstiziali di Cajal presenti nel tratto
gastrointestinale in corrispondenza dei gangli nervosi dei plesso
2
mioenterico di Auerbach a cui si attribuiscono funzioni di cellule
pacemaker in grado di coordinare l’attività peristaltica del sistema
gastrointestinale.
KIT è un recettore tirosin-chinasico codificato dal proto-oncogene
situato sul braccio lungo del cromosoma 4 (4q11-q12) ed è costituito
da 21 esoni. Questo gene, conosciuto come c-kit, è l’omologo cellulare
dell’oncogene v-kit del virus del sarcoma felino di Hardy-Zuckerman.
L’espressione di KIT è stata osservata in vari tipi cellulari durante lo
sviluppo embrionale e in cellule differenziate è stato osservato
particolarmente espresso nelle cellule interstiziali di Cajal.
3
Strutturalmente, KIT è un recettore tirosin-chinasico di tipo III, simile ai
recettori del fattore di crescita delle piastrine, il PDGFR: tutti questi
recettori possiedono cinque ripetizioni extracellulari immonoglobulinosimili e un dominio tirosin-chinasico separato in due porzioni
dall’inserzione di una sequenza di lunghezza variabile a seconda del
recettore.
Fisiologicamente il recettore viene attivato dallo specifico ligando che è
conosciuto come SCF. Questo legame che avviene nella porzione di
recettore extracellulare, causa una omodimerizzazione di KIT, ossia
rende possibile che due recettori si appaino sulla membrana
citoplasmatica della cellula. A questo punto, il recettore è in grado di
autofosforilarsi sui residui intracellulari di tirosina e, quindi, di attivarsi
come tirosin-chinasi, che trasferisce i gruppi fosfato dell’ATP ai residui
tirosinici di proteine bersaglio che a loro volta vengono così attivati. La
cascata di traduzione del segnale fino al nucleo coinvolge molte
proteine, come le MAP chinasi, le PI3 chinasi, STAT5, RAS e JAK2,
AKTmTOR, implicate nella proliferazione e differenziazione cellulare
promossa a monte da KIT.
In assenza di legame con SCF, il recettore è una proteina transmembrana monomerica enzimaticamente inattiva, ossia non “pronta”
stericamente a omodimerizzare e successivamente ad autofosforilarsi.
Nel 1998, Hirota e coll. hanno documentato non solo l’aumentata
espressione di KIT nei GIST, ma anche la presenza di mutazioni a
4
livello del dominio iuxtamembrana (esone 11) del gene KIT in cinque di
sei pazienti (83%) affetti da questi tumori. Questi recettori KIT codificati
dal gene mutato hanno attività chinasica costitutiva, cioè risultano
fosforilati indipendentemente dalla presenza del ligando SCF.
Molto interessantemente, questi KIT mutati se espressi in cellule
Ba/F3, sono in grado di conferir loro un fenotipo tumorale, cosa che
non sussiste se viene espresso un KIT normale, non mutato. Questi
risultati suggeriscono pertanto che l’attivazione oncogenica di KIT
riveste sicuramente un ruolo fondamentale nella crescita e nella
sopravvivenza dei GIST.
La regione iuxtamembrana, codificata dalla porzione di DNA
corrispondente all’esone 11, ha la funzione di inibire la dimerizzazione
del recettore in assenza dello specifico ligando. E’ in questa regione
che si trova infatti un dominio proteico chiamato di “autoinibizione” che
in assenza di SCF mantiene il recettore in uno stato conformazionale
non adatto a legare ATP. Mutazioni in questa regione impediscono
questa funzione, cambiano la conformazione del recettore che diventa
“prono” al legame con ATP, permettendo attivazione del recettore
anche in assenza del proprio ligando.
Alterazioni nell’esone 11 sono molto frequenti tanto che questo esone
è considerato il maggior hot spot di alterazioni del gene KIT.
Altra regione che può essere alterata in questi tumori, anche se meno
frequentemente, è la porzione extracellulare codificata dall’esone 9 e
5
responsabile della omodimerizzazione del recettore. Lux e coll. hanno
descritto per primi una mutazione a livello di questo dominio di KIT in 6
GIST che presentavano un esone 11 wild type, cioè senza mutazioni.
Si trattava della duplicazione dei codoni 501-502 (alanina-tirosina). Su
127 GIST maligni analizzati in un lavoro di Heinrich e coll. del 2003, 23
(18,1%) presentavano mutazioni dell’esone 9. Solo una mutazione
(duplicazioni codoni 506-508) era differente dalla duplicazione 501-502
descritta in precedenza. Il 95% dei GIST che presentano mutazioni di
questo esone sono intestinali. Il meccanismo di azione delle mutazioni
dell’esone 9 non è stato ancora determinato, anche se si suppone che
alterazioni strutturali in questa regione provochino una dimerizzazione
aspecifica senza che il ligando sia presente. Ulteriori studi modellistica
proteica potrebbero essere di aiuto nel capire questo fenomeno.
Altre regioni che sono state trovate alterate nei GIST sono le porzioni
di proteina codificate dall’esone 13 e 17, che costituiscono il dominio
chinasico del recettore, la tasca ove alloggia l’ATP che deve così
cedere il suo gruppo fosfato al recettore fosforilandolo e rendendolo
attivo. In particolare le mutazioni l’activation loop del recettore (esone
17) sono molto rare nel GIST. Rubin e coll. hanno evidenziato due
sostituzioni di singolo amminoacido (N822K e N822H), ciascuna in un
solo paziente. Su 322 tumori esaminati da Heinrich e coll in un lavoro
del 2003, solo 2 (0,6%) presentavano la mutazione N822K. La
sostituzione D802Y è stata riportata in alcuni GIST familiari, ma non è
6
mai stata osservata in forme sporadiche degli stessi tumori. Mutazioni
in questi due esoni determinano attivazione costitutiva del dominio
chinasico, ma il meccanismo attraverso cui ciò avviene non è ancora
noto.
A seconda della porzione di recettore che è alterata, si possono quindi
suddividere le varie mutazioni in regolatorie (esoni 11 e 9) in quanto
alterano regioni con siti di regolazione della forma/struttura del
recettore, e mutazioni enzimatiche (esoni 13 e 17) in quanto il, dominio
chinasico, sito ove avviene la reazione di fosforilazione, viene ad
essere perturbata. Ed è in questi termini che risulta chiara come la
diversa risposta ad un farmaco, che compete con ATP proprio nel sito
catalitico del recettore, sia relata a questi diversi tipi di mutazioni.
È noto che i GIST rispondono clinicamente ed anche patologicamente
ad una molecola chiamata Imatinib, conosciuta anche come STI571.
Questo composto è un inibitore di alcune tirosin-chinasi, tra le quali le
chinasi intracellulari ABL e la proteina di fusione BCR-ABL presente
nella CML ed i recettori con attività tirosin-chinasica KIT e PDGFR.
Imatinib è nato da varie modificazioni chimiche di un composto della
classe delle 2-fenilaminopirimidine che presentava debole attività
inibitoria delle serin/treosin e tirosin-chinasi.
Questo composto è stato utilizzato per la sintesi di una sostanza che
potesse avere una forte funzione inibitoria specifica per le tirosinchinasi.
7
La perdita del potere inibitorio verso le serin/treonin chinasi è stata
ottenuta con sostituzione a livello della posizione 6 dell’anello anilinofenilico, mentre l’introduzione di un gruppo metilico in questa posizione
ha potenziato l’attività inibitoria tirosin-chinasica della molecola.
L’inibizione del recettore PDGF è stata ulteriormente aumentata con
l’introduzione di un gruppo benzamidico sull’anello fenilico.
Infine, l’introduzione di N-metilpiperazina come catena laterale polare
ha migliorato la solubilità del principio attivo e la sua biodisponibilità
per somministrazione orale. Il risultato di queste varie modificazioni ha
dato origine a STI571-imatinib, un antagonista competitivo dell’ATP
che, legandosi con alta affinità ai suoi domini di legame, blocca il
trasferimento di gruppi fosfato dall’ATP stesso ai residui tirosinici sulle
proteine substrato, impedendo in questo modo la trasduzione del
segnale.
Quindi nella terapia molecolare “mirata” (targeted therapy) viene
impiegato un farmaco in grado selettivamente di bloccare un punto
della deregolazione pathway patogenetico. Più il farmaco si adatta
perfettamente all’alterazione che provoca la deregolazione, più
efficace sarà la risposta clinica. E i GIST perfettamente ricalcano
questo modello. Imatinib compete molto bene con ATP nel legare il
dominio chinasico di un recettore KIT attivato da mutazioni dell’esone
11 meno bene con mutazioni nell’esone 9, e risulta praticamente
inefficace se KIT risulta attivato da mutazioni nell’esone 13 o 17 (che
8
costituiscono il dominio chinasico) in quanto, proprio perché mutato
viene a mancare l’ambiente adatto affinché Imatinib si possa legare.
Risulta quindi fondamentale capire quale sia il meccanismo di
attivazione del recettore al fine di poter disegnare al meglio la terapia
partendo dalla scelta della molecola che più efficacemente è in grado
di bloccare quella determinata mutazione.
Recentemente è stato dimostrato che nei GIST un altro recettore
tirosin-.chinasico può essere alterato: il PDGFRA.
È stato osservato che le mutazioni attivanti sono mutuamente
esclusive, ossia se muta KIT non muta PDGFRA. È infatti, l’analisi del
DNA genomico di GIST col KIT wild type ha permesso di identificare
una serie di mutazioni a livello del dominio iuxta-membrana (esone 12)
e dell’activation loop (esone 18) del gene codificante per PDGFRA.
Clonate e transfettate in linee cellulari le isoforme mutate risultano
essere costitutivamente fosforilate anche in assenza di PDGF-AA
(ligando
di
PDGFRA):
questo
dato
confermerebbe
l’ipotesi
dell’attivazione oncogenica.
Generalmente la morfologia dei GIST con mutazioni in PDGFRA è
epitelioide e molti di questi tumori non esprimono KIT o sono
debolmente positivi per la colorazione immunoistochimica specifica.
In compenso, i profili di trasduzione del segnale sono indistinguibili da
quelli attivati da GIST mutati in KIT: questo dato suggerisce che
PDGFRA potrebbe essere un oncogene alternativo a KIT e anche una
9
loro eterodimerizzazione potrebbe essere possibile. Anche PDGFRA
attivato da mutazione nell’esone 12 è responsivo a Imatinib, mentre
non lo è se attivato da mutazioni nell’esone 18.
Ultimamente sono stati descritti casi di GIST che dopo un’iniziale
risposta al farmaco sviluppano resistenza ad Imatinib. L’analisi
molecolare di questi tumori ha dimostrato come causa di resistenza
secondaria al farmaco la presenza di mutazioni aggiuntive a carico del
gene KIT che vanno a distruggere la perfetta adattabilità di Imatinib nel
dominio chinasico.
Queste mutazioni in altre parole cambiano la conformazione del
recettore che non è più in grado di essere legato da Imatinib mentre
continua ad essere legato da ATP, attivando perciò pathway
patologico responsabile della crescita e proliferazione neoplastica. È
stato però dimostrato come molecole analoghe a Imatinib siano in
grado di funzionare e di bloccare la fosforilazione di questi recettori
resistenti.
Criteri nella diagnosi di GIST
La maggioranza dei GIST mostra non equivoca, diffusa, forte positività
citoplasmatica con l’anticorpo CD117 (c-KIT).
La maggioranza dei GIST presenta positività al KIT nel 90% delle
cellule tumorali, una piccola minoranza presenta colorazione focale
ristretta a <20% delle cellule tumorali. Se il significato di tale ridotta
10
positività ai fini terapeutici non è chiaro, può sussistere nel
campionamento di piccoli frammenti bioptici il problema di reperti falsi
negativi.
La distribuzione e l’intensità della immunoreazione per KIT non è
correlata al pattern istologico, alla sede di insorgenza della neoplasia,
al potenziale di malignità tumorale o alle caratteristiche della stessa,
primitiva o metastatica. Il criterio di immunoreattività con CD117 non è
l’unico elemento utile nel formulare la diagnosi istopatologica di GIST:
infatti è stato sottolineato come i tumori che non presentano i caratteri
morfologici dei GIST anche in presenza di reattività con c-KIT non
debbano essere denominati GIST, e altresì che i rari tumori (dal 5 al
10% secondo le casistiche) che hanno caratteri morfologici ed
ultrastrutturali di GIST ma che per una ragione o per l’altra non si
colorino con c-KIT dovrebbero essere nondimeno definiti GIST.
In questi casi l’approfondimento con analisi molecolare delle mutazioni
di KIT dovrà essere associato all’analisi della mutazione della tirosinchinasi PDGR-ά presente in circa un terzo dei casi di KIT wild type.
Sono riportati in letteratura casi di GIST immunofenotipicamente KIT
positivi pur in assenza di mutazioni di KIT o di PDGFR-ά in pazienti
portatori di specifiche alterazioni genetiche come al MF-1 e la triade di
Carney.
Nell’evenienza di neoformazioni morfologicamente diverse dai GIST
con dubbia KIT-positività (ad esempio la fibromatosi mesenterica),
11
particolare cura va posta nella interpretazione della reazione
immunoistochimica e all’impiego corretto dell’antisiero senza il ricorso
a tecniche di smascheramento antigenico.
Il 70% dei GIST presentano un pattern di proliferazione a cellule
fusate, mentre i restanti presentano cellule tumorali con aspetto
epitelioide (20%) o misto (10%).
L’aspetto epitelioide è più comune nei tumori a differenziazione
muscolare (il 30-40% è immunoreattivo con l’actina muscolare liscia) e
sembra essere più frequentemente associata a mutazione di PDGFRά.
I GIST con aspetti di differenziazione neurale sono in genere costituiti
da cellule fusate che crescono con disposizione fascicolata, a palizzata
o a formare vortici.
La
deposizione
di
collagene
amorfo
extracellulare
eosinofilo
(immunoreattivo al collagene tipo VI) definito come fibre schenoidi,
generalmente è presente nei GIST ileali di solito associato alla
differenziazione neurale.
Caratteri morfologici più inusuali comprendono la matrice mixoide
prominente,
cellule
tumorali
tipo
signet-ring
cell,
aspetti
paraganglioma-like o cellule multinucleate simil-osteoclastiche. I
markers immunoistochimici da utilizzare in un ideale pannello di
anticorpi comprendono oltre il CD117, actina, S-100 ed il CD34
(presente nel 60-70% dei GIST).
12
Rara è l’espressione di desmina (utile nella diagnosi differenziale con i
leiomiosarcomi) e anche raro è il riscontro di positività alle
citocheratine.
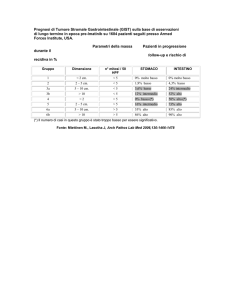
Parametri utili ai fini prognostici
E’ ben nota ai patologi la difficoltà di predire con assoluta certezza la
prognosi nei tumori stromali del tratto gastrointestinale. Ad oggi gli
unici elementi di certezza ci pervengono da dati clinici che possiamo
così riassumere:
a.
qualsiasi GIST può comportarsi in modo maligno;
b.
la metà dei GIST localizzati al momento della diagnosi e
completamente asportati presentano recidive entro i primi cinque
anni dall’intervento chirurgico.
Numerosi sono i fattori prognostici studiati o ancora soggetti al vaglio
dei ricercatori.
Pattern morfologico: in uno studio condotto su un campione di pazienti
con
follow-up
di
60
mesi
è
stata
riportata
una
prognosi
significativamente più sfavorevole in pazienti con GIST ad aspetto
epitelioide.
Ulcerazione e invasione della mucosa: l’ulcerazione della superficie
endoluminale dello stomaco e dell’intestino è comune evenienza nei
GIST determinando di conseguenza sanguinamento (frequente
sintomo di esordio nei GIST). Non è un parametro di utilità
13
prognostica. Altresì l’invasione della mucosa è stata osservata nei
GIST correlarsi alla malignità.
Marker
immunoistochimici:
espressione
di
KIT,
CD34
e
differenziazione muscolare o nervosa non sembrano avere alcun
valore prognostico.
Indici di proliferazione: la presenza di nuclei tumorali immunoreattivi al
Ki-67 superiore al 10% sembra associarsi ad un elevato rischio di
metastasi e a prognosi infausta. Altri autori non hanno rilevato
significative differenza tra la conta delle mitosi e l’indice proliferativi
fornito dal MIB-1 o dal Ki-67.
Sede: la valutazione della sede di insorgenza dei GIST è fonte di
controversia ancora irrisolte; a fronte di un gran numero di casi di GIST
del piccolo intestino ad alto rischio, i GIST gastrici appaiono gravati
percentualmente da un grado di rischio complessivamente più basso a
parità di dimensioni e di conta mitotica nella neoplasia. I rari GIST
esofagei sono anch’essi gravati da prognosi sfavorevole. I GIST
extragastrointestinali sono gravati da alta mortalità ( soprattutto al
mesentere e al retroperitoneo). Nonostante la messe di dati
sostanzialmente a favore di una distinzione in base alla sede di
insorgenza dei GIST, i criteri elaborati nella Consensus Conference di
Bethesda si applicano a tutti i GIST indipendentemente dalla sede di
origine. La suddivisione in quattro categorie di rischio (very low, low,
intermediate, e high) è formulata in base alle dimensioni (diametro
14
massimo della neoplasia in centimetri) e alla conta delle mitosi
effettuata in 50 high-power fields (HPF). Tabella 1
Il vantaggio di questa valutazione consiste nell’introduzione delle
categorie di rischio che risultano, se pur in un campo di valutazione
probabilistico, senz’altro più fondate (o approssimate al vero) di quanto
non fosse la distinzione in benigno o maligno. Di recente, grossa
attenzione è stata riposta nella validazione di parametri molecolari
attendibili ai fini prognostici: il tipo di mutazione di KIT, oggetto di
numerosi studi talora in contraddizione tra loro, ultimamente ha
evidenziato che mutazioni dell’esone 9 identificano un subset di GIST
localizzati soprattutto nel piccolo intestino e associati a prognosi
sfavorevole. Senz’altro l’analisi mutazionale di KIT è di maggiore
significato nel predire la risposta del tumore alla terapia con imatinib
mesylate. Di rilievo sembra essere il significato della ridotta o assente
15
espressione della proteina p16 correlata ad un andamento aggressivo
dei GIST. La considerazione che anche i GIST ad alto rischio hanno
decorso lento con recidive peritoneali o metastasi a distanza anche 10
o 15 anni dopo l’insorgenza, fa ritenere indispensabile per tutti i
pazienti un follow-up a lungo termine.
Modificazioni da targeted therapy
Il meccanismo competitivo con cui Imatinib agisce entrando nella tasca
dell’ATP in corrispondenza del sito enzimatico della molecola
recettoriale tirosinchinasica e, impedendo il legame, inibisce la
fosforilazione del recettore, è alla base di tutte le modificazioni che il
patologo incontra nell’osservare i GIST asportati o biopsiati dopo
terapia. I meccanismi molecolari alla base della risposta al farmaco
sono complessi e non ancora interamente delucidati, ma l’induzione
dell’apoptosi nelle cellule tumorali e il blocco della proliferazione
sembrano svolgere un ruolo. La risposta del tumore e talora presente
dopo poche settimane di terapia; i riscontri istologici eseguiti sui
pazienti in cui iniziava la resistenza secondaria al farmaco hanno
evidenziato quadri di completa risposta con sclerojalinosi e talora
presenza di debris nucleare e di corpi apoptotici in assenza di residuo
tumorale vitale. L’assenza di cellule immunoreattive al KIT conferma
tale dato morfologico peraltro già evidenziato fin dal primo caso
riportato in letteratura relativo al primo paziente sottoposto alla terapia.
16
L’alternarsi di aree di risposta a noduli comprendenti cellule tumorali
vitali testimonia il presentarsi dei fenomeni di resistenza in parte
analoghe a quelli già noti nei pazienti sottoposti a imatinib nella
leucemia mieloide cronica. Recentemente è stato dimostrato come il
verificarsi di una seconda mutazione di KIT insorta durante la terapia
induca resistenza secondaria al farmaco.
Metodi e pazienti
Pazienti:
la raccolta dati dei pazienti affetti da GIST è stata possibile grazie
all’utilizzo dei database degli ospedali. Sono stati raccolti i dati riguardo
pazienti che hanno avuto una diagnosi istopatologica di leiomioma,
leiomioblastoma,
leiomiosarcoma,
e
tumori
stromali
del
tratto
gastroenterico dal 1994 all’Ottobre 2004.
Tutti questi pazienti hanno subito un trattamento chirurgico del tumore.
I pazienti sono stati catalogati in base all’età, sesso, sintomi clinici
presenti al momento della diagnosi quali dolore addominale, anemia,
massa addominale palpabile, tipo di tumore, diametro massimo della
massa, durata dell’intervento chirurgico, estensione della resezione
chirurgica, presenza o insorgenza di metastasi a distanza. I pazienti
inclusi sono stati seguiti dalla prima visita fino al completamento del
follow up o al decesso quando avvenuto.
17
Non esisteva un protocollo da seguire: sono stati inseriti tutti gli esami
di
stadiazione
quali
RX
del
torace,
TC
torace-addome-pelvi,
ecoendoscopia del tratto gastrointestinale dove necessario.
Le analisi statistiche sono state elaborate con il software SPSS 12.0
(Chicago, IL, USA). Student’s t test è stato utilizzato per confrontare le
variabili continue, il chi-quadrato test è stato impiegato per analizzare
le variabili dicotomiche. La sopravvivenza è stata calcolata a partire dal
giorno della diagnosi fino alla morte o sino all’ultimo giorno di followup. La sopravvivenza disease-free è stata calcolata dalla prima
diagnosi fino alla recidiva tumorale o alla comparsa di metastasi a
distanza. Le analisi Kaplan-Meier con test log-rank sono state utilizzate
per comparare la sopravvivenza totale e la sopravvivenza diseasefree. La Cox proportional hazard method è stata utilizzata per la
valutazione dei fattori prognostici.
Immunoistochimica
I campioni tumorali sono stati esaminati utilizzando diversi marker
immunoistochimici:
•
anticorpi commerciali contro il CD117-KIT (1:50 Santa Cruz
Biotech, CA, USA)
•
proteina S-100 (1:40, Noavacastro Labs, USA)
•
Desmina (1:50 DAKO); Astina del muscolo liscio (1:300 DAKO)
18
Sono state eseguite valutazioni qualitative di immunoreattività
conformemente alle disposizioni dei laboratori produttori (casa
farmaceutica e/o produttore).
Risultati:
Sono stati analizzati tessuti derivanti dall’asportazione chirurgica di 61
pazienti.
Tutti
sono
risultati
positivi
al
CD117
all’analisi
di
immunoistochimica. Tutti i pazienti erano affetti da tumore primario;
solo 3 su 61 pazienti (5%) presentavano metastasi epatiche sincrone.
29 uomini e 32 donne di età media 60 anni (range 23-86).
Il tumore era localizzato nello stomaco in 41 casi (67%), nel piccolo
intestino in 14 casi (23%), nel colon in 4 casi (5%), nel duodeno in 2
casi (3%) nel retto in 1 solo caso (2%).
I
sintomi
più
frequenti
al
momento
della
diagnosi
erano
il
sanguinamento ed il dolore addominale in 11 pazienti (18%), senso di
pesantezza addominale e/o imbarazzo in 7 pazienti (11%). 20 pazienti
(33%) presentavano un quadro di anemia al momento della diagnosi,
15 pazienti (26%) presentavano all’esame obiettivo una massa
addominale palpabile. Per 6 pazienti (10%) asintomatici il riscontro di
GIST è stato occasionale durante l’esecuzione di esami strumentali
eseguiti di routine.
Nella tabella 2 vengono mostrati i diversi tipi di trattamento chirurgico a
cui sono stati sottoposti i pazienti presi in esame. L’unico paziente con
GIST localizzato a livello gastrico con singola metastasi epatica
19
sincrona al III segmento epatico è stato sottoposto a wedge resection
del III segmento e a resezione gastrica.
Le complicanze post-operatorie sono state in 1 caso emorragia gastrointestinale, in un altro leakage duodenale che ha portato ad un
secondo intervento chirurgico. Si è avuto un caso di sepsi da
batteriemia da catetere.
Mortalità perioperatoria nulla.
La valutazione anatomo-patologica dei pezzi operatori mostrava un
diametro massimo medio del tumore di 5,3 cm (range 0,6-38 cm).
10 tumori (16%) avevano un diametro massimo < 2 cm, 19 (31%) tra
2-5 cm, 17 (28%) tra 5-10 cm, e 15 (25%) >10 cm.
La conta mitotica fu < 5/50 per HPF in 37 casi (61%), tra 5-10/50 per
HPF in oltre 6 casi (10%) e >10/50 HPF in 18 casi (28%).
L’ulcerazione del tumore venne osservata in 42 casi (69%) l’emorragia
in 15 casi (25%) e necrosi tumorale in 17 casi (28%).
6 pazienti (10%) furono sottoposti ad intervento chirurgico palliativo a
causa del sanguinamento tumorale condizionante un severo quadro di
anemia.
3
pazienti
presentavano
metastasi
epatiche
sincrone
trattabili
chirurgicamente ed altri 3 presentavano una massa intraddominale
non resecabile.
In accordo con i criteri della NIH Consensus Conference 10 pazienti
(16%) risultavano appartenere alla classe a bassissimo rischio, 15
20
(25%) alla classe a basso rischio, 7 (11%) alla classe rischio
intermedio e 29 (48%) alla classe ad alto rischio.
Dei 61 pazienti trattati chirurgicamente 55 (90%) hanno subito una
resezione chirurgica radicale (R0). Tab. 3
La sopravvivenza complessiva per questi pazienti, a 5 anni, si è
dimostrata essere dell’88% comparato allo 0% per quei pazienti che
sono stati sottoposti ad un intervento chirurgico palliativo o non
radicale (R1-R2) (p<0,0001).
Durante il periodo di follow up 5 pazienti sono deceduti a causa di
ripresa di malattia, pazienti che appartenevano alla IV classe della NIH
al momento della diagnosi del primitivo.
Ulteriori 2 pazienti morirono per infarto miocardio acuto durante il
follow up ma erano liberi da malattia al momento del decesso.
7 pazienti che presentarono una ripresa di malattia furono trattati con
imatinib ad una dose giornaliera di 400 mg. 6 di questi pazienti sono
vivi dopo un periodo medio di follow up di 18 mesi. Fig. 1
Da un’analisi univariata, margini di resezione liberi da malattia, si è
osservato un miglioramento della sopravvivenza complessiva (91% a 5
anni per resezioni R0 rispetto allo 0% in resezioni R1-R2).
Pazienti inseriti nella classe NIH 4 che hanno subito una chirurgia
radicale hanno mostrato un incremento della sopravvivenza globale
(83% a 5 anni con intervento R0 rispetto allo 0% a 5 anni per gli
interventi R1. p=0,0031).
21
Altro fattore prognostico significativo influenzante la sopravvivenza
globale si è osservato essere il numero di mitosi (>10/50 HPF):
95% di sopravvivenza a 5 anni per pazienti con una conta mitotica ≤
10/50 HPF rispetto al 74% dei pazienti con conta mitotica > 10/50 HPF
(p=0,013). Fig. 2
Da un’analisi multivariata si è osservato che una conta mitotica >10/50
HPF influenza la sopravvivenza cancro-specifica e complessiva.
(HR=12350; CI 1295-117781: p=0,029)
A 5 anni la sopravvivenza disease-free per i pazienti che avevano
subito una chirurgia oncologicamente radicale era del 75%. Fig 2
Fra questi pazienti 8 svilupparono una ripresa di malattia dopo un
periodo medio di 21 ± 10 mesi (range: 4-36) di follow up.
Il fegato era la sede più frequente di ripresa di malattia (n=6; 75% delle
recidive). In questi 8 pazienti la sopravvivenza dalla recidiva fu del
30% a 3 anni.
Pazienti classificati come NIH 4 mostravano una sopravvivenza
disease-free a 5 anni del 65% comparato al 94% degli altri gruppi
combinati.
Il numero di mitosi e la grandezza del tumore mostrarono:
o Per 10/50 HPF 57% di sopravvivenza rispetto all’87% con conta
mitotica < 10/50 HPF
22
o Tumori con diametro massimo < 10 cm mostravano una
sopravvivenza disease-free dell’85% rispetto al 63% con
diametro > 10 cm (p=0,02)
Altro fattore di sopravvivenza studiato fu la presenza di necrosi
tumorale: la presenza fu associata ad un peggioramento della
sopravvivenza globale (51% in caso di necrosi rispetto al 91% in caso
di assenza di necrosi. p=0,002).
Dall’analisi di multivariate di fattori significativi derivanti da analisi
multivariate si è osservato che la necrosi tumorale ed il numero di
mitosi influenzano significativamente la sopravvivenza globale e
disease-free.
Discussione
L’analisi fatta su 61 casi di GIST ottenuta in un periodo di 10 anni
rivela che la sopravvivenza complessiva e la sopravvivenza diseasefree dipendono dalla dimensione del tumore, dalla conta mitotica, dallo
status risk (basso verso alto) e dalla radicalizzazione chirurgica.
La sede del tumore, la sintomatologia ed i segni clinici all’esordio quali
sanguinamento del tratto gastro-enterico, il dolore addominale e la
presenza di una massa addominale palpabile sono, così come
mostrato anche da altri studi, del tutto similari.
Non è stato creato alcun algoritmo specifico per la diagnosi dei GIST:
l’utilizzo combinato di TC ed RM si è rivelato utile nella diagnostica.
23
Nessun paziente del nostro studio è stato sottoposto a biopsia imaging
guidata o a prelievo citologico come proposto da altri autori.
Il trattamento dei GIST è stato rivoluzionato con l’introduzione
dell’imatinib nella malattia avanzata quando si è resa disponibile una
terapia medica “mirata su bersaglio molecolare” in una patologia
resistente alla chemioterapia convenzionale.
Il farmaco ha certamente modificato la prognosi a breve termine della
malattia avanzata, anche se resta da definirne l’impatto a medio
termine.
Nella malattia localizzata l’utilizzo dell’imatinib nell’ambito di un
approccio integrato è oggi in corso di sperimentazione.
La terapia dei GIST in fase localizzata è chirurgica. L’obiettivo è
l’exeresi completa della neoplasia, con margini liberi.
Non sembra esservi necessità di margini molto ampi anche se
l’inadeguatezza dei margini comporta un rischio di recidiva locale vera
e propria.
Ad oggi non vi è un’indicazione convenzionale all’uso adiuvante
dell’imatinib, cioè dell’unica terapia medica attualmente disponibile per
i GIST.
L’impiego adiuvante è logico, in linea di principio, in una malattia che in
molte presentazioni denuncia un rischio molto elevato di recidiva.
Il trattamento della malattia in una fase più precoce potrebbe prevenire
l’insorgenza di resistenze secondarie. D’altronde può anche essere
24
vero il contrario, con insorgenza precoce di resistenze secondarie e
difficoltà quindi al trattamento di un’eventuale recidiva.
Saranno solo gli studi randomizzati attualmente in corso, con braccio
di controllo senza terapia, a chiarire se sussista o meno un’indicazione
adiuvante. Questa sarà peraltro da considerare separatamente nelle
diverse fasce di rischio, e in pratica focalizzarsi sull’alto rischio.
L’eventuale utilizzo del farmaco in fase neoadiuvante in parte ricade
nelle stesse problematiche relative all’uso adiuvante.
In altri termini, soltanto una dimostrazione di efficacia in fase adiuvante
potrà indurre ad un utilizzo del farmaco in funzione preoperatoria.
D’altra parte vi sono alcune situazioni di malattia localizzata che
possono già oggi giovarsi, ragionevolmente, di una citoriduzione
preoperatoria.
Può essere il caso, ad esempio, di localizzazioni in sedi difficili
chirurgicamente o, soprattutto, di sedi di cui solo una citoriduzione può
consentire una chirurgia conservativa sotto il profilo anatomofunzionale.
È il caso delle localizzazioni rettali.
La decisione clinica non può che essere condivisa con il paziente,
nell’incertezza sul beneficio a lungo termine della terapia medica in
fase di malattia localizzata e/o sull’equivalenza di una chirurgia
conservativa dopo citoriduzione rispetto ad una chirurgia demolitiva.
25
Per quanto riguarda il follow up della malattia localizzata dopo
chirurgia adeguata, esso deve tenere conto della storia naturale.
La malattia come detto, comporta un rischio di recidiva soprattutto a
livello peritoneale ed epatico. Dunque l’esame radiologico di elezione
non può che essere sensibile a tale livello: la TC o la RM o
eventualmente l’ecografia.
La maggior parte delle recidive si verifica nei primi 5 anni dopo il
trattamento chirurgico della malattia localizzata e dunque è nei primi
anni che questi esami devono essere effettuati con maggiore intensità.
Il rischio, ma anche la velocità di diffusione dell’eventuale recidiva,
correlano con l’indice mitotico ed il diametro massimo della neoplasia >
5 cm.
Soprattutto nei casi con indice mitotico >10/50 HPF, ad alto rischio,
può essere ragionevole un follow up clinico e strumentale più serrato.
Questo è soprattutto vero se si considera che in alcuni casi la recidiva
peritoneale può evolvere velocemente e condizionare problemi clinici
quali
l’insorgenza
di
fenomeni
occlusivi,
deterioramento
delle
condizioni generali del paziente tali da compromettere la fattibilità della
terapia con imatinib.
Uno schema di follow up potrebbe ad esempio comportare un controllo
radiologico addominale ogni circa 3 mesi per almeno 3 anni, con Rx
torace ogni 6 mesi essendo comunque molto bassa la probabilità di
metastasi polmonari, soprattutto in assenza di recidiva addominale.
26
Negli anni successivi, il follow up potrebbe essere progressivamente
meno serrato, anche se si deve tenere conto del fatto che i GIST
possono recidivare anche dopo intervalli di tempo lunghi (media 10-15
anni), più probabilmente in caso di indice mitotico meno elevato.
La fase avanzata di malattia è stata spesso trattata con gli stessi
regimi chemioterapici in uso nei sarcomi dei tessuti molli dell’adulto.
D’altra
parte
i
GIST
mostrano
una
resistenza
notevole
alla
chemioterapia convenzionale.
È stata studiata questa resistenza sotto il profilo biologico mostrando le
differenze dei GIST da questo punto di vista rispetto ai leiomiosarcomi,
ovvero i sarcomi a cui sono stati in passato maggiormente accostati.
La frequenza di risposta alla chemioterapia convenzionale è < del 5%.
Anche per questo è stata particolarmente importante l’introduzione
dell’imatinib che ha dimostrato una capacità antitumorale intorno
all’85%.
Questa eccezionale attività antitumorale si è tradotta chiaramente in un
vantaggio di sopravvivenza: ora l’aspettativa di vita dei pazienti affetti
da GIST in fase avanzata è intorno ai 12-24 mesi.
La risposta tumorale è peraltro spesso notevole e rapida sotto il profilo
clinico, in presenza di sintomatologia di base.
Molti pazienti che hanno effettuato il trattamento con imatinib in
condizioni ciniche compromesse o cospicuamente sintomatiche hanno
infatti riportato un beneficio sintomatologico anche nel giro di pochi
27
giorni dall’inizio della terapia. Vi è poi il dato della risposta tumorale
precocissima rilevabile alla PET.
Alla PET, infatti, molti pazienti registrano una significativa diminuzione
dell’attività glicolitica del tumore nello spazio di giorni o addirittura ore
dall’inizio della terapia. Fig. 3
Figura 3. FDG-PET scan in paziente con GIST: a sinistra l’immagine al momento della
diagnosi e a destra dopo inizio trattamento con Imatinib
Questa assenza precoce di captazione alla PET coincide con una
inattivazione funzionale a livello molecolare e non con una scomparsa
del tumore.
In questo senso la PET è soprattutto un predittore di risposta. È stata
dimostrata la correlazione tra la PET e la successiva risposta
volumetrica del tumore evidenziabile in pochi mesi.
28
In effetti l’anticipo nella valutazione della risposta, quale consentito
dalla PET, può rivelarsi utile in diversi casi nei quali la TAC o la RM
non sono in grado di evidenziare chiaramente se la neoplasia stia
rispondendo o meno. Vi sono alcuni casi, infatti, in cui la risposta si
produce soltanto in intervalli di tempo piuttosto lunghi (mesi), e altri in
cui vi è addirittura, in fase iniziale, un vero e proprio aumento
volumetrico del tumore. In questi pazienti, I'aumento volumetrico è
essenzialmente determinato da fenomeni intralesionali di tipo necrotico
e/o emorragico, che evidentemente rappresentano segni di risposta.
Non sono chiari i motivi di questa tendenza necrotico-emorragica della
risposta nei GIST. Certamente, i GIST possono dimostrare fatti
necrotico-emorragici
anche
prima
della
terapia,
e
dunque
è
comprensibile che in caso di risposta questi fenomeni possano
ulteriormente
accentuarsi.
Il
clinico
deve
considerare
questo,
innanzitutto per evitare di interpretare come progressioni dei quadri
che sono in realtà di franca risposta. Ogni aumento volumetrico delle
lesioni in fase iniziale di terapia dovrebbe sempre essere valutato per
la presenza di necrosi e/o emorragia. Se l'aumento iniziale è
determinato da necrosi e/o emorragia, la malattia è, fino a prova
contraria, in risposta. La PET, come detto, può eventualmente dirimere
un eventuale dubbio diagnostico, anche se questo richiederebbe
l'effettuazione dell'esame, di base, in tutti i pazienti, cosa spesso non
29
facilmente fattibile al momento. In ogni caso, la TAC e la RM sono ben
in grado di rilevare necrosi ed emorragia.
La necrosi e l'emorragia sono importanti anche per le conseguenze
cliniche a cui possono dare luogo. Questo è ovvio per quanto riguarda
I' emorragia. Essa può determinare enterorragia, emoperitoneo,
anemizzazione rapida. Anche la necrosi può essere rilevante
clinicamente, ad esempio per la possibilità di fistolizzazioni ed
ascessualizzazioni. Da questo punto di vista, l'emorragia da risposta
rapida è innanzitutto un problema dei primi giorni di terapia, anche se
fatti emorragici possono continuare a verificarsi anche nelle settimane
e
nei
mesi
successivi
all'inizio
del
trattamento.
L'emorragia
intralesionale, ad esempio all'interno di lesioni epatiche, è un problema soprattutto per I'anemizzazione a cui può dare luogo, in quanto
di regola essa si tampona spontaneamente. Più rischiose possono
essere le emorragie digestive in caso di lesioni aggettanti nel lume del
tubo
gastroenterico,
o
I'emoperitoneo
di
voluminose
masse
addominali. In questo senso, sono da considerare a rischio soprattutto
le grosse masse, particolarmente se aggettanti nel lume (in pratica il
tumore
primitivo,
non
rimosso
chirurgicamente
o
recidivato
localmente). Le complicanze da necrosi sono invece più proiettate nel
medio
periodo.
Una
lesione
necrotica
può
progressivamente
fistolizzarsi (verso l'esterno o verso l'interno della cavità addominale),
dando luogo ad ascessi chiusi nell'addome o a fistole verso l'esterno.
30
È chiaro che, soprattutto qualora non siano proponibili provvedimenti
chirurgici sostanziali sul tumore, questi fatti settici intra-addominali
possono essere particolarmente difficili da affrontare. In generale, una
sintomatologia settica nei GIST in trattamento con lmatinib dovrebbe
indurre a ricercare possibili raccolte ascessuali, fistole, perforazioni
tamponate. Spesso la terapia antibiotica e la fistolizzazione, spontanea
o chirurgica, possono risolvere questi quadri, ma altre volte essi sono
di difficile gestione clinica, specialmente quando essi non siano ben
diagnosticabili strumentalmente e/o comunque non vi sia uno spazio
chirurgico concreto per l'estensione della neoplasia.
In prospettiva, la maggiore limitazione della terapia con Imatinib è
costituita
dalla
possibile
insorgenza
di
resistenza
"acquisita".
Quest'ultima si manifesta in pazienti inizialmente responsivi, che, dopo
mesi dall'inizio del trattamento, mostrano progressione di malattia. La
progressione
può
manifestarsi
globalmente,
oppure,
almeno
inizialmente, può riguardare una sola lesione, od alcune lesioni. AI
momento, non si hanno dati sull'incidenza effettiva di questo
fenomeno, che si affianca ovviamente alla resistenza "primaria", come
detto verosimilmente intorno al 10-15% dei casi. Peraltro, la resistenza
primaria si associa alla sede della mutazione dell'oncogene, divenendo
più probabile andando dalle mutazioni più frequenti (localizzate
nell'esone 11) a quelle meno frequenti (localizzate nell'esone 9 e in
altri esoni). La comprensione biomolecolare della resistenza primaria,
31
così come di quella acquisita, è evidentemente mirata alla possibile
realizzazione di terapie molecolari mirate anche per la "seconda linea"
terapeutica. Ovviamente, l'entità del fenomeno della resistenza
acquisita condizionerà fa prognosi ultima della malattia avanzata sotto
Imatinib, e anche if significato complessivo del trattamento: eradicante,
citoriduttivo (in vista per esempio di una chirurgia sul residuo), o
palliativo. D'altra parte è logico chiedersi cosa fare per contribuire a
limitare il rischio di resistenza acquisita. Nell'attesa di sviluppi
farmacologici rivolti ad affrontare il problema, è chiaro che una
possibilità è quella chirurgica. La chirurgia può rivolgersi all'exeresi di
lesioni in progressione, soprattutto se quest'ultima riguardi una parte
della malattia visibile (cioè solo una o poche lesioni). Oppure, in linea
di principio, la chirurgia potrebbe contribuire a prevenire l'insorgenza
della resistenza secondaria attraverso l' exeresi del residuo di malattia
dopo intervalli più o meno lunghi di terapia.
Di fatto, non solo non è noto quanto la terapia con lmaitnib richieda
una integrazione terapeutica con la chirurgia, ma neppure è stato
ancora stabilito, al momento, quale sia la durata ottimale della terapia.
Attualmente, la maggior parte dei pazienti in trattamento sta
proseguendo la terapia per periodi indefiniti, con la possibilità che essa
possa prolungarsi anche per anni, in assenza evidentemente di
progressione (o in caso comunque di persistenza di risposta dopo
exeresi di eventuali, singole lesioni in progressione). Sono peraltro in
32
corso studi clinici rivolti a confrontare il proseguimento a più lungo
termine della terapia con la sua sospensione dopo intervalli definiti (ad
esempio un anno), in assenza di malattia attiva visibile dopo risposta
maggiore.
Imatinib
viene
somministrato
continuativamente
ad
una
dose
giornaliera che, attualmente, è di 400 mg. È in corso il follow-up di due
grandi studi randomizzati che hanno confrontato nella malattia
avanzata la dose giornaliera di 400 mg con quella di 800 mg. Questi
due studi chiariranno dunque il quesito relativo alla dose ottimale nella
malattia avanzata. Vi sono stati casi di attività ad una dose superiore,
in assenza di attività a una dose inferiore. Questo ha determinato il
disegno dei due studi, che peraltro prevedevano il cross-over da 400 a
800 mg in caso di non risposta nel braccio a dose inferiore. La
somministrazione avviene in dose unica giornaliera a 400 mg,
assumendo il farmaco a stomaco pieno facendo seguire l'introduzione
di liquidi. Nel caso di somministrazione di 800 mg, la dose giornaliera
viene frazionata in due somministrazioni.
Peraltro, la terapia con Imatinib è usualmente ben tollerata, con effetti
collaterali limitati. Questi ultimi sono soprattutto concentrati nelle prime
settimane di terapia. L'effetto più frequente è l'edema, che spesso si
mantiene per diverse settimane. In genere non richiede terapia, ma
talvolta può necessitare di diuretici. Esso riguarda gli arti inferiori e le
regioni periorbitarie. Raramente, vi è una vera e propria ritenzione
33
idrica di grado notevole, che può determinare sovraccarico, o
versamenti pleurici o peritoneali. Il versamento peritoneale può
condizionare ad esempio un aumento di un'ascite pre-esistente e
aggiungersi alle difficoltà della valutazione della risposta in fase
iniziale. Spesso, I' ascite può assumere una nota emorragica, anche in
relazione ad una tendenza del farmaco a favorire in qualche modo la
diatesi emorragica. Peraltro, le emorragie sono in genere un effetto
secondario alla risposta tumorale, come sopra ricordato, e possono
assumere significato clinico particolarmente quando vi siano grosse
masse, soprattutto se aggettanti nel lume gastroenterico. In generale,
vengono sconsigliati gli anticoagulanti orali, venendo preferite, se è
necessaria una terapia anticoagulante, le eparine a basso peso
molecolare. Altro effetto collaterale possono essere i rush cutanei, solo
eccezionalmente importanti al punto da richiedere una terapia, con
antistaminici e/o steroidi. Nei primi giorni sono possibili fenomeni di
iperperistaltismo intestinale, con diarrea, sensibile ai comuni farmaci
antidiarroici. È possibile astenia, in alcuni casi di grado anche marcato.
Solo con il proseguimento del trattamento nei mesi, sono possibili
effetti mielodepressivi, tali da richiedere la sospensione temporanea
del farmaco. Vi può essere una tossicità epatica, anch'essa tale da
richiedere talvolta la sospensione temporanea del farmaco. È possibile
un effetto favorente la riattivazione virale in casi di pregressa epatite, e
in alcuni casi questo richiede la somministrazione concomitante di
34
antivirali. In generale, il trattamento degli effetti collaterali del farmaco
non presenta grosse difficoltà. In taluni casi, però, così non è, e in
effetti solo l'esperienza in corso nei pazienti in trattamento potrà
insegnare a maneggiare al meglio questi effetti col laterali di maggiore
impegno. In generale, il trattamento è cronico e quindi inevitabilmente
può richiedere sospensioni temporanee o riduzioni di dose. Peraltro,
l'intensità di dose sembra avere una importanza non secondaria, in
una
malattia
che
può
manifestare
l'insorgenza
di
resistenze
secondarie.
Conclusioni:
lo studio ha dimostrato che la radicalizzazione (R0) del tumore così
come la dimensione e l’attività mitotica, nonché la presenza di necrosi
intratumorale
sono
i
fattori
prognostici
più
importanti
nella
determinazione della sopravvivenza globale e disease- free.
Nell’era di imatinib e dei suoi effetti terapeutici è poco chiaro quello che
è o potrà essere il suo impiego in associazione alla chirurgia e la sua
sensibilità in caso di malattia metastatica.
In questo studio l’interpretazione clinico-patologica dello status risk del
tumore si è rivelato un approccio pratico per definire che la resezione
chirurgica oncologicamente radicale è il fattore prognostico chiave e
che la chirurgia nei GIST ad alto rischio deve essere supportata da un
approccio selettivo verso l’induzione o verso la terapia post-operatoria
molecolare.
35
Pazienti a rischio: 61
39
35
26
19
15
9
4
1
0
0
55
37
31
24
16
13
9
4
1
0
0
Figura 1. Sopravvivenza globale e sopravvivenza disease-free in
pazienti affetti da GIST.
36
months
Pazienti a rischio:
≤ 10 per 50 HPF
43
20
17
12
4
1
0
> 10 per 50 HPF
18
11
7
3
2
0
0
Figura 2. Sopravvivenza secondo il numero di mitosi per 61 pazienti
affetti da GIST.
37
Tabella 2. Prestazioni chirurgiche eseguite.
________________________________________________________
Procedure chirurgiche
N (% )
________________________________________________________
Wedge gastric resection
31 (51)
Resezione del piccolo intestino
14 (23)
Gastrectomia subtotale
8 (13)
Resezione colica
3 (5)
Gastrectomia totale
2 (3)
Duodenopancreasectomia
2 (3)
Escissione transanale
1 (2)
________________________________________________________
38
Tabella 3. Variabili clinicopatologiche dei 61 pazienti affetti da GIST in rapporto al numero di
mitosi per 50 HPF (≤ o >10)*
___________________________________________________________________________
Mitosi ≤10/50 per HPF
Mitosi >10/50 per HPF
p
Sede del tumore
stomaco
colon retto
piccolo intestino
duodeno
28 (68)§
13 (32)
1 (25)
3 (75)
12 (86)
2 (14)
2 (100)
0.09
0
Tipo di resezione chirurgica
R0
42 (74)
15 (26)
1(25)
3 (75)
≤ 10 cm
33 (72)
13 (28)
> 10 cm
10 (67)
5 (33)
R1+R2
0.04
Diametro del tumore
0.71
Necrosi intra-tumorali
Assenti
33 (75)
11 (25)
Presenti
10 (59)
7 (41)
*HPF, high power field
§ I numeri fra parentesi sono percentuali
39
0.21
Bibliografia:
1.
Suster
S.
Gastrointestinal
stromal
tumors.
Semin
Diagn
Patho11996; 13: 297-313
2. Langer C, Gunawan B, Schiiler P, Huber W, Fiizesi L, Becker H.
Prognostic factors influencing surgical management and outcome of
gastrointestinal stromal tumours. Br I Surg 2003; 90: 332- 339
3. Meittinen M, Sarlomo-Rikala M, Lasota I. Gastrointestinal stromal
tumors: recent advances in understanding their biology. Hum
Patho11999; 30: 1213-1220
4. Sircar K, Hewlett BR, Huizinga ID, Chomeyko K, Berezin I, Riddell
RH. Interstitial cells as precursors of gastrointestinal stromal tumors.
Am I Surg Patho11999; 23: 377-389
5. Kindblom LG, Remotti HE, Aldenborg F, Meis-Kindblom JM
Gastrointestinal pacemaker cell tumor (GIPACT): gastrointestinal
stromal tumors show phenotypic characteristics of the interstitial cells
of Cajal. Am IPatho11998; 152(5): 1259-1269
6. Miettinen M, Sobin LH, Sarlomo-Rikala M. Immunohistochemical
spectrum of GISTs at different sites and their differential diagnosis with
reference to CD 117 (KIT). Mod Pathol 2000; 13: 1134- 1142
7. Miettinen M, Lasota I. Gastrointestinal stromal tumors -definition,
clinical, histological, immunohistochemical and molecular genetic
features and differential diagnosis. Virchows Arch 2001; 438: 1-12
40
8. Mikhael AI, bacchi CE, Zarbo RJ, Ma CK, Gown AM. CD34
expression in stromal tumors of the gastrointestinal tract. Appl
Immunohistochem 1994; 2: 89-93
9. Debiec-Rychter M, Wasag B, Stul M, De Wever I, Van Oosterom A,
Hagemeijer A, Sciot R. Gastrointestinal stromal tumours (GISTs)
negative for KIT (CD117 antigen) immunoreactivity. I Pathol 2004; 202:
430-438
10. Gunawan B, Bergmann F, Hoer I, Langer C, Schumpelick V,
Becker H et al. Biological and clinical significance of cytogenetic
abnormalities in low-risk and high-risk gastrointestinal stromal
tumors.Hum Pathol 2002; 33: 316-321
11. EI-Rifai W, Sarlomo-Rikala M, Andersson LC, Knuutila S, Miettinen
M. DNA sequence copy number changes in gastrointestinal stromal
tumors: tumor progression and prognostic significance. Cancer Res
2000; 60: 3899-3903
12. Kontogianni K, Demonakou M, Kavantzas N, Lazaris ACh, Lariou
K, Vourlakou C, Davaris P. Prognostic predictors of gastrointestinal
stromal tumors: a multi-institutional analysis of 102 patients with
definition of a prognostic index. Eur I Surg Oncol. 2003; 29:548-556
13. Aparicio T, Boige V, Sabourin IC, Crenn P, Ducreux M, Le Cesne
A, Bonvalot S. Prognostic factors after surgery of primary respectable
gastrointestinal stromal tumours. Eur I Surg Oncol 2004; 30: 10981103
41
14. Ozguc H, Yilmazlar T, Yerci 0, Soylu R, Tumay V, Filiz G,
Zorluoglu A. Analysis ofprognoistic and immunohistochemical factors
in gastrointestinal tumors with malignant potential. I Gastrointest Surg
2005; 9: 418-429
15. Fletcher CD, Berman II, Corless C, Gorstein F, Lasota I, Longley
Bl, Miettinen M, O'Leary TI, Remotti H, Rubin BP, Shmookler B, Sobin
LH, Weiss SW. Diagnosis of gastrointestinal stromal tumors: a
consensus approach. Hum Pathol 2002; 33: 459-465
16. Kaplan EL, Meier P. Nonparametric estimation from incomplete
observation. I Am Stat Assoc 1958; 53: 457-481
17. Peto R. Pike MC. Conservation of the approximation (0-E2)/E in
the log-rank test for survival data on tumour incidence data. Biometrics
1973; 29: 579-584
18. DeMatteo RP, Lewis II, Leung D, Mudan SS, Woodruff JM,
Brennan MF. Two hundred gastrointestinal stromal tumors: recurrence
patterns and prognostic factors for survival. Am Surg 2000; 231: 51-58
19. Emory TS. Prognosis of gastrointestinal smooth-muscle (stromal)
tumors: dependence on anatomic site. Am I Surg Patho11999; 23: 8287
20. NishidaT, Nakamura 3, TaniguchiM,HirotaS, ItoT, Kitamura Y,
Matsuda
H.
Clinicopathological
features
tumors.JExpqjn Cancer Res 2000; 19: 417- 25
42
of
gastric
stromal
21.
Pardo
Martinez
C,Mayo.MartinezJ,Hernandez
AlvarezFernandez-Represa
J.
Gastric
stromal
Perez
C,
tumours:clinical
presentation and surgical options.. Rev EspEnferm Dig 2004; 96: 57883
22. Nowain A, Bhakta H, Pais S, Kanel G, Verma S. Gastrointestinal
stromal tumours: clinical profile, pathogenesis, treatment strategies
and prognosis. J Gastroenterol Hepatol 2005; 20: 818-24
23. Caramella T, Schmidt S, Chevallier P, Saint Paul M, BernardJL,
Bidoli R, Bruneton IN. MR features of gastrointestinal stromal
tumors..Clin Imaging 2005; .29: 251-4
24. King DM. The radiology of. gastrointestinal stromal tumours
(GIST). Cancer Imaging 2005; 15: 150-6
25. Tateishi U, MiyakeM, Maeda T, Arai Y, SekLK, Haegawa
T..CTandMRI findings in KIT- weak and KIT-negative atypical
gastrointestinal stromal tumors. Eur Radio12006; 16: 1537- 43
26. Palazzo L, Landi B, Cellier C, Cuillerier E, Roseau G, Barbier I-P.
Endosonographic features predictive of
benign and malignant
gastrointestinal stromal cell tumours. Gut 2000; 46: 88-92
27. Li SQ, O'Leary TI, Buchner SB, Przygodzki RM, Sobin LH, Erozan
YS, Rosenthal DL. Fine needle aspiration of gastrointestinal stromal
tumors. Acta Cytol. 2001; 45: 9-17
43
28. Kamiyama Y, Aihara R, Nakabayashi T, Mochiki E, Asao T,
Kuwano H, Oriuchi N, Endo K. 18 F-Fluorodeoxyglucose positron
emission tomography: useful technique for predicting malignant
potential of gastrointestinal stromal tumors. World I Surg 2005; 29:
1429-1435
29. Rudolph P, Chiaravalli AM, Pauser U, Oschlies I, Hillemanns M,
Gobbo M, Marichal M, Eusebi V, Hofler H, Capella C, Kloppel G.
Gastrointestinal
mesenchymal
tumors
-immunophenotypic
classification and survival analysis. Virchows Arch 2002; 441: 238-248
30.
Fraquemont
D.
Differentiation
and
risk
assessment
of
gastrointestinal stromal tumors. Am I Clin Patho11995; 103: 41-47
31.
BearzlI,Mandolesi
R:Gastrointestinal
A,
Arduini
F,
Costagliola
stromal
tumor.
A
study
of
A,
Ranaldi
158
cases:
clinicopathological features and prognostic factors. Anal Quant Cytol
Histo12006; 28: 137-47
32. Iaesalnieks I, Rummele P, Dietmaier W, Jantsch T, Zulke C, Schlitt
HJ, Hofstadter F, Anthuber M. Factors associated with disease
progression .in patients with gastrointestinal stromal tumors in the preimatinib era. Am J Clin Patho12005; 124: 740-8
33. Tarn C, Godwin AK. Molecular research directions in the
management of gastrointestinal stromal tumors. Curr Treat Options
Onco12005; 6: 473-86
44
34. NakamuraM, Yamamoto H, Yao T, Oda Y, Nishiyama K, Imamura
M, YamadaT, Nawata H, Tsuneyoshi M. Prognostic significance of
expressions of cell-cycle regulatory proteins in gastriointestinal stromal
tumor and the relevance of risk grade. Hum Patho1 2005; 36: 827- 37
35. Rubin B, Fletcher I, Fletcher C. Molecular insights into histogenesis
and
pathogenesis
of
gastrointestinal
stromal
tumors.
Surg
Patho12000; 8:5-10
36.
Harrison
ML,
Goldstein
D.
Management
of
metastatic
gastrointestinal stromal tumour in the Glivec era: a practical casebased approach. Intern MedJ 2006; 36: 367-77
37. Raut CP,Posner M, Desai J, Morgan JA, GeorgeS, Zahrieh D,
Fletcher CD, Demetri GD, BertagnollLMM. Surgical management of
advanced gastrointestinal stromal tumors after treatment with targeted
systemic therapy using kinase.inhib itors. J C.Jin Oncol 2006; 24:
2325-31
38. Tarn C, Skorobogatko YV,Taguchi T, Eisenberg B, vOlt 1\1ehren
1\1, Godwin AK. Therapeutic effect of imatinib in gastrointestinal
stromaltumors:AKT
signaling
dependent
and
independent
mechanisms. Cancer Res 2006; 66: 5477-86
39. Liu XH, Bai CG, Xie Q, FengF , Xu ZY, Ma DL. Prognostic value of
KIT mutation in gastrointestinal tumors. World JGastroenterol2005; 11:
3948-52
45
40. Koay MH, Goh YW,Iacopetta B,GrieuF, SegalA,Sterrett GF, Platten
M,
Spagnolo
DV.
Gastrointestinal
stromal
tumours(GISTs):
a
clinicopathological and molecular study of 66 cases. Pathology
2005;37: 22-3.1
41.
Hong
X,
Choi
H,
Loyer
EM,
BenjaminRS,TrentJC,
CharnsangaveiC. Gastrointestinal stromal tumour: role of CT in
diagnosis and in response evaluation and surveillance after tratment
with Imatinib. Radiographics2006; 26: 481-95.
42.
Stroszczynski
C,
JostD,
Reichardtp,ChmelikP,
Gaffke
G,Kretzschmar A, Schneider U, Felix R, Hohenberger P. Follow-up of
gastrointestinal stromal tumours (GIST) during treatment with Imatinib
mesylateby abdominal MRI..Eur Radio12005; 15: 2448-56.
43. Bucher P, Egger JF, GervazP, Ris F, Weintraub D, Villiger P,
Buhler
LH,
Morel
P.
An
audit
of
surgical
management
of.gastrointestinalstromal tumours (GIST). Eur J Surg Oncol 2006; 32:
310-4
44. Kosmadakis N, VisvardisEE, Tsimara M, Chatziantoniou A,
Panopoulos I, Erato p , Capsambelis P. The role otsurgeryjn the
management otgastrointestinarstromal tumors (GISTs) in the era of
imatinibmesy.late effectiveness.Surg Onco.l2005; 14: 75-84
45. Neuhaus SJ, Clark MA, Hayes AJ,Thomas JM,.Judson I. Surgery
for gastrointestinal stromal tumour in the post-imatinibera...ANZJSurg
2005;75: 165-72
46
46. Bumming P, Ahlman H, Andersson J,Meis-Kindblom JM, Nilsson B.
Population-based
study
of
the
diagnosis
and
treatment
gastrointestinal stromal tumours.Br J Surg 2006; 93: 836-43 .
47
of