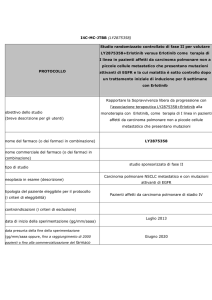
Riassunto del protocollo
1.
Studio di fase II su erlotinib e bevacizumab in pazienti con cancro del
polmone non a piccole cellule in stadio avanzato e mutazioni attivanti di
EGFR.
Razionale: in seguito al trattamento con erlotinib, i pazienti affetti da cancro del
polmone non a piccole cellule (NSCLC) in stadio avanzato con mutazioni (del19 o
L858R) del recettore del fattore di crescita epidermico (EGFR) mostrano
un’impressionante sopravvivenza libera da progressione (da 9 a 14 mesi). Tuttavia,
la presenza di mutazioni di EGFR può predire solo parzialmente l’esito. Noi
ipotizziamo che la sopravvivenza libera da progressione potrebbe essere
influenzata sia dal pretrattamento della mutazione T790M di EGFR sia da elementi
delle vie di riparazione del DNA.
Noi prospettiamo che un modello di trattamento in cui l’erlotinib venga associato al
bevacizumab possa far raggiungere ai pazienti con mutazioni di EGFR (singole o
con T790M) una PFS complessiva più lunga. Se i pazienti sono raggruppati per
livelli di mRNA di BRCA1 e T790M, si ipotizza che la combinazione di erlotinib più
bevacizumab possa migliorare la PFS in tutti i sottogruppi.
Scopi
1. Determinare l’esito a lungo termine di pazienti con diagnosi di NSCLC non
squamoso in stadio avanzato con mutazioni di EGFR, con o senza
mutazione T790M, trattati con la combinazione di erlotinib e bevacizumab.
Endpoint primario: sopravvivenza libera da progressione.
2. Valutare l’efficacia e la tollerabilità della combinazione.
3. Valutare la correlazione tra l’espressione dell’mRNA di BRCA1 e di AEG-1 e la
mutazione T790M con la sopravvivenza libera da progressione.
4. Monitorare le mutazioni di EGFR (inclusa T790M) nel siero longitudinalmente.
5. Valutare i biomarcatori molecolari correlati ai TKI di EGFR e al bevacizumab.
Disegno: studio di fase II, multinazionale e multicentrico volto alla valutazione di
erlotinib più bevacizumab in pazienti con NSCLC non squamoso in stadio avanzato
con mutazioni di EGFR confermate da rivalutazione centrale. I pazienti saranno
stratificati in due sottogruppi, con e senza mutazione T790M di EGFR. La
stratificazione sarà condotta dopo l’inclusione dei pazienti.
Dimensione del campione: 102 pazienti.
Criteri principali di eligibilità
1. Cancro del polmone non a piccole cellule non squamoso.
2. Malattia metastatica o localmente avanzata e non sottoponibile a chirurgia
radicale o radioterapia.
3. Mutazione di EFGR (exon del19 o L858R) confermata a livello centrale.
4. Malattia misurabile o valutabile (secondo i criteri RECIST 1.1).
BELIEF V1.1, 11 Nov 2011
1/2
5. Età ≥ 18 anni.
6. Funzionalità ematologica, renale ed epatica adeguate.
Trattamento in studio: Bevacizumab: infusione endovenosa di 15 mg/kg il 1°
giorno di ciascun ciclo di 3 settimane.
Erlotinib: 150 mg al giorno per via orale.
Cicli di 3 settimane fino alla progressione.
Considerazioni statistiche
Lo studio consiste di due sottostudi di fase II condotti in parallelo e rende
necessaria la partecipazione di 102 pazienti, di cui 35 con mutazione T790M di
EGFR da arruolare nel sottostudio 1 e 67 pazienti senza mutazione T790M di
EGFR da arruolare nel sottostudio 2. Il primo sottostudio segue il disegno di Simon
in due stadi, in cui una decisione può essere raggiunta nel primo stadio, mentre il
secondo sottostudio segue il disegno di Fleming a stadio unico. I pazienti senza
mutazione di EGFR alla visita centrale interromperanno il trattamento. Questi
pazienti saranno esclusi dall’analisi di efficacia finale e saranno documentati come
ineligibili. I pazienti ineligibili saranno sostituiti per raggiungere la dimensione del
campione complessiva secondo quanto previsto dal disegno dello studio. I pazienti
arruolati nello studio, ma che non sono valutabili per quanto riguarda l’efficacia,
saranno sostituiti (fino al 10% della dimensione del campione complessivo).
Durata: la durata totale dello studio sarà di circa 48 mesi, con un periodo di
arruolamento di 12 mesi comprendente il periodo di run-in di 3 mesi, con
arruolamento e follow-up totale di 36 mesi. Il database clinico e la banca dei tessuti
centrale saranno mantenuti per un tempo illimitato.
Lo studio terminerà con la preparazione della relazione finale, programmata per il
mese 54 dopo l’inclusione del primo paziente. I soggetti in studio riceveranno i
medicamenti in studio per un periodo massimo di 18 mesi dopo l’inclusione
dell’ultimo paziente. Tutti i pazienti che in quel momento continuano a beneficiare
del proprio trattamento saranno fatti passare al medicamento commerciale, che
sarà rimborsato da Roche.
Ricerca translazionale
Da tutti i pazienti arruolati saranno prelevati campioni tissutali, che verranno fissati
in formalina e inclusi in paraffina. Lo stato mutazionale di EGFR sarà determinato o
confermato a livello centrale. La mutazione T790M sarà analizzata non appena
sarà stato arruolato nello studio il campione di pazienti complessivo. Le espressioni
dell’mRNA di BRCA1 e di AEG-1 saranno valutate a condizione che sia disponibile
una sufficiente quantità di materiale tissutale.
I campioni di siero saranno raccolti al baseline, al momento della risposta
documentata e al momento della progressione. Questi campioni saranno usati per
individuare alterazioni molecolari rispecchianti il tessuto tumorale. I campioni
saranno conservati localmente a -80 °C e inviati in lotti al laboratorio centrale.
BELIEF V1.1, 11 Nov 2011
2/2