19/05/2014
ALDEIDI e CHETONI
Caratteristica strutturale di
aldeidi e chetoni
O sp2 legato a C sp2
C=O
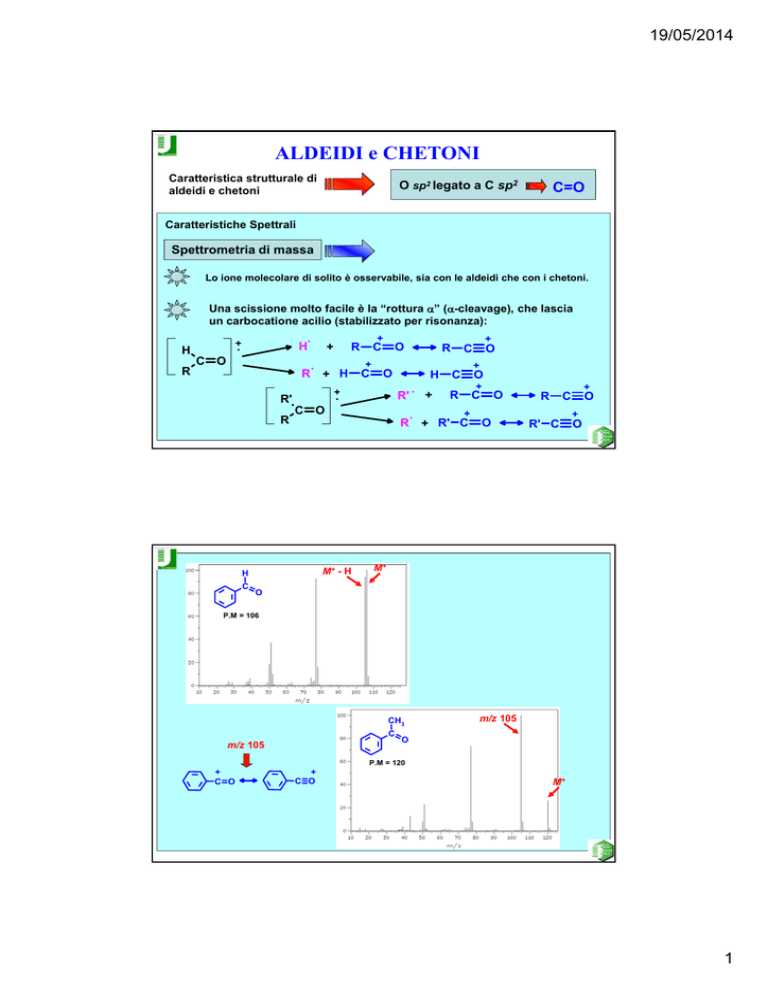
Caratteristiche Spettrali
Spettrometria di massa
Lo ione molecolare di solito è osservabile, sia con le aldeidi che con i chetoni.
Una scissione molto facile è la “rottura α” (α-cleavage), che lascia
un carbocatione acilio (stabilizzato per risonanza):
R
.
H
+.
H
C O
.
R + H
+
C
O
M+ - H
R
O
H
R'
C O
H
C
C
+.
R'
R
+
R
+
.
+
+
C
C
R
O
+
O
+
C
O
+
.
R + R' C O
R
+
C
R' C
O
+
O
M+
O
P.M = 106
CH3
C
m/z 105
m/z 105
O
P.M = 120
+
C O
+
C O
M+
1
19/05/2014
UV-visibile
due transizioni:
π → π* a λ = 190 nm (lontano UV) permessa dalla simmetria (ε> 10 000)
n → π* a λ = 280-290 nm proibita dalla simmetria (ε 15-20)
La transizione n → π* può non vedersi se la soluzione è diluita
La coniugazione con doppi legami sposta I massimi di assorbimento verso
lunghezze d’onda maggiori (shift batocromico)
O
IR
π → π* a λ = 231 nm (ε = 12 600 M-1cm-1)
n → π* a λ = 321 nm (ε =
40 M-1cm-1)
ALDEIDI
stretching C=O a circa 1725 cm-1, spostato verso valori più bassi
dalla coniugazione
stretching C-H (del –CHO)
deboli bande a 2750 e 2850 cm-1.
3-metilbutanale
benzencarbaldeide
2
19/05/2014
IR
CHETONI
stretching C=O
a circa 1715 cm-1, spostato verso valori più bassi
dalla coniugazione
3-pentanone
fenil metil chetone
13C
NMR
L’effetto -I dell’O ed il campo magnetico generato
dagli elettroni π diminuiscono la densità elettronica
attorno al nucleo del 13C: molto deschermato
δCO 205-185 ppm (aldeidi) 220-190 ppm (chetoni)
3-metilbutanale
CO
3-pentanone
CO
3
19/05/2014
1H
NMR
ALDEIDI
L’effetto -I dell’O ed il campo magnetico generato dagli elettroni π
diminuiscono la densità elettronica attorno al nucleo del 1H del CHO: molto
deschermato (9,5-10,5 δ)
CHO
benzencarbaldeide
3-metilbutanale
CHO
1H
NMR
CHETONI
L’effetto -I dell’O diminuisce la densità elettronica attorno al nucleo del 1H
sul C adiacente: deschermato da 2,0-2,5 (CH3) fino a 3 (CH2, CH) δ
3-pentanone
fenil metil chetone
4
19/05/2014
ALDEIDI e CHETONI
δ+
sp2
Nu:
δ-
C O
H
E+
C
H acido
ADDIZIONE NUCLEOFILA
Reazione caratteristica
Meccanismo:
1.
Nu:-
lento
C
O
sp2
(trigonale
planare)
C
Nu
E+
Nu
O-
C
O
E
sp3
(tetraedrico)
E+ = H+
generalmente
2.
O + H+
C
C
+
O H + :Nu
sp2 (trigonale
planare)
C
lento
+
C
+
O H
O H
Nu
C
O
H
sp3
(tetraedrico)
5
19/05/2014
Sono reazioni di equilibrio
Risentono dell'effetto sterico
Risentono degli effetti elettronici dei sostituenti
Sostituenti ad attrazione elettronica RENDONO PIU' POSITIVO il C carbonilico
FAVORISCONO l'attacco del nucleofilo
REATTIVITA' CRESCENTE
CHETONI < METILCHETONI < ALDEIDI < METANALE
a. NUCLEOFILI ALL'OSSIGENO
H2O
OH
O
R
C
H +
R
H 2O
C
aldeide idrata
OH
O
R
C OH
H
R +
R
H 2O
C OH
R
chetone idrato
Meccanismo:
:O
C
O
+
H
H
+
lento
OH2
OH
C
C
O-
OH
6
19/05/2014
ROH
Meccanismo:
:O
C
R
H
+
+
lento R OH
C
O
OR
OH
O-
esempi:
H3C
H
C
H3C
+ CH3CH2OH
C
CH3
O CH2 CH3
C
H
O
H3C
EMIACETALE
C
OH
H3C
+ CH3CH2OH
C
H3C
O
O CH2 CH3
OH
La reazione può avvenire anche in modo intramolecolare:
O
O
H2C
HO CH2 CH2 CH2 C H
H
C
H2C
CH2
OH
Se la reazione con alcool si fa in ambiente ACIDO ANIDRO, prosegue:
O
C H + 2 R'OH
R
OR'
H+(*)
R C OR'
+ H2O
H
(*) HCl (gas)
O
R
C R" + 2 R'OH
ACETALE
OR'
H+(*)
R C OR' + H2O
R"
ACETALE (CHETALE)
(*) HCl (gas)
Meccanismo:
R
C
O
H
+ R' O H
OR'
R
C
H
OH
come già
descritto
7
19/05/2014
OR'
R
..
H+
OR'
C +
H
O H
H
R
C
H
R
OH
OR'
C +
H
O R'
H
C
H
..
HO
+
C OR'
R'
H
H
OR'
R
R
+
OR'
C
H2O +
R
+ H+
OR'
Con I chetoni (meno reattivi delle aldeidi) l’equilibrio è spostato verso sinistra
H3C
C
CH3
H+
H3 C
+ 2 CH3CH2OH
C
H3 C
O
O CH2 CH3
O CH2 CH3
I chetoni danno chetali con equilibrio spostato verso destra solo se il nucleofilo è un
diolo (1,2- o 1,3-): la reazione è intramolecolare e si forma un anello stabile
H3 C
C O
H3C
HO
H3C
C
H3C
C
H3C
CH2 OH
H 3C
H3C
C
O CH2
CH2
KMnO4
CH OH
CH2 OH
OH
C
H3 C
O CH2
CH2 OH
HO
H3C
O CH2
H3C
H3C
C+
H3C
CH2 OH
H
O
+ CH2
Esempio di applicazione:
CH
+
OH2
H3C
H+
O CH2
H3 C
O
C +
O CH2
H3 C
H
CH2 OH
CH2
OH
-
H3C
..
HO CH2
CH2
O CH2
O
CH2
C
+ H+
O CH2
H
O
O
C
C
come ottenere CH OH da
CH
CH2
CH2 OH
H
H
però, con KMnO4:
C
O KMnO4
HO
?
C
O
8
19/05/2014
H
O
+
C
HO CH2 H
CH +
HO CH2
CH2
O
CH2 CH CH
OH OH
O
O
CH2
CH2
CH CH
CH2
O
CH2 H2O, H+
CH2
KMnO4
OH-
O
CH2 OH
CH2 CH CH +
CH2 OH
OH OH
b. NUCLEOFILI ALLO ZOLFO
RSH
R
:S
C
H
+
lento
+
R SH
SR
C
C
O
EMITIOACETALE
OH
O-
esempi:
H3 C
H
C
+
H3 C
CH3CH2SH
H
O
H3 C
C
C
CH3
H 3C
+ CH3CH2SH
H3 C
O
S CH2 CH3
OH
C
S CH2 CH3
OH
Se la reazione con si fa in ambiente ACIDO ANIDRO, prosegue:
H+ anidro
C
C
+ 2 CH3CH2SH
S CH2 CH3
TIOACETALE
S CH2 CH3
O
Con ditioli la reazione è intramolecolare quando si possono formare anelli
stabili (5 e 6 termini).grado di
R
C O
..
HS
CH2
HS
CH2
CH2
R
R
-
O
C +
S CH2
R
H CH
2
CH2 SH
SH
R
OH
C
R
S
CH2
CH2 CH2
9
19/05/2014
H+
+
OH2
R
C
R
H
R
C
R
S
+
R
CH2
R
S
CH2
CH2
C
CH2
+ H+
S CH2
TIOACETALE (TIOCHETALE)
CH2
solo con aldeidi
-O
: S OH
C
-O
H
CH2
S CH2
Reazione di Bertagnini
+
C
C+
R
O
O
HS
R
CH2
CH2 CH2
CH2
S
NaHSO3
S
SH
O
OH O
S OH
C
S O-
H
O
H O
reazione acido-base
Serve per purificare le aldeidi: l’addotto precipita, si filtra, si torna ad aldeide
c. NUCLEOFILI ALL’AZOTO
con i nucleofili all'azoto i prodotti di addizione perdono una molecola diacqua
ammoniaca ed ammine primarie
O
R
C
+ :NH3
H
H+
NH3, RNH2
OH
R CH
NH + H2O
IMMINA
R CH
NH2
(base di Schiff)
O
R
+
C
H
..
R'NH2
H+
OH
R CH
NH R'
R CH N R' + H2O
IMMINA
(base di Schiff)
Meccanismo:
C O + H+
veloce
+
C OH
+
C OH
10
19/05/2014
..
+
C OH + H2N R
OH veloce
C +
NH2
lento
+
OH2
C
R
veloce
+
C NH R
..
NH
R
veloce
N
C
R
H+
H2O
5÷6
La velocità della reazione dipende dal pH
k
la velocità massima si ha a pH 5÷6
NH2 + H+
R
O
R
+ H+
C
+
NH3
+O H
O
C
C
+
pH
H
a pH troppo acido manca il nucleofilo
a pH non abbastanza acido, la concentrazione di composto carbonilico protonato è
troppo bassa
R2NH
ammine secondarie
O
+
C
H2C
R'
H
OH
H+
..
R2NH
R' CH2 CH
R' CH CH NR2 + H2O
ENAMMINA
NR2
Meccanismo:
veloce
+ H+
C O
CH2
+
C OH
CH2
+
C OH
.. R
HN
R
lento
+
OH2
veloce
C
H
CH
NH
R
CH CH N
Esempi:
H+
O
CH3 C
+
CH3
H N
R
R
OH
C +
NHR2
CH2
+ H2 O + H+
H
CH2
H2O C
CH3
CH2
C
N
H2O, H+
N
CH3
11
19/05/2014
H
O
CH3
CH2 CH N
CH3
OH
+ (CH3)2NH
CH3 C
H
+
R3 N
O
+
R3 N C
C
NESSUNA REAZIONE
H+
veloce
+ OH
H OH
:N
..
H2N OH
OH
lento
H + OH
N
C
+ OH
IDROSSILAMMINA
+
C
C
O
H2N-X
..
H2N OH
X = OH
H
+
H N OH
C
OH
OH
N
C
2
CH3
-
derivati dell'ammoniaca
C
H2O
CH3
R3N
ammine terziarie
O
CH2 CH N
OSSIMA
C
H2 O
Esempio:
O
C
H+
H
OH
CH N OH
CH NH OH
+ H2N OH
H2O
O
CH3 CH2 C CH3 + H2N OH
H+
ossima della
benzencarbaldeide
OH
CH3 CH2 C NH OH
CH3
CH3 CH2 C N OH
CH3
H2O
ossima del
butanone
12
19/05/2014
.. ..
H2N NH2
X = NH2
H+
O
veloce
N
C
+ OH
OH
2
H2O
NH2
IDRAZONE
C
H+
H NH
2
:N
C
lento
H + NH
2
N
C
H
+
H N NH2
..
H2N NH2
+
C
OH
C
+ OH
C
IDRAZINA
Esempio:
O
C H + H2N NH2
CH
CH3
2
H+
OH
CH3 CH2 CH N NH2
CH3 CH2 CH NH NH2
idrazone del propanale
H2O
X = NH-C6H5
Nu
H+
C
C
O
veloce
+ OH
H NH
:N
C
+ OH
2
.. ..
H2N NH
+
C
OH
H + NH
N
H2O
C
FENILIDRAZINA
..
H2N NH
lento
H
+
H N NH
C
OH
NH
N
H+
C
FENILIDRAZONE
13
19/05/2014
Esempio:
.. ..
H2N NH
O
C
CH N NH
+
CH3
H 2O
fenilidrazone del
fenil metil chetone
H2N NH
O
+
CH3CH2CH2 C H
CH3CH2 CH2 CH N NH
fenilidrazone del
butanale
H 2O
Nu
.. ..
H2N NH
NO2
2,4-DINITROFENILIDRAZINA
NO2
NO2
.. ..
H2N NH
C
NO2
H+
NH
NO2
N
+
O
C
NO2
2,4-DINITROFENILIDRAZONE
Esempio:
O
H2N NH
NO2
CH3 C CH3 +
H+
H3 C
C
N
NH
H3 C
NO2
NO2
H2 O
NO2
2,4-difenilfenilidrazone
del del propanone
14
19/05/2014
O
..
H2N C
..
NH NH2
X = CONHNH2
SEMICARBAZIDE
Nu
O
O
..
+ HN C
..
2
NH NH2 H O
2
C
O
N
NH C
NH2
C
SEMICARBAZONE
d. NUCLEOFILI AL CARBONIO
HCN
OH
R C H
O
R
+ HCN
C
H
C N
cianidrina
OH
O
R
C
+ HCN
R'
R C R'
C N
cianidrina
meccanismo:
O
C
+
-: C
lento
N:
..
:O:C C N:
H+
..
:OH
C C N:
15
19/05/2014
Addizione di carbanioni (composti organometallici)
RMgX
O
δ-
+
δ+ C
O - +MgX
C
δ- δ+
RMgX
OH
H2O
(H+)
R
C
+ Mg(OH)X
R
Esempi:
H
OMgBr
MgBr
O
H
O
H3C
OMgI
C
H
+ CH3MgI
H 3C
OH
H2 O
CH
H 3C
CH3
OMgI
O
H3 C
CH2 OH
H2 O
CH2
+
C
C
CH3
+ CH3CH2MgI
H3 C
C CH2CH3
CH
CH3
H 2O
CH3
OH
H3 C
C CH2CH3
CH3
RLi
δ-
O
δ+ C
+
δ- δ+
OLi
RLi
C
R
esempio:
O
Li
CH3 CH C H +
CH3
FOSFORANO
OLi
CH3 CH CH
CH3
OH
H2O
(H+)
C
+ Li(OH)
R
H2O
OH
CH3 CH CH
CH3
REAZIONE DI WITTIG
alogenoalcano + trifenilfosfina +
base forte + composto carbonilico
ALCHENE
16
19/05/2014
1. Sostituzione nucleofila
SN 2
..
P
R CH2 Br +
R CH2
+
P
Brsale di FOSFONIO
(bromuro di alchiltrifenilfosfonio)
2. Reazione acido-base
+
R CH2 P(C6H5)3
..- +
R CH P(C6H5)3
base
Nu:
BASE
R CH P(C6H5)3
FOSFORANO o ILIDE (yilide)
butillitio (CH3CH2CH2CH2Li) oppure idruro di sodio (NaH)
IL FOSFORO PUO' ESPANDERE L'OTTETTO: stabilizza il carbanione
3. Addizione nucleofila
..- +
R CH P(C6H5)3
O
R CH P(C6H5)3
+
C
R"
R'
R" C
BETAINA
o
FOSFETANO
O
R'
R CH
R" C
+
R'
"driving force“
(forza trainante)
Esempio:
P(C6H5)3
fosfinossido
O
Il legame P-O è più forte del legame P-C
O
1. :PPh3
CH3 CH2 CH2 Br + CH3 CH
CH3 CH2 CH2 Br + :PPh3
O
+
..CH3 CH2 CH PPh3 + CH3 CH
2. NaH
CH3 CH CH CH2 CH3
+
..NaH
+
CH3 CH2 CH PPh3
CH3 CH2 CH2 PPh3
H2
O
PPh3
CH3 CH CH CH2 CH3
CH3 CH CH CH2 CH3
O=PPh3
17
19/05/2014
Esempio:
O
CH3 CH2 CH2Br +
..- +
CH3 CH2 CH PPh3 +
1. :PPh3
C
2. C4H9Li
CH3
O
O
C
CH3 C
CH3
CH3
CH3 CH2 CH C
PPh3
CH3 CH2 CH
CH CH2 CH3
CH3
C
CONDENSAZIONE ALDOLICA
2
H3C
O
C
10% NaOH in H2O
H
O
OH
H3C CH CH2 C
H
ALDOLO
meccanismo:
genera il nucleofilo
1. reazione acido-base
HO- +
O
α
H CH2 C
H
HO H + -CH2 C
O-
O
CH2 C
H
H
2. addizione nucleofila
O
CH3 C
H
O
CH2 C
H
O
OH3C CH CH2 C
H
3. reazione acido-base
O
O+ HO H
H3C CH CH2 C
H
O
OH
H3C CH CH2 C
H
+ HOla sua
concentrazione
non cambia
18
19/05/2014
l'aldolo, sottoposto a riscaldamento, perde una molecola di acqua
O
Δ
O
OH
CH
C
H3C CH
2
H
H3C CH CH C
H 2O
H
doppio legame coniugato
perché la condensazione aldolica possa avvenire, è necessario che
l'aldeide abbia almeno un H in α al carbonile
O
per esempio:
CH3 O
H3C C CH
O
CH
H
CH
non reagiscono
CH3
aldeidi con più C dell'etanale, comunque danno il carbanione
in α al carbonile
HO-
H
+
O
CH3CH C
H
O
-
CH3 CH C
α
H
O
δ-
CH3 CH2 C δ+
H
-
O
+ CH3 CH C
H
OO
+ H2O
CH3 CH2 CH CH C
H
CH3
OCH3 CH C
H
+ H2O
OO
CH3 CH2 CH CH C
H
CH3
OH
O
+ HOCH3 CH2 CH CH C
H
CH3
CONDENSAZIONE ALDOLICA MISTA
La reazione con due aldeidi, entrambe con H in α, dà una miscela di prodotti
O
CH3 C
H
+
O
CH3 CH2 C
H
HO-
O
CH2 C
H
O
CH3 CH C
H
+ H2O
19
19/05/2014
O
OH
OH
O
OH
O
+ CH3 CH2 CH CH C
+ H C CH CH C
H3C CH CH2 C
3
H
H
H
CH3
CH3
OH
O
+ CH3 CH2 CH CH2 C
H
HO H
la condensazione aldolica mista (o incrociata) diventa utile quando
una sola delle aldeidi ha un H in α (precursore del nucleofilo).
O
C
O
C
H
HO-
O
CH3 C
H
+
nucleofilo
O-
O
CH CH2 C
H
O
CH2 C
H
H
O
CH2 C
H
H2O
OH
O
CH CH2 C
H
+ HO-
H
C
OH
O
CH CH2 C
H
O
CH C
H
+ H2O
la coniugazione con l'anello
benzenico facilita la disidratazione
ATTENZIONE!
la condensazione aldolica in ambiente basico con i chetoni
non avviene
equilibrio spostato a sinistra
O
2
C
CH3
O
OH
H3C C CH2 C
CH3
CH3
CH3
i chetoni possono essere utilizzati come fonti di carbanioni in condensazioni
miste con aldeidi senza H in α
REAZIONE DI CLAISEN-SCHMIDT
O
C
O
H
+
C
CH3
O
-OH
CH3
C
CH3
CH2
nucleofilo
20
19/05/2014
meccanismo:
OO
C
O
CH
C
2
H +
CH3
O
CH CH2 C
H
C
spontanea
OH
O
CH CH2 C
CH3
H2O
CH3
O
CH C
CH3
+ H2 O
la coniugazione con l'anello
benzenico facilita la disidratazione
esempio:
O
O
C
H
+
C
CH3
H
-OH
-O
O
CH2 CH2 C CH3
CH3
H2O
O
CH2 CH2 C CH3
OH
In questo caso, per avere disidratazione occorre SCALDARE (meglio se in ambiente acido)
O
Δ
CH2 CH2 C CH3
O
CH2 CH C CH3
H+ + OH H
2
OH
O
CH2 CH C CH3 + H2O
REAZIONE DI CANNIZZARO
Le aldeidi SENZA H in α al carbonile possono reagire con NaOH, in condizioni
più drastiche di quelle della condensazione aldolica (concentrazione più
elevata di base, temperatura elevata)
O
2
C
H
-OH
H
Δ
O
+
C CH3OH
H
O
Reazione di disproporzione
(un -CHO si ossida e un altro di riduce)
meccanismo:
1. attacco nucleofilo al C carbonilico
O δC
H δ+ H
O+
-OH
Cannizzaro (1826-1910)
H C H
OH
Questo EQUILIBRIO si ha anche nel caso della condensazione aldolica, ma in
quel caso c’è un’altra strada (attraverso la base coniugata) che porta a
prodotti e quindi questo equiibrio è come se non ci fosse.
21
19/05/2014
2. trasferimento di idruro (H con gli elettroni di legame)
C
H
δ-
O-
O
H
H C H
OH
H
3. reazione acido-base
=/
δ-
OH
O
OH C H + C H
OH
H
O
C H
CH3OH + HCO2-
O
O
C
H
C H
H
O+
H C H
OH
H
Danno la reazione di Cannizzaro tutte le aldeidi SENZA H ACIDI
Di solito gli H acidi sono in α al carbonile, ma NON NECESSARIAMENTE
esempio:
O
C
-OH
CH2OH
H
H
C
ma:
O
C
+
O-
O
-OH
?
H acido!
CH3
H
C
H
O
H
O
C
-OH
C
H
O
C
O
H
C
O-
ecc.
- CH
CH3
CH2
2
CH2
Nucleofilo
H
C
H
C
+ H2O
CH2
condensazione aldolica
O
O
O
-
H
C
H C CH2
H2O
O
- CH2
CH3
CH3
OH
H C CH2
HC CH
C
O
CH3
H
H
C
O
H2O
CH3
22
19/05/2014
TAUTOMERIA
C
C
O
H
C
O
C
H
L'equilibrio tautomerico è catalizzato da acidi e da basi
meccanismo in ambiente basico:
O
C
H
C
+ OH
O
O
..C
C
HO
C
C
+ H2O
C
enolo
ione enolato
reazione acido-base
C
reazione acido-base
l'equilibrio è spostato verso la forma carbonilica
O
OH
C
C
CH2
H 3C
0.01%
CH3 CH3
99.99%
OH
O
C
CH3
H
99.90%
C
H
CH2
0.10%
OH
O
H
H
H
0.06%
99.4%
l'equilibrio è spostato verso la forma enolica se ci sono fattori particolari che la
stabilizzano
O
C
CH3
O
CH2
C
O
C
CH3
CH3
20%
..H
....
O
O
C
C
CH3
CH3 CH
OH
C
CH3
CH
80%
stabilizzazione per
legame idrogeno
meccanismo in ambiente acido:
O
C
H
C
+
H3O+ H O
reazione acido-base
C
H
C
H O
+C
H
C
HO
:OH2
C
C
reazione acido-base
23
19/05/2014
Un C chirale in α al carbonile in ambiente acido o basico racemizza
H
H
O
H
*
OH
H+
H
CH3
CH3
O
H
H
O
H
CH3
CH3 + H
*
*
oppure
-OH
(S)
(S)
H
(R)
Ricapitolando:
R
R
R
H
-OH = B
R
H
H
HO
H
R
H
H
H
H
O
H
H
O
O
R
OH
R
H
H
R
MA QUANDO UNEQUILIBRIO E’
SPOSTATO VERSO I PRODOTTI,
GLI ALTRI TORNANO INDIETRO:
E’ COME SE NON CI FOSSERO
+
O-
O
H2O + R H
H
- OH
-OH
H acidi
HO O-
H
+
H
H
-OH = Nu
HO OH
C elettrofilo
O
Tutti gli equilibri
COESISTONO
H
-O R
H2O
H
R
H
H
H
H
H
RIDUZIONE
OH
R CH R
H2, cat.
OH
O
R
C
idruro
R
R CH R
(a) oppure (b)
[H] NH3
R
CH2 R
NH2
R
idruro = NaBH4, LiAlH4
(a) Zn(Hg), HCl
Clemmensen
(b) NH2NH2, OH-, Δ
Wolff-Kischner
CH R
24
19/05/2014
meccanismi:
O
O
H BH3
C
BH3
..
+ H2 N
C
C
H
ADDIZIONE NUCLEOFILA
NH2
O
OH
H+
H2O
C
H
..
H2N
Nu: = H-
ADDIZIONE NUCLEOFILA
NaBH4
NH2
C N
-OH
NH2
N
Δ
H2O
..
NH3
Nu: = H2N-NH2
ADDIZIONE NUCLEOFILA
O
C
+
..
NH3
CH
Ni
H2O
+
CH2
Nu: = :NH3
H2
C NH
N
NH2
idrogenazione catalitica
OSSIDAZIONE
O
R
R
H
O
R
O
[O]
C
C
[O]
C
tutti gli ossidanti già visti con gli
alcooli
OH
[O]
NESSUNA REAZIONE
R'
O
Saggio di Tollens O
R
C
+ Ag(NH3)2OH
R
H
C
O
+ Ag°
specchio
d'argento
gli α-idrossichetoni possono
dare un saggio positivo:
R CH C R'
OH O
[-2H]
Ag(NH3)2OH
Gottfried Tollens
R C
O
C R'
O
+ Ag°
25
19/05/2014
REAZIONI IN CATENA LATERALE
α-ALOGENAZIONE
I chetoni vengono alogenati in α al carbonile. La reazione è promossa da
basi oppure acido-catalizzata (Le aldeidi vengono ossidate dagli alogeni).
promossa da basi:
O
H3C
C
CH3
O
O
+ Br2 + -OH
C
H3C
CH2 Br
O
+ Br2 + -OH
+ Br- + H2O
+ Br- + H2O
Br
la base si consuma
acido-catalizzata
O
O
H3C
O
C
CH3
+ Br2
H3C
O
C
CH2 Br
+ Br- + H+
+ Br- + H+
+ Br2
Br
l'acido non si consuma
La velocità dell'α-alogenazione (sia in ambiente basico che in ambiente acido)
NON dipende dalla concentrazione di alogeno.
meccanismo della reazione promossa da basi:
O
H3C
C
CH3
+ -OH
O
C CH2
H3C
O-
O
lento
H3C
C CH2
H3C
C
CH2
+ H2O
O
Br Br
H3C
C
CH2 Br
+ Br-
26
19/05/2014
meccanismo della reazione acido catalizzata:
O
H3C
C
+O
+
CH3 + H
H3C
C
H
CH3
+OH
H3C
C
OH
lento
CH2
H3C
+ H+
C
CH2
H
H3C
C
+ OH
:OH
OH
Br Br
+
H3C C CH2 Br
+
CH2
O
H3C C CH2 Br
+ OH
H3C C CH2 Br
Con i metilchetoni
H3C C CH2 Br
reazione dell'aloformio
con eccesso di alogeno e NaOH in acqua
O
C
CH3
O
-OH, H O
2
+ I2
C
O-
+ CHI3
iodoformio
meccanismo:
O
R
O
R
C
C
O
R
C
R
I I
C CH I
R
R
C
C CI2
CH2 I
CH I
I
O
R
C
Acidità maggiore di
quella del metile
O
O
-OH
CHI2
O
C CH2
R
CH3
-OH
CH2 I
O
-OH
solido
giallo
O
R
C
CI3
3 atomi di iodio
(elettronegativi)
27
19/05/2014
O
R
C
O+ -OH
O
R C CI3
CI3
R C
OH
+
OH
O
:CI3
R C
O-
+ CHI3
Si separa; giallo
ATTENZIONE!!! Ci possono essere “falsi positivi”
I2
ossidante
anche composti diversi dai metilchetoni possono dare lo iodoformio (falsi
positivi) se la molecola può essere ossidata dallo iodio a metilchetone
CH3 CH2 OH
CH3 CH CH3
O
I2
I2
CH3 C H
I2
-OH
CH3 C CH3
O
OH
O
O C H
I2
-OH
+ CHI3
O
H C O- + CHI3
COMPOSTI CARBONILICO α,β-INSATURI
centro nucleofilo
O-
O
CH2 CH CH
CH2 CH CH
+
O
CH2 CH CH
+
centro elettrofilo
Con reagenti elettrofili
O
Addizione 1,2 e 1,4
+
OH
H+
OH
CH2 CH CH
+
Addizione 1,2
CH2 CH CH
CH2 CH CH
O
CH2 CH CH
+ HCl
CH2
OH
CH CH Cl
OH
+
CH2 CH CH
Addizione 1,4
OH
Cl CH2 CH CH
O
Cl CH2 CH2 CH
28
19/05/2014
Con reagenti nucleofili
Addizione 1,2 e 1,4
O
HCN
CH C CH3 + C N
CH2
CH2
OH
CH C CH3
C N
+
O
CH2CH2 C CH3
C N
meccanismo:
1,4
O
CH C CH3
CH2
C N
HCN
1,2
CH2
-O
O
CH2 CH C CH3
C N
O
CH2CH2 C CH3
C N
OH
C N + CH2 CH C CH3
C N
O-
O
CH C CH3
C N
CH2 CH C CH3
C N
OH
CH2 CH C CH3 + -CN
C N
HCN
CH2 CH C CH3
C N
con nucleofili basi più forti è preferita l'addizione 1,2 (al C=O)
O
CH2 CH C CH3 + CH3MgI
OH
OMgBr
CH2 CH C CH3
CH3
CH2 CH C CH3
CH3
con nucleofili basi più deboli è preferita l'addizione 1,4
CH2
O
O
CH C CH3 + HCN
N C CH2 CH2 C CH3
RIDUZIONE di composti carbonilici contenenti C=C
il prodotto dipende dal catalizzatore e dalle
condizioni di reazione
O
si riduce C=C
CH
CH
CH
CH
CH
H , Ni
CH3 CH
O
CH CH2 CH
2
25°C
H2, Ni, Δ
3
2
2
2
OH
CH3 CH2 CH2 CH2 CH2
si riducono entrambi
1. NaBH4
2. H2O
OH
CH3CH CH CH2 CH2
si riduce C=O
29
CHIMICA ORGANICA I
Corso di laurea in CHIMICA, CHIMICA APPLICATA, SCIENZA DEI MATERIALI
Esercitazione n. 16 - Reazioni e meccanismi di aldeidi e chetoni.
TERMINI ED ARGOMENTI PER LO SVOLGIMENTO DEGLI ESERCIZI DI QUESTO FOGLIO: Meccanismo
generale dell'addizione nucleofila. Addizione di HCN. Addizione di acqua. Addizione di alcooli (formazione di
emiacetali e di acetali). Formazione di immine ed enammine. Addizione dei derivati dell'ammoniaca (idrossilammina,
idrazina, fenilidrazina, 2,4-dinitrofenilidrazina, semicarbazide). Reazione con i reattivi di Grignard ed i composti
litioorganici. Reazione di Wittig. Condensazione aldolica, aldolica incrociata, condensazione di Claisen-Schmidt.
Reazione di Cannizzaro. Reazione di ossidazione, reattivo di Tollens. Reazioni di riduzione: con idrogeno e
catalizzatore, con idruri, di Clemmensen, di Wolff-Kishner. Tautomeria. α-Alogenazione (promossa da basi ed acidocatalizzata); reazione dell'aloformio. Reazioni dei composti α,β-insaturi.
1. Dare la definizione ed un esempio per ciascuno dei seguenti termini: a) chetone; b) aldeide; c)
forma enolica; d) ione enolato; e) tautomeria; f) tautomero; g) idrogeno enolizzabile; h) cianidrina; i)
immina; j) ossima; k) fenilidrazone; l) enammina; m) acetale; n) emiacetale; o) 1,3-ditiano (= 1,3ditiacicloesano); p) saggio di Tollens; q) riduzione di Wolff-Kishner; r) riduzione di Clemmensen.
PER RICORDARE LE REAZIONI
2. Completare le equazioni chimiche per le reazioni del propanale con ciascuno dei seguenti
reagenti: a) NaBH4 (e poi H2O); bromuro di fenilmagnesio e poi acqua e HBr; c) OH-, H2O; d) 1,2etandiolo, in ambiente acido; e) bromo, in acido acetico; f) idrossilammina; g) fenilidrazina; h)
dietilammina; i) KMnO4, OH-; j) con piperidina (= azacicloesano); k) con pirrolidina (=
azaciclopentano).
3. Scrivere i prodotti che si ottengono per ciascuna delle seguenti reazioni della p-metilbenzencarbaldeide: a) con aldeide acetica (= etanale), in ambiente basico; b) con NaOH concentrata; c) con
KMnO4, a freddo; d) con KMnO4, a caldo; e) con etanammina.
4. Completare le seguenti reazioni del cicloesanone, specificando i nomi dei composti organici che si
ottengono: a) con 2,2-dimetil-1,3-propandiolo, in ambiente acido; b) con idrossilammina; c) con 1,2etandiolo, in ambiente acido; d) con LiAlH4 e poi acqua e acido.
5. Scrivere i prodotti che si ottengono da ciascuna delle seguenti reazioni dell'acetofenone (=
feniletanone): a) con cloro (in eccesso), in ambiente basico; b) con NaBH4, e poi acqua; c) con
HNO3 e H2SO4; d) con idrazina; e) con idrazina, in ambiente basico, a caldo; f) con bromuro di
fenilmagnesio, e poi acqua e HBr; g) con iodio, in ambiente basico; h) con Zn(Hg) e HCl.
6. Scrivere i prodotti delle reazioni del ciclopentanone con: a) bromo in acido acetico; b) NaBH4 e
successiva idrolisi; c) fenilidrazina; d) bromuro di isopropilmagnesio e poi acqua, H+; e) idrazina, in
ambiente basico a caldo.
7. Completare le seguenti reazioni, specificando i nomi dei composti organici che si formano: a)
cicloesancarbaldeide + HCN; b) ciclopentanone + NaCN + H2SO4; c) aldeide benzoica +
metanammina; d) ciclopentanone + anilina; e) ciclopentanone + piperidina (= azacicloesano); f) 4metil-3-penten-2-one + metanammina.
8. Per ciascuno dei seguenti composti indicare il gruppo funzionale e scrivere la reazione di idrolisi
completa.
HO
O CH2 CH3
a)
O
b)
CH3 CH2 C
O
O
d)
CH O CH3
CH3
O
c)
CH3
O
CH3
e)
CH3
HO
O
f)
HO
OH
OH
g)
O
N
O
N
h)
N
OH
9. Scrivere le reazioni per la formazione di emiacetali in soluzione acquosa di: a) 5-idrossi-2esanone; b) 1,3,4,5,6-pentaidrossi-2-esanone; c) 5-idrossipentanale; d) 2,4-diidrossipentanale. c)
Scrivere l'equazione chimica ed il meccanismo per la formazione di acetali con metanolo, a partire
dagli emiacetali precedenti.
10. Scrivere le reazioni del cicloesanone con i seguenti reagenti: a) metanammina, in ambiente acido;
b) metanolo, in ambiente acido anidro; c) idrossilammina, in ambiente acido; d) 1,2-etandiolo, in
ambiente acido; e) fenilidrazina, in ambiente acido; f) bromuro di fenilmagnesio, e poi acqua acida;
g) reattivo di Tollens; d) acetiluro di sodio e poi acqua acida; i) cianuro di sodio e poi acqua acida; j)
idrazina e poi KOH, a caldo.
11. Scrivere le reazioni della cicloesancarbaldeide con i seguenti reagenti: a) bromuro di
fenilmagnesio, e poi acqua acida; b) reattivo di Tollens; c) etanolo, in ambiente acido anidro; d) 1,3propanditiolo, in ambiente acido anidro; e) amalgama di zinco in HCl acquoso; f) fenilidrazina, in
ambiente acido.
12. Scrivere tutti i passaggi della reazione di Wittig servendosi di: a) trifenilfosfina, 1bromopropano, butillitio, benzaldeide; b) trifenilfosfina, 2-iodopropano, idruro di sodio, propanale.
13. Le seguenti reazioni sono usate per l'identificazione e l'analisi di aldeidi e chetoni. Scrivere le
reazioni corrispondenti: a) butanone + 2,4-dinitrofenilidrazina; b) benzaldeide + reattivo di Tollens;
c) cicloesanone + Br2, OH-.
14. Completare le seguenti reazioni: a) propanone + NH3, H2, Ni; b) propanale, H2, Pt; c)
cicloesancarbaldeide + KMnO4.
15. Scrivere i prodotti (specificandone il nome) delle seguenti reazioni: a) ciclopentanone + NaBH4 e
successiva idrolisi; b) benzaldeide + NaCN, HCl; c) pentanale + NaOH, H2O; d) 4-esenale +
metanolo e HCl anidro; d) 1,3-diossaciclopentano + H2O, H+ (ATTENZIONE: il gruppo funzionale
è del tipo C(OR)2 !).
16. Completare la seguente serie di reazioni: benzene + CH3CH2COCl + AlCl3 → A; A + NH2NH2,
OH-, a caldo → B; B + KMnO4, a caldo → C.
PER CAPIRE LE REAZIONI (MECCANISMI)
17. a) Scrivere il meccanismo della reazione tra idrossilammina ed un composto carbonilico. b)
Prevedere, spiegando, l'ordine di reattività delle seguenti aldeidi nei confronti dell'idrossilammina:
benzaldeide, p-nitrobenzaldeide, m-nitrobenzaldeide.
18. a) Mettere i seguenti composti in ordine di reattività nei confronti della reazione con idrazina
(spiegare): benzaldeide, p-metilbenzaldeide, p-metossibenzaldeide. b) Mettere i seguenti composti in
ordine di reattività nei confronti della reazione con 2,4-dinitrofenilidrazina: 2-pentanone, 3pentanone, 3-cloro-2-pentanone, pentanale (spiegare).
19. a) Scrivere l'equazione chimica ed il meccanismo della reazione che avviene tra etanale e
metanolo, in presenza di acidi. b) Spiegare come varia la reattività se con metanolo si fa reagire
l'aldeide tricloroacetica.
20. a) Scrivere il meccanismo dell'idratazione di un composto carbonilico; b) mettere i seguenti
composti carbonilici secondo l'ordine decrescente delle loro costanti di equilibrio di idratazione:
CH3COCH2Cl, ClCH2CHO, CH2O, CH3COCH3, CH3CHO. (Spiegare).
21. a) L'1-fenil-2-propanone può dare due enoli diversi. a) Scrivere le strutture degli enoli. b)
Prevedere quale sarà presente all'equilibrio in quantità maggiore. c) Scrivere il meccanismo di
formazione dell'enolo in uno dei due casi.
22. Il 3-fenil-2-butanone potrebbe formare due enoli, ma in realtà ne forma uno solo. Quale?
Spiegare. b) Che cosa succede quando l'(R)-3-fenil-2-butanone si scioglie in soluzione acquosa acida
o basica? [suggerimento: tautomeria...]
23. Quando l'(R)-3-fenil-2-butanone si scioglie in etanolo acquoso contenente NaOH o HCl, il potere
rotatorio della soluzione diminuisce lentamente, fino a diventare zero. Evaporando il solvente, si
ottiene una miscela racemica di (R) e (S)-3-fenil-2-butanone. Spiegare e scrivere gli equilibri
corrispondenti.
24. Il 4-idrossibutanale esiste in soluzione essenzialmente in forma ciclica. a) Che tipo di composto
è? b) Scrivere l'equilibrio tra la forma aperta e la forma ciclica. c) Scrivere il meccanismo relativo
alla ciclizzazione.
25. a) L'1,1-dietossietano si idrolizza facilmente in acqua contenente un po' di acido solforico;
scrivere i prodotti di reazione ed il meccanismo. b) Un acetale si può formare in soluzione acida, ma
non in soluzione basica. Perché? c) L'etossicicloesano non dà reazione con HCl diluito, mentre l'1,1dietossicicloesano sì. Spiegare.
26. Nel tentativo di ottenere l'(R)-3-bromo-2-butanone, un chimico ha trattato l'(R,R)-3-bromo-2butanolo con acido cromico, ottenendo però una miscela racemica. Spiegare.
27. Quando il cis-2,4-dimetilcicloesanone si scioglie in etanolo acquoso contenente una traccia di
NaOH, si ottiene una miscela di isomeri cis e trans. Spiegare, servendosi del meccanismo.
28. a) La p-nitrobenzaldeide viene riscaldata in presenza di una base forte. Scrivere l'equazione
chimica ed il meccanismo della reazione. b) La benzaldeide viene fatta reagire con etanale in
ambiente acquoso basico. Scrivere l'equazione chimica ed il meccanismo della reazione, spiegando
la funzione della base e dei due carbonili.
29. a) Scrivere l'equilibrio che si stabilisce quando si scioglie l'etanale in acqua. b) Etanale,
tricloroetanale ed acetone si sciolgono in acqua: stabilire l'ordine decrescente di stabilità degli addotti
che si formano. Spiegare, sulla base del meccanismo.
30. Dire da quali dei seguenti composti si formano idrati stabili (scrivere gli equilibri corrispondenti
e spiegare): esacloropropanone, cicloesanone, benzaldeide, 2,2-dimetil-3-pentanone, formaldeide (=
metanale).
31. Mettere i seguenti composti in ordine di reattività verso HCN: difenil chetone, benzaldeide, fenil
metil chetone. Spiegare e scrivere le reazioni corrispondenti.
32. a) Perché una arilammina (per es. anilina) dà un'immina più stabile della isopropilammina? b)
Quale è la geometria di CH3CH=N-CH3? Vi aspettate che ci siano stereoisomeri? Da quali composti
si può ottenere?
33. a) Scrivere le equazioni chimiche della reazione del cicloesanone con le seguenti ammine:
metanammina, dimetilammina, piperidina (azacicloesano, C6H11N), pirrolidina (azaciclopentano,
C4H9N). b) Se si tratta con pirrolidina l'1-fenil-2-pentanone si forma una sola delle due enammine
regioisomere. Indicare quale e spiegare perché.
34. a) Scrivere gli equilibri tautomerici per i seguenti composti: cicloesanone, feniletanone, 1,3cicloesandione, 2,5-pentandione, 2,4-pentandione. b) Scrivere equazione chimica e meccanismo per
la clorurazione promossa da basi di (R)-1-fenil-2-metil-1-butanone. c) Scrivere gli equilibri
tautomerici per i seguenti composti carbonilici ed il meccanismo di formazione in ambiente acido e
basico: 3-ossobutanale, 3-metil-2,4-pentandione, 2-acetilcicloesanone.
35. La condensazione aldolica dei chetoni in genere non è un processo favorevole. La condensazione
aldolica intramolecolare di dichetoni, invece, è un metodo importante per la sintesi di composti
ciclici. Scrivere la reazione del 2,7-ottandione con KOH in acqua.
36. Ciascuno dei seguenti composti viene fatto reagire con HCN: etanale, D-gliceraldeide,
gliceraldeide racemica, propanone. a) Scrivere la reazione per ognuno dei composti. b) Se si fraziona
la miscela di reazione (cioè si separano i prodotti, sulla base delle diverse proprietà fisiche), quante
frazioni si ottengono in ciascun caso? Quali sono risolvibili (cioè sono miscele racemiche).
37. a) I metilchetoni vengono ossidati dagli ipoalogeniti (reazione dell'aloformio): scrivere
l'equazione chimica ed il meccanismo della reazione tra feniletanone ed ipoclorito di sodio
[ricordarsi che l'ipoclorito in ambiente basico è in equilibrio con cloro]. b) Dire quali dei seguenti
composti danno un saggio dello iodoformio positivo: iodoetanale; propanale, 2-butanolo,
feniletanone, 2-metil-3-pentanone. c) Da quale metil chetone si è ottenuto ciascuno dei seguenti
acidi, in seguito a reazione dell'aloformio:
HO
a) (CH ) CHCO H
32
2
b)
O
C
c)
C
C
OH
O
OH
O
38. Il testosterone (un ormone sessuale) contiene un raggruppamento -C=C-C=O, α,β-insaturo.
Perché sia il carbonio carbonilico che il carbonio in beta sono suscettibili di attacco da parte dei
reagenti nucleofili?
PER APPLICARE LE REAZIONI STUDIATE
39. a) Indicare nelle seguenti strutture i gruppi emiacetale ed acetale:
H3C
O
O
CH
OH
CH3
O
O
CH
OCH2CH3
CH2CH3
HO
CH3
O
HO
OH
b) Da quali alcooli ed aldeidi o chetoni si deve partire per ottenere i composti in (a)? Scrivere le
reazioni.
40. Da quali composti carbonilici ed ammine si ottengono le seguenti immine?
N
a)
b)
N
c)
CH3
C
CH3
N
d)
NH
e)
CH3
N
CH3
41. Da quale alogenuro alchilico potete partire per effettuare le seguenti reazioni di Wittig: a)
difenilchetone → 1,1-difeniletene; b) 2-pentanone → 4-metil-1,3-eptadiene; c) o-benzendialdeide →
o-divinilbenzene; d) metil (p-metossifenil) chetone → 1-metossi-2-(p-metossifenil)propene.
42. Indicare come si possa sintetizzare il 2-ottanone a partire dai seguenti composti e tutti i reagenti
necessari: a) eptanale; b) 2-ottanolo; c) 1-ottino.
43. Indicare come si possa sintetizzare l'ottanale a partire dai seguenti composti e tutti i reagenti
necessari: a) 1-ottanolo; b) 1-nonene (suggerimento: riguardare le reazioni degli alcheni!); c) 1ottino; d) 1,1-dicloroottano.
44. Dire quale tra i seguenti composti dà un saggio di Tollens positivo:
O
a) CH CHO
3
b) CH COCH
3
3
c)
OH
O
O
d)
CH3
45. Sia NaBH4 che NaBD4 sono disponibili commercialmente. Indicare come otterreste i seguenti
CH3CD(OD)CH2CH3,
composti
a
partire
dal
butanone:
CH3CD(OH)CH2CH3,
CH3CH(OD)CH2CH3.
46. Indicare come si possono effettuare le seguenti conversioni in modo efficiente (ricordate che le
aldeidi sono più reattive dei chetoni): a) da 3-ossociclopentancarbaldeide a 3-idrossimetilciclopentanone; b) 3-ossociclopentancarbaldeide a 3-idrossiciclopentancarbaldeide.
47. Scrivere le strutture dei seguenti derivati di composti carbonilici: a) il 2,4-dinitrofenilidrazone
della benzencarbaldeide; b) l'ossima del ciclopropanone; c) l'acetale etilenico del 3-esanone
(ciclico!); d) il dimetilacetale dell'etanale; e) il metil emiacetale del metanale; f) l'isomero E
dell'immina dell'1-fenil-1-propanone.
48. Sintetizzare i seguenti derivati, a partire dall'opportuno composto carbonilico:
a)
b)
d)
c)
N
N OH
f)
e)
N
N
H3C
O
O
CH3
N
49. Da quale alogenuro alchilico e da quale composto carbonilico si può partire per ottenere i
seguenti alcheni, mediante una reazione di Wittig:
50. a) Indicare due diversi modi per ottenere il 2-butanolo, usando reattivi di Grignard e gli
opportuni composti carbonilici.
51. Come si possono preparare i seguenti composti:
N
a) CH3CH2CH
d)
CH N(CH2CH3)2
N
e)
c)
b)
N
N
52. Come potete preparare i seguenti composti, a partire da ioduro di metile e reagenti opportuni: a)
3-metil-3-pentanolo; b) etanolo; c) 2-pentanolo; d) 1-feniletanolo; e) 1-fenil-2- butanolo.
53. Indicate come si possono effettuare le seguenti trasformazioni: a) da benzaldeide a 1-fenil-1butanolo; b) da cicloesanone a 1-butilcicloesanolo; c) da 1-butino a 2-pentin-1-olo; d) da
bromobenzene ad alcool benzilico.
54. Da quali composti i seguenti alcooli si possono ottenere per riduzione con NaBH4: 1-propanolo,
3-cicloesenolo, 1-cicloesiletanolo.
55. a) Con quale reattivo di Grignard si possono effettuare le seguenti trasformazioni: metanale in
alcool benzilico; cicloesanone in 1-propilcicloesanolo. b) Dire quali tra i seguenti composti non
possono essere usati in una sintesi di Grignard? (Attenzione: un reattivo di Grignard è
sostanzialmente un carbanione e quindi una base forte ...) 3-idrossibutanale, 3-ossobutanale, 3fenilpropanale, p-amminobenzaldeide, pentandiale, cicloesanone.
SPETTROSCOPIA
56. Dalle bottiglie che contenevano due composti, un’aldeide ed un chetone, entrambi di formula
molecolare C8H8O, si sono staccate le etichette. I composti sono stati provvisoriamente chiamati A e
B e si sono fatti gli spettri riportati di seguito. Sulla base degli spettri, identificate i composti e ...
rimettete a posto le etichette.
A
cm-1
B
19/05/2014
Esercitazione n. 16 - Reazioni e meccanismi di aldeidi e chetoni.
NB. Questo esercizio va affrontato
DOPO aver studiato il capitolo (a dir la
verità, anche gli altri!)
1. Dare la definizione ed un esempio per ciascuno dei seguenti termini:
a) chetone
Composto con gruppo funzionale C=O, con le altre due valenze
libere scambiate con atomi di C
b) aldeide
Composto con gruppo funzionale C=O, con almeno una delle
altre due valenze libere scambiate con un atomo di H
c) forma
enolica
d) ione enolato
e) tautomeria
f) tautomero
Composto con gruppo funzionale C=C-OH, in equilibrio
tautomerico con CH-C=O
Base coniugata dell’enolo (e del composto carbonilico)
C=C-O- ↔ -C-C=O
Equilibrio tra specie in cui si sposta un H
Ciascuno dei composti in equilibrio tautomerico
g) idrogeno enolizzabile
h) cianidrina
i) immina
j) ossima
k) fenilidrazone
l) enammina
m) acetale
n) emiacetale
H in alfa al carbonile, che può essere strappato
da una base, dando uno ione enolato
Composto contenente CN e CHO legati allo stesso C (da aldeide
o chetone e HCN)
Composto contenente C=N (da aldeide o chetone e ammoniaca
o ammina primaria)
Composto contenente C=N-OH (da aldeide o chetone e
idrossilammina, NH2OH)
Composto contenente C=N-NHPh (da aldeide o chetone e
fenilidrazina, PhNHNH2)
Composto contenente C=C-N (da aldeide o chetone e ammina
secondaria)
Composto contenente due gruppi OR legati allo stesso C sp3 (da
aldeide o chetone e ROH in ambiente acido anidro)
Composto contenente un gruppo OH ed un gruppo OR legati
allo stesso C sp3 (da aldeide o chetone e ROH)
1
19/05/2014
o) 1,3-ditiano (= 1,3-ditiacicloesano)
Tioacetale ciclico da composto carbonilico e 1,3-propanditiolo
p) saggio di Tollens
Reazione di identificazione del gruppo aldeidico: ossidazione ad opera
di Ag+ che, riducendosi ad Ag° dà uno specchio
q) riduzione di Wolff-Kishner
Reazione di riduzione del gruppo CO carbonilico a CH2, in
ambiente basico (fenilidrazina, OH-, a caldo)
r) riduzione di Clemmensen
Reazione di riduzione del gruppo CO carbonilico a CH2, in
ambiente acido (Zn in Hg, HCl)
2. Completare le equazioni chimiche per le reazioni del propanale con
ciascuno dei seguenti reagenti:
O
a) NaBH4 (e poi H2O)
CH3 CH2 C H
a. NaBH4
CH3 CH2 CH2 OH
b. H2O
b) bromuro di fenilmagnesio e poi acqua e HBr
O
a.
CH3 CH2 C H
c) OH-, H2O
O
CH3 CH2 C H
O
CH3 CH2 C H + CH3 CH C H
O
OH
MgBr
CH3 CH2 C H
b. H2O
OH-, H2O
O
CH3 CH C H
O
CH3 CH C H
CH3 CH2 CH O -
H2O
CH3 O
CH3 CH2 CH CH C H
OH
2
19/05/2014
d) 1,2-etandiolo, in ambiente acido
CH2-OH
O
CH2-OH
CH3 CH2 C H
H+
O
CH2
CH3 CH2 CH
CH2
O
O
e) bromo, in acido acetico
Br2, H+
CH3 CH2 C H
f) idrossilammina
O
N
NH2OH
CH3 CH2 C H
O
CH3 CH2 C
OH
OH
CH3 CH2 C H
g) fenilidrazina
NH NH2
N
O
NH
CH3 CH2 C H
CH3 CH2 C H
h) dietilammina
O
CH3 CH2 C H + HN
CH2 CH3
CH3 CH CH N
CH2 CH3
H2O
i) KMnO4, OH-
O
CH3 CH2 C H
KMnO4, OH-
CH2 CH3
CH2 CH3
O
CH3 CH2 C OH
j) con piperidina (= azacicloesano)
O
CH3 CH2 C H
N
H
CH3 CH CH N
H2O
k) con pirrolidina (= azaciclopentano)
O
CH3 CH2 C H
N
H
H2O
CH3 CH CH N
3
19/05/2014
3. Scrivere i prodotti che si ottengono per ciascuna delle seguenti reazioni
della p-metilbenzencarbaldeide:
a) con aldeide acetica (= etanale), in ambiente basico
H
C
O
+
OH-
CH3 C H
H2O
CH3
H
b) con NaOH concentrata
H
O
C
O
C
- CH
O
2
H
CH CH
H
H
+ - CH
2
C
H2O
HO CH CH2
C
O
C
O
H2O
O
CH3
CH3
NaOH
CH3
C
CH CH C H
HO CH CH2 C H
CH3
H
O
O
O
CH3
CH3
c) con KMnO4, a freddo
H
C
Condizioni blande: avvengono SOLO le reazioni
più facili
O
HO
C
O
KMnO4, a freddo
CH3
CH3
Condizioni energiche: avvengono TUTTE le
reazioni possibili
d) con KMnO4, a caldo
H
C
O
HO
C
O
KMnO4, a caldo
CH3
C
O
H
e) con etanammina
C
OH
O
CH3
CH3 CH2 NH2
H
C
N CH2 CH3
+ H2O
CH3
4
19/05/2014
4. Completare le seguenti reazioni del cicloesanone, specificando i nomi dei composti
organici che si ottengono: a) con 2,2-dimetil-1,3-propandiolo, in ambiente acido; b) con
idrossilammina; c) con 1,2-etandiolo, in ambiente acido; d) con LiAlH4 e poi acqua e
acido.
OH
O
CH2 OH
1. LiAlH4
H3C C CH3
H3C CH3 CH2 OH
O
2. H2O
cicloesanolo
H+
O
CH2 OH
NH2OH
acetale
N
H+
OH
CH2 OH
O
O
acetale
ossima
5. Scrivere i prodotti che si ottengono da ciascuna delle seguenti reazioni
dell'acetofenone (= feniletanone):
a) con cloro (in eccesso), in ambiente basico
O
C
CH3
O
C
Cl2(eccesso),OH-
b) con NaBH4, e poi acqua
-
O
+ CHCl3
OH
O
C
CH3
CH CH3
1. NaBH4
2. H2O
c) con HNO3 e H2SO4
O
O
C
CH3
C
HNO3+H2SO4
CH3
NO2
N
O
d) con idrazina
C
CH3
NH2NH2
C
NH2
CH3
5
19/05/2014
e) con idrazina, in ambiente basico, a caldo
O
C
NH2NH2,OH-
CH3
CH2 CH3
Δ
f) con bromuro di fenilmagnesio, e poi acqua e HBr
MgBr
O
C
1.
CH3
HO
C
CH3
2. H2O, HBr
g) con iodio, in ambiente basico
O
O
C
h) con Zn(Hg) e HCl
I2, base
CH3
C
O
C
CH3
CH2 I
CH2 CH3
Zn(Hg), HCl
6. Scrivere i prodotti delle reazioni del ciclopentanone con: a) bromo in
acido acetico; b) NaBH4 e successiva idrolisi; c) fenilidrazina; d) bromuro di
isopropilmagnesio e poi acqua, H+; e) idrazina, in ambiente basico a caldo.
O
O
Br
Br2, H+
NH2NH2,OH-
Δ
1. NaBH4
OH
NHNH2
2. H2O
1.
CH
CH3 CH
3
2. H2O, HBr
N
CH3
MgBr
HO
CH CH3
NH
6
19/05/2014
7. Completare le seguenti reazioni, specificando i nomi dei composti
organici che si formano:
a) cicloesancarbaldeide + HCN
O
C
H
OH
CH C N
+ HCN
cianidrina
2-cicloesil-2-idrossietanonitrile
b) ciclopentanone + NaCN + H2SO4
HO
O
C N
+ NaCN + H2SO4
cianidrina
1-idrossiciclopentancarbonitrile
HCN
c) aldeide benzoica + metanammina
O
C
CH N CH3
H + CH NH
3
2
H 2O
immina
metilimmina della benzencarbaldeide
d) ciclopentanone + anilina
NH2
O
N
+
immina
e) ciclopentanone + piperidina (= azacicloesano)
O
N
+
N
H
H2O
enammina
f) 4-metil-3-penten-2-one + metanammina
CH3
CH3 C
CH3
CH
C
CH3 + CH3 NH2
O
NH CH3
CH3 C CH2 C CH3
CH3
O
CH
CH3 C
H2O
N
CH3
C CH3
addizione 1,2
+
NH CH3
CH3 C CH C CH3
CH3
addizione 1,4
OH
enolo
7
19/05/2014
8. Per ciascuno dei seguenti composti indicare il gruppo funzionale e scrivere le
reazioni di idrolisi completa
HO
a)
O
O CH2 CH3
H2 O
H O CH2 CH3
+
emiacetale
H 3C
b)
H 3C
H2O
O CH3
H3C CH2 O CH3
acetale
c)
H 2O
O
H+
O
acetale
d)
O
O
H3C CH2
HO
+
HO
O
H2O
H+
CH O CH3
CH3
O + H O CH3
OH
+ CH3OH +
CH
CH3
acetale
H 2O
e)
H+
O O
acetale
HO
O
OH
f)
HO
H 2O
3
O
6
1
HO 2
OH
O
H
HO
O
OH
5
4 OH
d)
N
OH OH
= HO
6
OH
OH
emiacetale
OH
+
5
4
3
2
1
O
OH OH
O
H2 O
+
H 2N
immina
N
h)
N
diimmina
H2O
NH2
NH2
O
+
O
8
19/05/2014
9. Scrivere le reazioni per la formazione di emiacetali in soluzione acquosa di:
Scrivere l'equazione chimica ed il meccanismo per la formazione di acetali con metanolo,
a partire dagli emiacetali precedenti
a) 5-idrossi-2-esanone
O
OH
H3C
CH2
OH
HO
O CH
3
CH3
CH3
6 O
CH3OH, H+ HO
2 OH
HO
CH2OH
OH
HO
c) 5-idrossipentanale
O
5
CH2 CH2 CH2 CH2 CH
1
OH
OH CH OH, H+
3
O
OH
OH
H3C
O
O
OH
O
4
1
CH3 CH CH2 CH CH
d) 2,4-diidrossipentanale
OH
O
OH
OH
CH2 O OH
CH3OH, H+ H2C
O O CH
3
5 2
CH2OH
CH2OH
HO
HO
OH
OH
b) 1,3,4,5,6-pentaidrossi-2-esanone
OH
OH O
6 CH2 CH CH CH 2C
5
OH
OH
+ H3C
OH CH3OH, H
O
5 2
CH3 CH CH2 CH2 C CH3
2
5
O
CH3
OH CH2OH
CH3
OH
CH3OH, H+
O H
O
O
H3C
O H
CH3
10. Scrivere le reazioni del cicloesanone con i seguenti reagenti: a) metanammina, in
ambiente acido; b) metanolo, in ambiente acido anidro; c) idrossilammina, in ambiente
acido; d) 1,2-etandiolo, in ambiente acido; e) fenilidrazina, in ambiente acido; f)
bromuro di fenilmagnesio, e poi acqua acida;
O
N
CH3
MgBr
1.
CH3NH2
H+
OH
2. H2O, H+
CH3OH
H+
H3C O O CH3
CH2 CH2
OH OH
CH2 CH2 H+
O
O
NH NH2
N NH
H+
O
g) reattivo di Tollens; d)
acetiluro di sodio e poi acqua
acida; i) cianuro di sodio e poi
acqua acida; j) idrazina e poi
KOH, a caldo.
NESSUNA
REAZIONE
1. HC C
+
2. H
HO
1. NH2NH2
2. KOH, Δ
Ag(NH3)2OH
C CH
NaCN
HO
C N
9
19/05/2014
11. Scrivere le reazioni della cicloesancarbaldeide con i seguenti reagenti:
a) bromuro di fenilmagnesio, e poi acqua acida; b) reattivo di Tollens; c) etanolo, in
ambiente acido anidro; d) 1,3-propanditiolo, in ambiente acido anidro; e) amalgama
di zinco in HCl acquoso; f) fenilidrazina, in ambiente acido.
H
MgBr
1.
O
C
NH NH2
H+
H
C
N NH
2. H+
CH OH
-O
Ag°
C
Zn(Hg), HCl
Ag(NH3)2OH
1. HC C
+
2. H
HC C
OH
CH
O
CH3
SH SH +
H
S
S
+
12. Scrivere tutti i passaggi della reazione di Wittig servendosi di:
a) trifenilfosfina, 1-bromopropano, butillitio, benzaldeide
CH3 CH2 CH2 Br + PPh3
CH3 CH2 CH2 CH2Li
+
CH3 CH2 CH2 PPh3 + BrCH3 CH2 CH
+ PPh
butano
3
H
-
CH3 CH2 CH +
+ PPh
C
O
P
O
CH3 CH2 CH C H
CH3 CH2 CH CH + Ph3P=O
3
b) trifenilfosfina, 2-iodopropano, idruro di sodio, propanale
+
PPh3
Br
CH3 CH CH3 + Br
CH3 CH CH3 + PPh3
O
NaH
PPh3
O
CH3 C CH3+ CH3 CH2 CH
-
PPh3
CH3 CH2 CH C CH3
CH3
CH3 CH2 CH C CH3 + Ph3P=O
CH3
10
19/05/2014
13. Le seguenti reazioni sono usate per l'identificazione e l'analisi di aldeidi
e chetoni. Scrivere le reazioni corrispondenti:
a) butanone + 2,4-dinitrofenil-idrazina
O
CH3 CH2 C CH3 +
NH NH2
NO2
NO2
CH3
H2O
NO2
NO2
CH3 CH2 C N NH
2,4-dinitrofenilidrazone
b) benzaldeide + reattivo di Tollens
CO2
CHO
+ Ag(NH3)OH
+ Ag°
c) cicloesanone + Br2, OH-
O
+ Br
2
-OH
O
Br
14. Completare le seguenti reazioni:
NH2
O
a)
+ NH3 + H2, Ni
NH2
O
CHO
c)
b)
CO2H
+ H2, Pt
+ KMnO4
15. Scrivere i prodotti (specificandone il nome) delle seguenti reazioni:
a) ciclopentanone + NaBH4 e
successiva idrolisi
O
2. H2O
H
b) benzaldeide + NaCN, HCl
1. NaBH4
C
OH
ciclopentanolo
C N
CH OH
O
NaCl
HCl
2-fenil-2-idrossietanonitrile
11
19/05/2014
2
c) pentanale + NaOH, H2O
O
-OH
CH3 CH2 CH2 CH2 C H
H
O
OH C 1
CH3 CH2 CH2 CH2 CH CH CH2 CH2 CH3
H2O
6
7
4
2
3
5
3-idrossi-2-propileptanale
d) 4-esenale + metanolo e HCl anidro
O
CH OH
3
CH3 CH CH CH2 CH2 C H
H+
OCH3
CH3 CH CH CH2 CH2 CH
OCH3
dimetil acetale del 4-esenale
H+ (ATTENZIONE:
d) 1,3-diossaciclopentano + H2O,
è del tipo C(OR)2 !)
H2O
O O
H+
il gruppo funzionale
CH2 CH2
OH
OH
+
H
O
C
H
16. Completare la seguente serie di reazioni: benzene + CH3CH2COCl + AlCl3
→ OH- , a caldo → B; B + KMnO4, a caldo → C.
O
O
C
AlCl3
+ CH3 CH2 C Cl
NH2 NH2
CH2 CH3
(A)
CH2 CH2 CH3 KMnO
4
CO2
-OH, Δ
(C)
(B)
H+
-OH, Δ
CO2H
17. a) Scrivere il meccanismo della reazione tra idrossilammina ed un composto
carbonilico. b) Prevedere, spiegando, l'ordine di reattività delle seguenti aldeidi
nei confronti dell'idrossilammina: benzaldeide, p-nitrobenzaldeide, mnitrobenzaldeide.
O
-
lento
+ NH2OH
O
+
NH2OH
NH OH
N
OH
H2O
stadio lento
favorito da sostituenti ad
attrazione elettronica
attacco di Nu
H
C
O
H
NO2
C
O
H
C
O
>
>
-I, -R
HO
NO2
-I
12
19/05/2014
18. a) Mettere i seguenti composti in ordine di reattività nei confronti della reazione
con idrazina (spiegare): benzaldeide, p-metilbenzaldeide, p-metossibenzaldeide.
per la reattività bisogna considerare lo stadio lento!
O
lento
HO
O
+ H2N NH2
NH NH2 H O
2
+ NH2 NH2
stadio lento
favorito da sostituenti ad
attrazione elettronica
attacco di Nu
O
C
H
O
C
N NH2
H
O
C
H
>
>
+I
CH3
OCH3
+R > -I
b) Mettere i seguenti composti inordine di reattività nei confronti della reazione con
2,4-dinitrofenilidrazina: 2-pentanone, 3-pentanone, 3-cloro-2-pentanone, pentanale
(spiegare).
O
lento
+ H2N NH
NO2
-O
HO
+ NH2 NH
NH NH
NO2
H2O
N NH
NO2
NO2
NO2
NO2
stadio lento
>
>
NO2
favorito da sostituenti ad
attrazione elettronica
attacco di Nu
da C sp2 a C sp3
O
CH3 CH2 CH2 CH2 C
H
NO2
risente di effetto sterico
O
CH3 CH2 CH2 CH C CH3
Cl
>
O
CH3 CH2 CH2 CH2 C CH3
O
CH3 CH2 CH2 C CH2 CH3
13
19/05/2014
19. a) Scrivere l'equazione chimica ed il meccanismo della reazione che avviene
tra etanale e metanolo, in presenza di acidi. b) Spiegare come varia la reattività
se con metanolo si fa reagire l'aldeide tricloroacetica.
-O
HO
O
H
H+
CH3 C H + CH3 OH
+OH
lento
2
CH3 C O CH3
H
CH3 C O CH3
+
H
CH3 C O CH3
H
H + CH3
O
CH3 OH
+
H2O + CH3 C O CH3
H
CH3 C O
CH3
H
O
CH3
CH3 C O
H CH3
+
CH3 C O CH3
H
stadio lento
favorito da sostituenti ad
attrazione elettronica
attacco di Nu
O
O
>
CCl3 C H
CH3 C H
-I dei 3 Cl
21. a) L'1-fenil-2-propanone può dare due enoli diversi. a) Scrivere le strutture
degli enoli. b) Prevedere quale sarà presente all'equilibrio in quantità maggiore.
c) Scrivere il meccanismo di formazione dell'enolo in uno dei due casi.
OH
CH C CH3
O
CH2 C CH3
più stabile perché coniugato
con l'anello benzenico
OH
CH2 C CH2
24. Il 4-idrossibutanale esiste in soluzione essenzialmente in forma ciclica. a) Che tipo
di composto è? b) Scrivere l'equilibrio tra la forma aperta e la forma ciclica. c) Scrivere
il meccanismo relativo alla ciclizzazione.
O
CH2 C H
CH2
OH
CH2
OCH2 C H
CH2
O H
+
CH2
OH
CH2 C H
CH2
O
CH2
emiacetale
14
19/05/2014
27. Quando il cis-2,4-dimetilcicloesanone si scioglie in etanolo acquoso
contenente una traccia di NaOH, si ottiene una miscela di isomeri cis e trans.
Spiegare, servendosi del meccanismo.
O
OH
CH3 -OH
H
O
CH3
H
CH3
H2O
H 3C H
H 3C H
Nella forma enolica si perde
la configurazione del C2
H 3C H
28. a) La p-nitrobenzaldeide viene riscaldata in presenza di una base forte.
Scrivere l'equazione chimica ed il meccanismo della reazione.
O
Equazione
C
H
CH2 OH
-OH
C
O-
Δ
NO2
NO2
O
C
+
2
Meccanismo:
O
H
-OH
-O
OH
O
H
C
C
NO2
C
+
NO2
NO2
OH C H
OH
O
H
+
NO2
NO2
NO2
b) La benzaldeide viene fatta reagire con etanale in ambiente acquoso basico.
Scrivere l'equazione chimica ed il meccanismo della reazione, spiegando
la funzione della base e dei due carbonili.
è il sito di attacco
genera il nucleofilo
del nucleofilo
O
H3C
C
O
O
-OH
H
-
C
CH2
H
C
H
O-
O
H C CH2 C H
+
-O
stabilizza il
carbanione
OH
H2C
C
H
O
O
HC CH C H
H C CH2 C H
H2O
15
19/05/2014
29. a) Scrivere l'equilibrio che si stabilisce quando si scioglie l'etanale in
acqua.
HO OH
O
H3 C
H
H3 C
H
b) Etanale, tricloroetanale ed acetone si sciolgono in acqua: stabilire l'ordine
decrescente di stabilità degli addotti che si formano. Spiegare, sulla base del
meccanismo.
L'addotto più stabile è quello che corrisponde
all'equilibrio più spostato a destra, cioè al
composto carbonilico più reattivo
ALDEIDI PIU' REATTIVE DI CHETONI (per effetto sterico e +I del secondo
alchile)
Reazione favorita da sostituenti ad attrazione elettronica
O
H
O
C
>
CCl3
H
C
CH3
>
O
H3C
C
CH3
-I di 3 Cl
33. a) Scrivere le equazioni chimiche della reazione del cicloesanone con le
seguenti ammine:
metanammina
N
O
CH3
+ CH3 NH2
dimetilammina
CH3
O
N
CH3
+ CH3 NH CH3
piperidina (azacicloesano, C6H11N)
O
N
+
N
H
16
19/05/2014
pirrolidina (azaciclopentano, C4H9N)
O
N
+
N
H
b) Se si tratta con pirrolidina l'1-fenil-2-pentanone si forma una sola delle due
enammine regioisomere. Indicare quale e spiegare perché.
O
N
CH3 CH2 CH2 C CH2
+
CH3 CH2 CH2 C CH
N
H
perché l’alchene è coniugato
34. a) Scrivere gli equilibri tautomerici per i seguenti composti:
cicloesanone
O
O
1,3-cicloesandione
O
feniletanone
OH
O
C
CH3 HO
2,5-pentandioneO
CH2
O
+
OH
O
OH
OH
O
O
C
O
2,4-pentandione
O
O
H
O
b) Scrivere equazione chimica e meccanismo per la clorurazione promossa
da basi di (R)-1-fenil-2-metil-1-butanone.
O
H
(R)
:BBH
O
-
O
Cl Cl
O
H3C Cl
(R + S)
17
19/05/2014
c) Scrivere gli equilibri tautomerici per i seguenti composti carbonilici ed il
meccanismo di formazione in ambiente acido e basico: 3-ossobutanale, 3metil-2,4-pentandione, 2-acetilcicloesanone.
O-
O
:B-
O
-
OH
O
BH
+
O
OH
HA
O
H
O
O
A-
O
-
O
O
O
..
O
O
O+
H
O
O
H
A-
O+
+
O
H +
O
O
O
H
O
H
H
O
O
O
O
OH O
OH
+
37. a) I metilchetoni vengono ossidati dagli ipoalogeniti (reazione dell'aloformio): scrivere l'equazione chimica ed il meccanismo della reazione tra
feniletanone ed ipoclorito di sodio [ricordarsi che l'ipoclorito in ambiente
basico è in equilibrio con cloro].
O
R C CH3
Cl2
-OH
O
O
R C
R C O- + CHCl3
CCl3
b) Dire quali dei seguenti composti danno un saggio dello iodoformio positivo:
iodoetanale; propanale, 2-butanolo, feniletanone, 2-metil-3-pentanone.
O
O
I CH2 C H
CH3 CH2 C H
NO
SI
OH
Cl2
CH3 CH2 CH CH3 OH
O
CH3
SI
O
CH3 CH2 C CH3
SI
O
CH3 CH C CH2CH3
CH3
NO
18
19/05/2014
c) Da quale metil chetone si è ottenuto ciascuno dei seguenti acidi, in
seguito a reazione dell'aloformio:
O
CH3 CH C CH3
CH3
(CH3)2CHCO2H
era il CO del metilchetone
O
C
HO
C
O
OH
C
H3C
C
O
OH
C
O
CH3
C
O
CH3
O
38. Il testosterone (un ormone sessuale) contiene un raggruppamento -C=CC=O, α ,β -insaturo. Perché sia il carbonio carbonilico che il carbonio in beta
sono suscettibili di attacco da parte dei reagenti nucleofili?
C
C
C C O
+
C C O
+C
C
C O-
39. a) Indicare nelle seguenti strutture i gruppi emiacetale ed acetale:
HO
OR
RO
emiacetale
OR
acetale
b) Da quali alcooli ed aldeidi o chetoni si deve partire per ottenere i
composti in (a)? Scrivere le reazioni.
OH
OCH2CH3
HO
O
CH
O
CH2CH3
O
H3C CH CH3
CH3
O
O
HO O
OH
acetale
acetale
emiacetale
emiacetale
O
O
CH
CH3
CH
O
O
HO
OH
HO
OH
emiacetale
HO-CH2CH3
O
CH2CH3
C
OH
CH3OH
19
19/05/2014
44. Dire quale tra i seguenti composti dà un saggio di Tollens positivo:
O
O
CH3 C CH3
CH3 C H
SI
O
acetale
O
CH3
O
CH2 CH2 CH2 C H
emiacetale
NO
O
OH
OH
SI
NO
47. Scrivere le strutture dei seguenti derivati di composti carbonilici:
a) il 2,4-dinitrofenilidrazone della benzencarbaldeide
NH
N
CH
NO2
NO2
b) l'ossima del ciclopropanone
N
OH
CH2 CH2
O
O
c) l'acetale etilenico del 3-esanone (ciclico!)
CH3 CH2 C CH2 CH2 CH3
O CH3
d) il dimetilacetale dell'etanale
CH3 CH
O CH3
O CH3
e) il metil emiacetale del metanale
CH2
OH
f) l'isomero E dell'immina dell'1-fenil-1-propanone
E
C N
CH3 CH2 H
20
19/05/2014
51. Come si possono preparare i seguenti composti:
O
CH2 CH3
CH3 CH2 CH CH N
CH2 CH3
CH2 CH3
CH3 CH2 CH2 C H + HN
CH2 CH3
enammina
N
O + H2 N
immina
O + H N
N
enammina
N
O+ H N
enammina
N
O + H N
54. Da quali composti i seguenti alcooli si possono ottenere per riduzione
con NaBH4: 1-propanolo, 3-cicloesenolo, 1-cicloesiletanolo.
O
H O-
+ NaBH4
OH
H
H+
O
1-propanolo
CH3 CH2 CH
CH3 CH2 CH2 OH
3-cicloesenolo
O
HO
1-cicloesiletanolo
CH3
CH
OH
CH3
C O
21
ACIDI CARBOSSILCI e DERIVATI
O
Caratteristica strutturale di acidi carbossilici e
derivati
C
Y
Caratteristiche Spettrali
Spettrometria di massa
Acidi carbossilici
Lo ione molecolare di solito è spesso debole.
La “rottura α” (α-cleavage), lascia il carbocatione acilio (stabilizzato
per risonanza):
+.
HO
R
.
HO +
C O
R
.
+
+
C
O
R
C
+
O
R+
Può essere perso il gruppo –CO2H
R CO2H +.
R
CO2H +
m/z 45
Anche con gli altri gruppi funzionali è favorita la scissione dello ione molecolare
che porta al carbocatione acilio
Le ammidi non sostituite sull’N hanno un picco caratteristico a m/z 44
+.
O
R C NH2
.
R +
+
O
C NH2
m/z 44
acido butanoico,
PM 88
CH3CO+
acetato di etile,
PM 88
M+
M+
1
+
propanammide,
PM 73
O
cloruro di butanoile,
PM 106
C NH2
m/z 44
M+ - Cl
M+
+
C
O
Analogo a quello di aldeidi e chetoni
UV-visibile
IR
stretching O-H
anidride
benzencarbossilica,
PM 226
ACIDI CARBOSSILICI
banda molto larga a 2400 cm-1, spesso sovrapposta
alle bande CH
O
HO
R C
C R
OH
O
stretching C=O a circa 1730-1700 cm-1, spostato verso valori più
bassi dalla coniugazione
stretching C-O
tra 1320 e 1210 cm-1
acido butanoico
2
IR
ESTERI
stretching C=O
a circa 1735 cm-1, spostato verso valori più bassi
dalla coniugazione con R. La coniugazione con OR’
sposta l’assorbimento verso valori più alti.
stretching C-O
due o più bande tra 1300 e 1000 cm-1
acetato di etile
IR
AMMIDI
stretching C=O
a circa 1670-1640 cm-1.
stretching N-H
3500-3100 cm-1 (CONH2 hanno due bande)
propanammide
O
H C
N CH3
H3C
3
IR
CLORURI ACILICI
stretching C=O
a circa 1800 cm-1, spostato verso valori più bassi dalla
coniugazione.
cloruro di butanoile
cloruro di benzoile
IR
stretching C=O
stretching C-O
ANIDRIDI
sempre due bande tra 1830 a 1800 cm-1 e tra 1775 e 1740,
spostato verso valori più bassi dalla coniugazione con R.
tra 1300 e 900 cm-1
anidride propanoica
4
IR
stretching
NITRILI
C N a circa 2250 cm-1, spostato verso valori più bassi dalla
coniugazione con R.
propanonitrile
benzenecarbonitrile
13C
NMR
L’effetto -I dell’O ed il campo magnetico generato
dagli elettroni π diminuiscono la densità elettronica
attorno al nucleo del 13C: molto deschermato
δCOX 180-160 ppm
CO
acetato di etile
acido butanoico
CO
COCO
anidride propanoica
CO
propanammide
5
1H
NMR
L’effetto -I dell’O diminuisce la densità elettronica attorno al nucleo del 1H
sul C adiacente: deschermato da 2,0-2,5 (CH3) fino a 3 (CH2, CH) δ
OH (negli acidi arbossilici) fortemente deschermato: 10-15 δ;
protone mobile, scambia con D2O
NH (nelle ammidi) deschermato e molto allargato: 6-7 δ; protone
mobile, scambia con D2O
acido butanoico
acido
benzencarbossilico
OH
OH
acetato di etile
propanammide
NH
N-metiletanammide
anidride benzoica
NH
6
ACIDI CARBOSSILCI e DERIVATI
H acido
H
O+ C O
δ
sp2
H
δ
H+
C
Nu:
H acido
Caratteristiche:
Acidità del legame O-H
Il C del carbossile subisce attacco da parte dei nucleofili
I protoni in α al carbossile sono relativamente acidi e
possono essere sostituiti
gruppo uscente
Y
C O
H
H acido
♦ sull'O del carbonile (o sull'N del
nitrile) si ha protonazione
δ-
δ+
sp2
Caratteristiche:
H+
C
♦ I protoni in α al carbonile sono
relativamente acidi e possono
essere strappati con basi forti
♦ Qualche reazione caratteristica
delle ammidi avviene sull'N
Nu:
Reazione caratteristica
δ+
sp
C N
H
SOSTITUZIONE NUCLEOFILA
δ-
(la sostituzione nucleofila può avvenire con
meccanismo base- o acido-catalizzato)
H acido
H+
C
Nu:
7
Meccanismo:
+
H Nu:
lento
R
C
Nu H
R
O
C
O
Nu
-
sp2
(trigonale planare)
C
O
R
Y
Y
sp2
(trigonale planare)
sp3
(tetraedrico)
SOSTITUZIONE NUCLEOFILA AL CARBONIO ACILICO
Principali nucleofili:
:NuH = H2O, ROH, NH3, RNH2, R2NH, RSH, RCO2H
Nu:- = RCO2-, R-, H-
O
O
<
C
R
<
C
R
NH2
O
O
C
C
R
OR'
O
<
O
<
C
R
R
O
C
R
SR'
Cl
reattività crescente
Questo ordine di reattività è il risultato di più fattori
Basicità del gruppo uscente
Basicità:
meno basico: miglior gruppo uscente
-NH2 < -OR < -O-C(O)R < Cl-
capacità come gruppo uscente
però non può essere solo questo, perché il gruppo esce DOPO lo stadio lento
Risonanza
O-
O
C
R
C
Cl
R
Cl+
R C
O
R C
O+
R C
O
O-
C
C +
R
SR'
SR'
O-
O
R C
R
O
O
R
O+
O
O-
C
C
R
OR'
C
R
R
+
OR'
O-
O
C
R C
O-
O
C
NH2
R
+
NH2
il contributo della struttura di risonanza a separazione di carica diminuisce
la bontà del gruppo uscente ed è tanto maggiore quanto migliore è la
sovrapposizione degli orbitali (cioè con gli elementi della stessa riga).
8
Effetto induttivo
Maggiore è l’effetto ad attrazione elettronica, più positivo è il C carbonilico
più facile è l’attacco del nucleofilo
O
R C
REATTIVITA‘
CRESCENTE
Cl
O
R C
O
R C
H2O
O
O
H+
oppure
OH-
R C
OR'
O
O
R C
OH
R C
NH2
R C
N
O
R C
REATTIVITA‘
CRESCENTE
Cl
O
R C
O
R"OH
O
R C
OR"
R C
O
O
R C
OR'
O
R C
REATTIVITA‘
CRESCENTE
Cl
O
R C
O
R C
O
NH3
O
R C
NH2
O
R C
OR'
9
1.
Nu = H2O
REAZIONE CON H2O
a) Alogenuri acilici
lento
O
R C
+ :OH2
Cl
O-
O
+
R C OH2
R C
OH
HCl
Cl
Sostituenti ad attrazione elettronica su R FACILITANO l'attacco del nucleofilo
b) Esteri
Gli esteri sono meno reattivi degli alogenuri acilici: l’acqua da sola non reagisce)
-OH,
Nu = -OH
In ambiente basico
-:OH
+
OR'
R C
O
lento
O
H2O oppure H2O, H+
R
O
O
+ -OR'
R C
C OH
R C
OH
reazione acido-base
OR'
O
- + R'OH
L'ultimo passaggio rende IRREVERSIBILE l'intero processo
Sostituenti ad attrazione elettronica su R FACILITANO l'attacco del nucleofilo
In ambiente acido
O
Nu = H2O
H+
+O H
R C
R C
OR' H O
2
OH
OH
R C
OR'
+ OH
2
R C
OH
O H
R C
+
OR'
OH
lento
R C
OR'
:OH2
OR'
+OH2
+
H
OR'
+
R C +
OH
Processo REVERSIBILE
O
OH
OH
R C
+ R'OH
R C
OH
H+
OH
Questo significa che in ambiente acido si può
idrolizzare un estere ad acido carbossilico
L'idrolisi acida degli esteri è praticamente insensibile agli effetti elettronici
dei sostituenti; è invece sensibile agli effetti sterici
ATTENZIONE
Questa insensibilità agli effetti elettronici (induttivo
e coniugativo) dei sostituenti è una caratteristica
SOLO dell’IDROLISI ACIDA degli ESTERI
è il risultato di effetti opposti, praticamente uguali
10
Lo stadio lento è l’attacco del nucleofilo sull’estere protonato:
dipende quindi dalla sua concentrazione, che, a sua volta, dipende
dalla basicità dell’estere
K=
[RC(O)OHR'+]
[RCO2R'][H+]
[RC(O)OHR'+] = K [RCO2R'][H+]
v = k[RC(O)OHR'+] = kK [RCO2R'][H+]
La reattività dipende dalla costante di velocità dello stadio lento (k) E
dalla costante di equilibrio acido-base preliminare (K)
k
l'attacco del nucleofilo è favorito dai sostituenti ad attrazione elettronica
K
la protonazione di una base è sfavorita dai sostituenti ad attrazione elettronica
Solo nel caso dell'idrolisi acida degli esteri gli effetti hanno valori molto simili,
cioè la sensibilità della protonazione e dell'attacco nucleofilo all'effetto dei
sostituenti è praticamente la stessa.
Essendo di segno opposto, gli effetti si annullano.
c) Ammidi
Le ammidi sono ancora meno reattive: l’acqua da sola non reagisce)
-OH,
Nu = -OH
In ambiente basico
O
R C
+ -:OH
O-
lento
R
C OH
NH2
Ci sono solo CATTIVI gruppi uscenti, -OH e
-NH2, ma -OH è più ACIDO di –NH2
C OH
R
NH2
O-
H2O oppure H2O, H+
NH2
O-
-:OH
R
C O
NH2
-
O
R C
-
+ -NH2
H2O
O
R C
O
reazione acido-base
O-
+ NH3
L'ultimo passaggio rende IRREVERSIBILE l'intero processo
Sostituenti ad attrazione elettronica su R FACILITANO l'attacco del nucleofilo
11
In ambiente acido
H+
O
Nu = H2O
+O H
R C
R C
NH2 H O
2
OH
OH
R C NH2
+ OH
R C
O H
NH2
R C
+
O
R C
OH
:OH2
R C NH2
+ OH
2
+ OH
R C +
OH
OH
2
NH2
OH
H
NH2
+
OH
lento
+ NH3
R C
OH
+ NH4+
L'ultimo passaggio rende IRREVERSIBILE l'intero processo
Sostituenti ad attrazione elettronica su R FACILITANO l'attacco del nucleofilo
d) Anidridi
Nu = H2O
Le anidridi sono più reattive di esteri ed ammidi: basta l’acqua da sola
O-
O
C
R
O
R
R
+ :OH2
C
-
O
+
OH2
R
C
O
R
C
C
R
C
O
O
O
O-
O
+
R
OH
O H
+
C OH2 + R
OH
2
C
O
R
C
O
L'ultimo passaggio rende IRREVERSIBILE l'intero processo
Sostituenti ad attrazione elettronica su R FACILITANO l'attacco del nucleofilo
e) Nitrili
I nitrili sono poco reattivi (meno delle ammidi): l’acqua da sola non reagisce)
-OH,
H2O oppure H2O, H+
12
In ambiente acido
OH
tautomeria
+ R C N H
H+
O
:OH2
+
OH2
lento
+
R C N H
R C N H
+
R C N H
+
R C N: + H
H+
Nu = H2O
R C
NH2 H O
2
OH
+O H
R C NH2
+ OH
R C
R C
+
O
R C
OH
OH
R C NH2
+ OH
NH2
:OH2
+ OH
OH
H
NH2
+
R C +
OH
OH
2
PROSEGUE con l'idrolisi
acida delle ammidi
O H
R C NH2
OH
H+
O
R C NH2
2
+ NH3
R C
OH
+ NH4+
L'ultimo passaggio rende IRREVERSIBILE l'intero processo
Sostituenti ad attrazione elettronica su R FACILITANO l'attacco del nucleofilo
2.
REAZIONE CON ALCOOLI
a) Acidi carbossilici
In ambiente acido
+O H
O
+ H+
R C
OH
OH
R C
+ OH
O H
R C+
OH
R C
OH
OR'
H2O +
Nu = R’OH
OH
R C OR'
+
lento
+
: O R'
H
OH
R C
OH
H
O
R C OR'
H
OR'
+
+
H+ + R C
O
OR'
2
La reazione intramolecolare è facile, se si formano anelli stabili (5 e 6 termini)
R
HO:
O
R CH CH2 CH2 C
γ
OH
Δ
H+
CH
H2O + CH2 O
CH2 C
γ-lattone
O
13
HO:
O
R CH CH2 CH2 CH2 C
δ
OH
Δ
R
CH2 CH
H2O + CH2
O
CH2 C
δ-lattone
O
H+
se l'OH è più vicino al carbossile, ci sono altri percorsi di reazione, più facili della
chiusura di un anello teso
R
Δ
O
R CH CH2 C
+
OH H
β
HO
CH O
CH2 C
O
O
R CH CH C
OH β-eliminazione
α
OH
R CH C
O
OH
OH
HO
C CH R
O
R
+
Δ H
O
CH C
O
CH
R
O
lattide
O
C
+ 2 H2O
se l'OH è più lontano dal carbossile, il prodotto dipende dalle condizioni di reazione
in soluzione molto diluita:
OH
OH
CH2CH2 CH2 CH2 CH2 CH2 C
O
Δ
O
O
H+
in soluzione concentrata:
OH
OH
n CH2 CH2 CH2 CH2 CH2 CH2 C
O
Δ
H+
O
(
O CH2 CH2 CH2 CH2 CH2 CH2 C
)
n
+ n H2O
b) Alogenuri acilici
-
O
R C
Cl
..
+ HOR'
lento
O +
R C OR'
Cl
H
O
R C
HCl
OR'
E’ opportuno effettuare la reazione in presenza di una base (per HCl)
14
es.:
O
O
C
C
N
Cl + CH3CH2CH2OH
OCH2CH2CH3 +
N + ClH
c) Anidridi
-
O
R
C
R
C
O
..
O + HOR'
C
R
O
R
R
C
O H
+
O
O
O
C
R
O
+
OR'
R
+
+
O
C
R
OR'
Nu = -OR’’
+ -:OR"
R
H+
OR' R"OH
O
C OR"
+ -OR'
R C
OR"
OR'
In ambiente acido
R C
O-
lento
OR'
H
R C OR'
+
OR"
C
TRANSESTERIFICAZIONE
In ambiente basico
R C
O
OH
R
O
d) Esteri
O
-
C
H
OH
-
C OR'
R
C
O
O
O
H
OR'
+
Nu = R’’OH
+O H
R C
OR'
OH
R C +
OR"
O H
R C
+
OH
lento
OR'
: O R"
H
R C OR'
+ OR"
+ OH
+ R'OH
R C
OR"
H
O
R C
OR"
H+
15
e) Ammidi
3.
Essendo meno reattive, richiedono condizioni di reazione
troppo energiche per essere utili
REAZIONE CON AMMONIACA ED AMMINE
a) Acidi carbossilici
con NH3
O
O
R C
R C
+ :NH3
OH
O-
NH4+
reazione acido-base
Scaldando il carbossilato di ammonio solido:
O
R C
Δ
NH4+ (solido)
O-
NH2
Meccanismo:
R C
O-
O
O
O- NH4
R C
+
O
R C
OH
+ :NH3
R
+ H2 O
O-
+
C NH3
C NH2
R
OH
O
R C
NH2
OH2
+
+ H2O
con ammine primarie
O
OH
O
R C
O-
O
+ RNH2
R C
RNH3+
R C
Δ
(solido)
O-
RNH3+
O
+ H2 O
R C
NH R
Meccanismo:
-
O
R C
RNH3+
O-
-
O
O
R C
OH
+ RNH2
C NH R
OH
+ 2
+
NH2 R
OH
O
R
R C
O
R C
NH R
+ H2O
16
con ammine secondarie
O
R C
OH
O
R C
O-
O
+ :NHR2
R C
Δ
R2NH2+ (solido)
R2NH2+
O-
O
R C
NR2
+ H2 O
Meccanismo:
O
R C
O-
O
R
O-
O
R2NH2+
R C
+ :NHR2
OH
R
+
C NHR2
OH
O
C NR2
R C
+ H2 O
NR2
OH2
+
Se si ha un amminoacido con il gruppo amminico in γ o δ al carbossile, la
reazione è intramolecolare (si formano anelli a 5 o a 6 termini)
R
NH2
R
Δ
OH
CH CH2 CH2 C
γ
CH
CH2
H+
O
+ H2O
NH
γ-lattame
CH2 C
O
NH2
R CH CH2 CH2 CH2 C
δ
OH
Δ
O
H+
R
CH2 CH
CH2
NH
+ H2O
CH2 C
δ-lattame
O
se l‘NH2 è più vicino al carbossile, ci sono altri percorsi di reazione, più facili della
chiusura di un anello teso
R
CH NH
β
OH
H+
O
Δ
R CH CH2 C
NH2
CH2 C
O
OH
+ NH3
R CH CH C
β-eliminazione
O
17
b) Alogenuri acilici
Meccanismo:
R C
O
-
+
R C NH3
+ :NH3
Cl
R C
O
lento
O
O
+ 2 :NH3
O
R C
NH2
O
+ 2 R'NH2
O
+ NH4+Cl+ R'NH3+Cl-
R C
NH R'
Cl
R C
NH2
HCl
Cl
Cl
R C
O
R C
O
+ 2 R'R"NH
+ R'R"NH2+Cl-
R C
N R'
R"
Cl
c) Anidridi
O-
O
C
R
R
R
+ :NH
3
O
O
+
NH3
C
R
O
R
C
R
C
R
C
-
+
NH3 + R
C
NH2
O H
+
O
O
O
O
C
-
O
O
R
C
C
OH
NH2 + R
O
O
R
O
O
R
R
O
+ NH3
NH2
O
C
R
OH
+
O
O +NH
4
NH3 R
O
18
R
R
O
O
O
O
R
+ R'R"NH
O
R
R
+ R'NH2
N
O
R' R O
+ O
R"
N R' R
+
R
O
O
R'NH2
-+
R
O
R'NH3
O
-
R
O R'R''NH
O
O
O
+
R'R''NH2
Le anidridi cicliche danno immidi
O
O
O
..
O + 2 NH3
NH
.. 2
+ NH
3
OH
NH2
O+
NH4
O
anidride ftalica
O
O
O
Δ
NH
H2O
ftalimmide
O
O
:B-
O
NH
base debole, H acido
N
BH
O
-
O
d) Esteri
lento
O
R C
OR'
+ :NH3
-
O-
+
R C NH3
O
R
C
O
NH2
R C
+ R'OH
NH2
+ OR'
H
OR'
Gli esteri sono meno reattivi di alogenuri acilici e anidridi e perciòbisogna scaldare
O
+ H2N R"
R C
Δ
O
R C
NH R"
OR'
O
R C
+
OR'
HN R"
R'''
+ R'OH
Δ
O
+ R'OH
R C
N R"
R'''
19
4.
REAZIONE CON ACIDI CARBOSSILICI E CARBOSSILATI
Con questi nucleofili possono reagire solo I derivati acilici più reattivi
-
a) Alogenuri acilici
O
O
R C
R
O
O-
+ R C
Cl
R
O
C Cl
R C
O
C
R C
O
Cl-
O
O
OO
O
Cl
+O H
C
R
O
+ R C
R C
OH
O
R
R C
C Cl
O
R C
O
HCl
neutralizzato con una base
man mano che si forma
O
es:
O
CH3 CH2 CH2 C
Cl
O
+ CH CH CH C
3
2
2
O
C
N
CH3 CH2 CH2
OH
N
H
C
O
CH2 CH2 CH3
+ Cl-
b) Acidi carbossilici
(SOLO con acidi bicarbossilici in grado di formare
O
anelli stabili) O
C
C
Δ
CH2
OH
CH2
O
OH
CH2
CH2
C
C
H2 O
O
O
2.
REAZIONE CON TIOLI
a) Alogenuri acilici
O-
O
R C Cl
R' +SH
+ R C
R' SH
Cl
O
R C
HCl
SR'
es:
O
O
CH3 CH2 C
+ CH3 CH2 SH
N
CH3 CH2 C
Cl
N+
H
S CH2 CH3
Cl-
20
Ricapitolando:
Cl: -I>+R
O
R C
Cl
R
O
C
reagisce anche con nucleofili deboli (oltre a quelli forti):
acqua, alcooli, acidi carbossilici, ammine, tioli
buon gruppo uscente
OCOR: -I<+R
O
O
ottimo gruppo uscente (idem Br)
R
reagisce anche con nucleofili deboli (oltre a quelli forti):
acqua, alcooli, ammine
OR’: -I<+R con –I minore e +R maggiore rispetto alle anidridi
O
R C
O R'
cattivo gruppo uscente
reagisce solo con nucleofili molto forti (o se reso miglior
gruppo uscente dalla protonazione):
idrossido, alcossidi , ammine (in presenza di H+: acqua, alcooli)
O
R C
N R'
R''
NR’R’’: -I<+R con –I minore e +R maggiore rispetto agli esteri
pessimo gruppo uscente
reagisce solo con nucleofili molto forti (o se reso miglior
gruppo uscente dalla protonazione): OH-, H2O e H+
6. REAZIONE CON COMPOSTI ORGANOMETALLICI
con reattivi di Grignard e litioorganici
a) Esteri
O
δ - δ+
R' C OR" + R MgX
O- +MgX
R' C OR"
O
R' C
R
+
R"OMgX
R
da qui prosegue la reazione dei chetoni
O
R' C
δ- δ+
R + R MgX
O +MgX H O, H+
2
R' C R
OH
R' C R
R
R
i chetoni sono più reattivi degli esteri e perciò si arriva all'alcool terziario
es.:
MgBr
O
CH3 CH2 O C CH3 +
2
CH3 C
OMgBr
H2O, H+
CH3 C
OH
21
O- +Li
O
δ- δ +
R' C OR" + R Li
O
R' C OR"
R' C
R + R"OLi
R
da qui prosegue la reazione dei chetoni
O
R' C
O +Li
δ- δ+
R + R Li
R' C R
OH
H2O, H+
R' C R
R
b) Cloruri acilici
O
R' C Cl
δ- δ+
+ R MgX
R
O- +MgX
O
R' C Cl
R' C
R + MgXCl
R
con accorgimenti sperimentali, è possibile fermare la reazione alla
formazione del chetone, altrimenti, si arriva ad alcool terziario
O
δ- δ +
R + R MgX
R' C
O +MgX H O, H+
2
R' C R
OH
R' C R
R
O
O
δ - δ+
+ R Li
R' C Cl
R
+Li
O
R' C Cl
R' C
R
+ LiCl
R
O
R' C
O +Li
δ- δ+
R + R Li
R' C R
H2O, H+
R
OH
R' C R
R
con cadmioorganici e cuprati organici
Per fermare la reazione a chetone si devono usare:
composti organometallici meno reattivi
solo con i cloruri acilici
2 RMgX + CdCl2
R2Cd + MgCl2 + MgX2
(R = CH3, alchile primario, fenile)
esempio:
MgBr CdCl
2
Cd
22
-
O
O
+ CH3 CH2 C
Cd
O
CH3 CH2 C
Cl
Cl
O-
δ- δ+
+ R CuLi
2
R' C Cl
O
CH3 CH2 C
O
R' C
R' C Cl
R
R
es.:
O
O
C
C
Cl
CH3
+ (CH3)2CuLi
O
O
C
H
C C
CH3 CH
H
Cl
(CH3CH2)2CuLi
CH3
C
CH3 CH
-78°C
CH2 CH3
C
C
CH3
CH2
CH2
CH3
CH3
(feromone delle formiche)
92%
RIDUZIONI
a) Con idruro
LiAlH4
O
R C
R CH2 OH
OH
R C
O LiAlH4
Cl
R CH2 OH
LiAlH4
O
R CH2 OH
R C
OR'
LiAlH4
O
R C
R CH2 NH2
NH2
R C
N
LiAlH4
R CH2 NH2
23
Meccanismo:
+
AlH3 (Li )
+ H
H
O
O
-
O
R C
H2
+ R C
(Li+)
-
AlH3
O
-
Y = Cl, OR', OAlH3
O
O
R C
-:H
+
-
O
R C H
R C H
Y
Y
O
+
R C H
O-
-:H
R C H
OH
H2 O
R C H
H
Y = NH2
O
R C
+
H
OR C H
-:H
Y
OH
R C H
H
+
H
H2 O
R C H
- NH
NH
N
NH
- NH
H
-:H
R C H + OH
R C H
NH2
R C H +
R C
+ Y-
-:H
R C
-
N
NH2
H
+
-:H
R C
N
2 - 2 H2 O
H
R C
NH2
H
H
Diminuendo la reattività dell'idruro è possibile fermare ad aldeide la riduzione
dei CLORURI ACILICI
O
R C
-
+ [(CH3)3CO]3AlH
O
Li+
R
Cl
es.:
O
CH3 CH2 CH2 C
-
+ [(CH3)3CO]3AlH
C
H
O
Li+
CH3 CH2 CH2 C H
Cl
24
b) Con idrogeno e catalizzatore
H2, Pt
N
R C
R CH2 NH2
Con catalizzatore disattivato è possibile fermare ad aldeide la riduzione
degli ALOGENURI ACILICI
Pd, BaSO4
Pd, chinolina
N
O
R C
Cl
O
+ H2
R
es.:
C
H
O
O
C
Pd
C
H
+ H2
Cl
N
REAZIONI SPECIFICHE DELLE SINGOLE CLASSI DI GRUPPI FUNZIONALI
1.
Acidi carbossilici
(a) trasformazione del gruppo OH in buon gruppo uscente
OH
cattivo gruppo uscente
O
Per trasformarlo in buon gruppo uscente si possono utilizzare i
reagenti che trasformano -OH in -Cl
R C
Con agenti alogenanti
OH
R C
O
+ PCl5
O
R C
O
+ HCl + POCl3
R C
O
Cl
OH
+ PCl3
3R C
O
O
CH3 C OH + Cl S Cl
+ P(OH)3
3 R C
O
esempi:
+ HCl + SO2
Cl
OH
R C
Cl
+ SOCl2
O
O
CH3 C Cl + HCl + SO2
25
O
C
O
C
OH + PCl
5
Cl + HCl + POCl
3
O
CH3 CH2 CH3 C Cl
O
CH3 CH2 CH3 C OH + PCl3
+ P(OH)3
Meccanismo con SOCl2:
O
O
CH3 C O S Cl
O
O
CH3 C OH + Cl S Cl
O
O
CH3 C O S Cl
+
CH3 C O
+
CH3 C O
+ HCl
-
+
O
O S Cl
O
CH3 C Cl + O S O
Con diazometano: CH2N2
O
R C
-:
+
OH
CH2
-:
O
+
R C
N
N
O
-
+
CH3
Nu
reazione acido-base
O
N2
.. N:
+
CH2 N
+
N
+
N
CH2 N
N
ottimo gruppo uscente
sp3
Con diazometano si formano esteri metilici
+ R C
O CH3
Con dicicloesilcarbodiimmide, DCC
O
+
R C
O H
N
O
C
C
R
C N
..
H2N R'
H
N
O
N
N
H
-
O
R
C
C
R' NH2
+
N
N
O
C
N
Nu
Addizione nucleofila
buon gruppo uscente
H
H
O
R
C
+
NH2 R' + O
O
N
C
R
N
C NH R' + HO
N
C
N
reazione acido-base
26
H
N
La DCC permette di ottenere ammidi dagli
acidi carbossilici in condizioni molto blande
O C
NH
dicicloesilurea
b) reazione in posizione α
OH
OH
PBr3, Br2
R CH2 C
oppure
P + Br2
O
Reazione HVZ
(Hell-Volhard-Zelinski)
R CH C
O
Br
α-alogenazione
Meccanismo:
..
OH
Br
Br
PBr3
R CH2 C
R CH C
R CH2 C
O
OH
O
gli alogenuri acilici enolizzano più facilmente degli acidi carbossilici
Il C=C addiziona Br2
OH
R CH C
Br
+
OH
R CH C +
Br
Br-
Br
OH
H+
R CH C
Br
Br
O
R CH C
Br
Br
Br
Br
Quando si lavora la reazione (aggiunta di acqua), il bromuro acilico è più reattivo di
quello alchilico. Oppure si possono aggiungere nucleofili
O
R CH C
O
R CH C
Br
NH2
NH3
Br
OH
H2O
Br
ROH, H+
H+
R CH C
Br
O
O
R CH C
Br
OR
27
2.
Esteri
Con alcossido (condensazione di Claisen)
CH3CH2O-Na+
O
2 CH3 C
OCH2 CH3
O
O
CH3 C CH2 C O CH2 CH3 + CH3CH2OH
L’alcossido DEVE essere identico al gruppo -OR dell’estere
Meccanismo:
(Na+)
O
CH3 C
O CH2 CH3
E
O
-
+ CH3CH2O-Na+
CH2 C
reazione acido-base
+ CH3CH2OH
O CH2 CH3
(equilibrio spostato a sinistra)
Nu
OO
CH3 C
CH3
O
-
CH3 C O CH2 CH3
O
O CH2 CH3
O CH2 CH3
H2C C
(equilibrio spostato a sinistra)
O CH2 CH3
O
O
C
C
CH2
:
+ CH
2
C
O
O CH2 CH3
CH3
+ CH3CH2O-
C
O
CH
-
C
O CH2 CH3
+ CH3CH2OH
(equilibrio spostato a destra)
H più acidi di quelli dell’estere di partenza
O
CH3
C
O
O
C
O CH2 CH3
CH
+
(Na )
H2O
OH-
CH3
C
O
C
CH2 O CH2 CH3
E' possibile la condensazione incrociata, quando un solo estere ha H in α:
O
O
O
O CH CH
C
2
3
O
1. CH CH O-Na
C
3 2
CH2C O CH2CH3
+ CH3 C O CH2CH3 2. H+
qualsiasi carbanione è in grado di dare condensazione
O
NaNH2
H3C C C(CH3)3
O
(Na+) H2C C C(CH3)3
NH3
O
O
O
O
CH3 C CH3 C CH2 C C(CH3)3
CH2 + CH3 C O CH2CH3
C
CH3
CH3
CH3CH2O-
28
3.
Ammidi
Con anidride fosforica, P2O5
O
R
C
R C N + H2O
NH2
Con con Br2 + NaOH (Trasposizione di Hofmann)
O
R C NH2 + Br2 + 4 NaOH
R-NH2 + 2 NaBr + Na2CO3 + 2 H2O
(oppure NaOBr, OH-)
meccanismo
O
R C NH2 +
O
R C
NH
+
-OH
O
R C NH Br
O
R
C
O
+ Br Br
R C NH Br +
N-bromoammide
O
-
R C N Br
..
R C N
..
nitrene
..
N
..
+
Br-
H2O
+
Br-
R N C O
isocianato
R N C O + -OH
OH
R NH C O +
-
R C NH + H2O
O
..R C N
.. Br
O
O
-OH
-OH
OH
R NH C O
O
OH H O
2
R N C O
OH
- OH
R NH C O
OH
O
+
R NH2 C O
O
OH
R NH C O
OH
R NH C O + H2O
O
R NH2 +
O C O
O
29
DECARBOSSILAZIONE
a) da carbossilati di metalli pesanti (reazione di Hunsdiecker)
O
O
C
R
+ Ag2O
C
OH
- +
O Ag
R
O
O
+ HgO
C
R
-)
O 2
Hg2+
O
O
C
C
R
OH
R
+ Pb(OCOCH3)4
R
OH
R
O
C
C
-)
Pb4+
O 4
Δ
+ Br2
O Ag+
(o I2)
R Br + CO2
(R I )
meccanismo:
O
R C O
R
inizio
O
R C O Br
acil ipobromito
Br Br
:O:
O .. ..
C O
.. :
... Br
.. .
.. .
+
:
Br
R C O
..
..
radicale carbossilato
:O:
propagazione
.
R
.. .
R C O
..
.
R + O C O
O
+
Br O C
O
R
R Br + R
C
..
.
O
..
30
b) da β-chetoacidi
R
C
O
R
OH
R
O
Δ
O
O
#
H
H
O
C
C
Δ
O
R
O
C
C
C
O
R
R
O
+
C
C
C
O
-
+ CO2
O
O
C
C
R
CH2
in ambiente basico:
H
O
H
O
R
O
C
+ CO2
CH3
CH3
O
O
CH2
C
O-
R
C
O
CH2
-
C
R
CH2
b) da acidi β-dicarbossilici
O
HO
O
O
C
O
O
H
H
O
C
C
CH3
HO
OH
Δ
O
O
O
O
C
C
C
C
H
C
#
O
O
+ CO2
O
O
O
H
O
+
C
C
C
O
O
O
C
C
la decarbossilazione è favorita da sostituenti ad attrazione elettronica
31
Sfrutta l'acidità degli H in mezzo a due CO e la facile
decarbossilazione dei β-chetoacidi
SINTESI "ACETOACETICA"
-O
OCH2CH3
C
-:CH
C
O
R"
(Na+)
O
O
OCH2CH3
C
+ CH3CH2OCH2
Na+
C
O
R"
O
C
HC
C
(CH3)3C O - K+
O
OCH2CH3
ecc.
C
C
O
R"
sostituzione nucleofila
al C saturo
R X
c'è ancora un H acido
(meno di prima )
C
OCH2CH3
R
R"
H2O, OHidrolisi
basica
R"
O
OC CH C
O
R
H+
neutralizzazione
(acido-base)
OCH2CH3
C
-:C R (K+)
C
O
R"
sostituzione
R
nucleofila
1 X
al C saturo
O
O
OH
R" C CH C
O
R
Δ
decarbossilazione
OCH2CH3
1. H+
C
O R1 OH2O, OH2. Δ
R1 C R
R" C C C
R"
idrolisi
C
O
R
CO2
basica
O
R"
O
O
R" C CH2 R
O
C CH R
R1
Scegliendo opportunamente il reagente R-X, si possono ottenere chetoni
con un altro gruppo funzionale
R-X = α-alogenoesteri
OCH2CH3
C
:CH
+
C
H3C
O
O
O
C
O
CH CH C O CH2 CH3
R CH C O CH2 CH3
Br
OH
Cβ β
O
1. NaOH, H2O
α CH CH C OH
α
γ
2. H3O+
C R
H3C
O
OCH2CH3
O
O
R
C
H3C
Δ
O
CH2
C
H
C
CO2
3
O
O
CH C OH
R
O
CH3 C CH2 CH C OH
O
R
γ-chetoacido
32
R-X = α-alogenochetoni
OCH2CH3
C
:CH
C
O
H3C
OCH2CH3
O
1. NaOH, H2O
CH CH2 C R
2. H3O+
C
H3C
O
O
O
O
C
O
Br CH2 C R
OH
C
O
α CH CH2 C R
βC
H3C
O
Δ
CO2
O
CH3 C CH2 CH2 C R
O
γ-dichetone
R-X = alogenuri acilici
Non si può usare come base CH3CH2ONa in CH3CH2OH, perché l'alogenuro acilico
è molto reattivo (e reagisce con l’etossido ed anche con l'etanolo)
OCH2CH3
OCH2CH3
O
C
C
NaH
CH2
:CH
+
C
C
H2
O
H3C
O
H3C
O
1. NaOH, H2O
2. H3O+
Δ
CH3 C CH2
CO2
C
O
CH C R
R C
Cl
O
C R
OCH2CH3
O
O
C
H3C
O
O
β-dichetone
Con una base molto forte (ammide di sodio o di potassio) si possono
strappare due protoni.
Il dianione può essere fatto reagire con un equivalente di alogenuro alchilico
OCH2CH3
C
KNH2
CH2
C
NH3
O
CH3
O
OCH2CH3
C
- : CH
2 K+
C R
O
CH
.. 2
O
X
OCH2CH3
O
OCH2CH3
O
C
C
NH4+Cl
- : CH
CH2
C
C
O
O
CH2 R
CH2 R
per la neutralizzazione conviene usare l'acido coniugato del solvente
il β-chetoestere con catena allungata può essere utilizzato in tutte le reazioni viste in precedenza
33
SINTESI "MALONICA"
Sfrutta l'acidità del metilene tra due funzioni esteree e la facile decarbossilazione
degli acidi β-dicarbossilici
-O
O
O
C
C
C
OCH2CH3
+
OCH2CH3
C
:CH
C
O
OCH2CH3
O
CH3CH2O-
OCH2CH3
O
O
propandioato dietilico
(malonato dietilico)
-O
C
C
C
OCH2CH3
C
C
C
OCH2CH3
C
R X
:CH
C
O
X
OCH2CH3
OCH2CH3
C
CH R
C
O
OCH2CH3
O
1. H2O, -OH
2. H O+
3
OH
C
CH R
C
O
OH
O
OCH2CH3
OCH2CH3
"estere malonico"
O
OCH2CH3
R
Δ
CO2
CH2
C
OH
O
acido acetico
α-sostituito
OCH2CH3
OCH2CH3
O
C
(CH3)3CO-K+
C
CH R
R C:
R' X
C
C
O
O
OCH2CH3
OCH2CH3
O
OCH2CH3
C
1. H2O, -OH
R C R'
2. H3O+
C
O
OCH2CH3 3. Δ , - CO
O
2
R'
O
R CH C
OH
acido acetico α,α-disostituito
La reazione si può effettuare con tutti gli alogeno derivati utilizzati con il 3ossobutanoato di etile (estere acetoacetico)
alogenuri alchilici, alogenuri acilici,
α-alogenochetoni, α-alogenoesteri
altri esempi (che si possono usare anche nella sintesi acetoacetica:
R-X = α,ω-dialogenoalcani
O
O
C
C
C
OCH2CH3
+
CH3CH2O- Na+
O
Na+
OCH2CH3
-C
: CH
C
OCH2CH3
O
OCH2CH3
34
OCH2CH3
OCH2CH3
O
C
(CH3)3CO-K+
C
CH R
R C:
R' X
C
C
O
O
OCH2CH3
OCH2CH3
O
OCH2CH3
C
1. H2O, -OH
R C R'
2. H3O+
C
O
OCH2CH3 3. Δ , - CO
O
2
R'
O
C
R CH
OH
acido acetico α,α-disostituito
La reazione si può effettuare con tutti gli alogeno derivati utilizzati con il 3ossobutanoato di etile (estere acetoacetico)
alogenuri alchilici, alogenuri acilici,
α-alogenochetoni, α-alogenoesteri
altri esempi (che si possono usare anche nella sintesi acetoacetica):
O
R-X = α,ω-dialogenoalcani
C
C
C
O
OCH2CH3
+
O
CH3CH2
O-
Na+
C
OCH2CH3
OCH2CH3
O
C C
:CH
:CH
Br ( CH2)n Br
C
C
O
O
OCH2CH3
OCH2CH3
O
2) H+
OH
O
OH
C
C
CH ( CH2 )n CH
C
C
O
O
OH
OH
O
OCH2CH3
-C
: CH
O
OCH2CH3
a) in eccesso di estere
1) H2O, OH-
Na+
Δ
OCH2CH3
O
OCH2CH3
C
C
CH ( CH2 )n CH
C
C
O
O
OCH2CH3
OCH2CH3
O
O
HO
CH2 ( CH2)n CH2 C
C
OH
O
2 CO2
OCH2CH3
acido bicarbossilico
b) in quantità equimolari
O
OCH2CH3
C :CH Br ( CH )n Br
2
C
O
O
O
OCH2CH3
C
C
C
OCH2CH3
CH3CH2O-- O C OCH2CH3
C
CH ( CH2)n Br
:C ( C )n Br
C
C
O
O
OCH2CH3
OCH2CH3
O
OCH2CH3
(CH2)n
1) H2O, OH-
O
2) H+
OCH2CH3
O
C
C
C
OH
(CH2)n
Δ
OH
(CH2)n C
CO2
OH
C
n = 2,3,4,5
O
acidi cicloalcancarbossilici
35
CHIMICA ORGANICA I
Corso di laurea in CHIMICA, CHIMICA APPLICATA, SCIENZA DEI MATERIALI
Esercitazione n. 17 - Reazioni di acidi carbossilici e derivati.
TERMINI ED ARGOMENTI DA CONOSCERE PER LO SVOLGIMENTO DEGLI ESERCIZI DI QUESTO
FOGLIO: Meccanismo di sostituzione nucleofila al carbonio acilico. Reazioni degli acidi carbossilici: riduzione,
conversione in alogenuri acilici, in anidridi, in esteri (formazione di lattoni e lattidi), in ammidi (formazione di
lattami). Reazioni degli alogenuri acilici: conversione in acidi, in anidridi, in esteri, in ammidi, in tioesteri; riduzione
(con LiAlH4 e con H2, Pd/BaSO4). Reazioni delle anidridi: conversione in acidi carbossilici, in esteri, in ammidi ed
immidi. Reazioni degli esteri: idrolisi acida e basica; transesterificazione; conversione in ammidi; riduzione. Reazioni
delle ammidi: idrolisi basica ed acida; conversione in nitrili, in ammine (riduzione,). Reazioni dei nitrili: idrolisi acida,
riduzione.
Reazioni specifiche delle singole classi: acidi carbossilici (α-alogenazione; reazione con diazometano; reazione con
DCC); cloruri acilici (reazioni con composti organometallici [reattivi di Grignard, cadmioorganici]; esteri (reazione
con i reattivi di Grignard, condensazione di Claisen); ammidi (trasposizione di Hofmann).
Reazioni di decarbossilazione. Uso degli esteri acetoacetico (= 3-ossobutanoato) e malonico (= propandioato) nella
sintesi organica.
PER RICORDARE LE REAZIONI
1. Scrivere i prodotti (specificandone il nome) che si ottengono quando l'acido butanoico viene fatto
reagire con ciascuno dei seguenti composti: a) LiAlH4 e poi acqua; b) cloruro di benzoile; c)
etanolo, in ambiente acido; d) metanammina e poi riscaldamento.
2. Scrivere i prodotti (specificandone il nome) che si ottengono quando il cloruro di acetile viene
fatto reagire con ciascuno dei seguenti composti: a) ammoniaca (eccesso); b) acqua; c) 1-butanolo,
in presenza di piridina; d) toluene + AlCl3; e) H2 e Pd disattivato; f) metanammina (eccesso); g)
anilina (eccesso); h) dimetilammina (eccesso); i) etantiolo, in presenza di piridina; j) acetato di
sodio; l) acido acetico; m) fenolo, in presenza di piridina.
3. Scrivere i prodotti (specificandone il nome) che si ottengono quando l'anidride acetica viene fatta
reagire con ciascuno dei seguenti composti: a) ammoniaca (eccesso); b) acqua; c) 1-propanolo; d)
benzene + AlCl3; e) etanammina (eccesso); f) dietilammina (eccesso); g) cicloesanolo; h) pbromofenolo; i) piperidina (azacicloesano); j) etossido di sodio in etanolo.
4. Scrivere le reazioni del cloruro di benzoile con ciascuno dei reagenti dell’Esercizio precedente.
5. Scrivere i prodotti (specificandone il nome) che si ottengono quando il propanoato di etile viene
fatto reagire con ciascuno dei seguenti composti: a) acqua, H+; b) acqua e OH-; c) 1-ottanolo + HCl;
d) metossido di sodio; e) metanammina; f) LiAlH4 e poi acqua.
6. Scrivere i prodotti (specificandone il nome) che si ottengono quando la propanammide viene fatta
reagire con ciascuno dei seguenti composti: a) acqua ed acido; b) acqua e OH-; c) LiAlH4 e poi
acqua.
7. Scrivere i prodotti di esterificazione di: a) acido p-metilbenzoico con 2-propanolo; b) acido pbenzendioico con etanolo (in eccesso); c) acido acetico con (R)-2-butanolo.
8. Scrivere la reazione di esterificazione acido catalizzata che porta ai seguenti esteri, suggerendo un
modo per portare la reazione a completamento: a) o-idrossibenzoato di metile; b) metanoato di
metile (punto di ebollizione, 32°C); c) benzoato di etile.
9. Scrivere i prodotti (specificandone il nome) che si formano per riscaldamento di: a) acido
propandioico; b) acido 2-metil-3-ossobutanoico; c) acido 2-etil-3-ossopentanoico; d) acido 5ossoesanoico.
10. Completare le seguenti reazioni: a) acido benzoico + 2-propanolo, in ambiente acido, a caldo; b)
acido benzoico + 1,2-etandiolo, in ambiente acido, a caldo; c) acido formico (metanoico) +
cicloesanolo, in ambiente acido; d) acido benzoico + (S)-2-pentanolo, in ambiente acido.
11. Completare le seguenti reazioni: a) soluzione concentrata di acido 10-idrossidecanoico, in
ambiente acido, a caldo; b) soluzione diluita di acido 10-idrossidecanoico, in ambiente acido, a
caldo; c) acido o-benzendioico + anidride benzoica; d) 3-ossobutanoato di etile + acqua, in ambiente
acido.
12. Completare le seguenti reazioni, specificando i nomi dei composti organici che si ottengono: a)
benzoato di fenile + metossido di sodio; b) cloruro di propanoile + metanammina; c) anidride
acetica + metanolo; d) acido benzoico + cloruro di tionile (SOCl2); e) propanoato di isopropile +
acqua, in ambiente acido; f) acido propanoico + metanolo, in ambiente acido; g) acetanilide + acqua,
in ambiente basico; h) anidride butandioica + ammoniaca (due equivalenti); i) 1-naftalenammina +
anidride acetica, in presenza di piridina.
13. Scrivere i prodotti che si ottengono per riscaldamento, in ambiente acido, dei seguenti composti:
a) acido ossalico (= acido etandioico); b) acido acetoacetico (= acido 3-ossobutanoico); c) acido
lattico (= acido 2-idrossipropanoico); d) acido ftalico (= acido o-benzendioico); e) acido 2idrossibutanoico; f) acido 3-idrossibutanoico; g) acido 4-idrossibutanoico; h) acido malonico (=
acido propandioico); i) acido 2-amminopentanoico; l) acido 3-amminopentanoico; m) acido 4amminopentanoico; n) acido piruvico (= acido 2-ossopropanoico).
14. Completare le seguenti reazioni, specificando i nomi dei composti organici che si ottengono: a)
cloruro di propanoile + diallil cadmio; b) cloruro di propanoile + diisopropil cuprato di litio; c)
cloruro di butanoile + dipropil cadmio.
15. Scrivere i prodotti (specificandone il nome) che si ottengono quando il cloruro di acetile viene
fatto reagire con ciascuno dei seguenti composti: a) ioduro di isopropilmagnesio e poi acqua ed
acido; b) difenil cadmio; c) dietilcuprato di litio.
PER CAPIRE LE REAZIONI (MECCANISMI)
16. Scrivere il meccanismo delle sostituzioni nucleofile al carbonio acilico che portano: a) al
benzoato di etile dal cloruro di benzoile; b) all'N-metiletanammide dal cloruro di acetile (= etanoile).
17. Scrivere il meccanismo della reazione acido-catalizzata dell'acido acetico con etanolo.
18. a) Quando l'acido maleico (= cis-butendioico) viene scaldato a 200°C, perde una molecola di
acqua e si trasforma in anidride maleica (= cis-butendioica). Il diastereomero dell'acido maleico,
l'acido fumarico, richiede una temperatura molto più alta per disidratarsi e quando lo fa, dà anch'esso
anidride maleica. Spiegare. b) L'acido o-benzendioico, scaldato a 200°C, forma un'anidride ciclica.
Quale ne è la struttura?
19. a) Perché il cloruro di benzoile è meno reattivo di altri alogenuri acilici (per esempio, cloruro di
butanoile) con i nucleofili? b) Perché non si può preparare un cloruro acilico da un acido e HCl? c)
Scrivere il meccanismo della reazione del cloruro di butanoile con il fenolo, in presenza di piridina.
20. Scrivere le equazioni chimiche per le reazioni dei seguenti derivati di acidi carbossilici con
NaOH acquoso, indicandone l'ordine di reattività; benzoato di etile, N-etilbenzammide, cloruro di
benzoile, anidride benzoica propanoica.
21. Scrivere equazione chimica e meccanismo per l'idrolisi basica del benzoato di metile; spiegare
l'ordine di reattività dei seguenti composti nell'idrolisi basica: benzoato di metile, p-bromobenzoato
di metile, p-nitrobenzoato di metile.
22. a) Scrivere il meccanismo di idrolisi basica degli esteri. Noto questo, si chiede se è possibile
esterificare un acido carbossilico in soluzione basica. b) Prevedere, spiegando, l'ordine di reattività
dei seguenti esteri nell'idrolisi basica: acetato di etile, 2-ossopropanoato di etile, 2-metilpropanoato
di etile.
23. Conoscendo il meccanismo di idrolisi basica degli esteri, si chiede se, partendo dal benzoato di
sec-butile di configurazione S, l'alcool che si forma dall'idrolisi ha subito racemizzazione, inversione
o ritenzione della configurazione. Spiegare.
24. Il benzoato di etile viene trattato con una soluzione acquosa di acido solforico. a) Scrivere
l'equazione chimica ed il meccanismo della reazione, mettendo in evidenza il ruolo dell'ambiente
acido. b) Spiegare l'ordine di reattività che si osserva sottoponendo ad idrolisi acida: benzoato di
etile, p-nitrobenzoato di etile, p-metossibenzoato di etile.
25. Scrivere i meccanismi delle seguenti reazioni: a) cloruro di benzoile + ammoniaca (in eccesso);
b) cloruro di esanoile + cicloesanammina (in eccesso).
26. a) Scrivere l'equazione chimica ed il meccanismo della reazione che avviene trattando il
propanoato di etile con etossido di sodio in etanolo. b) Dire se il 2,2-dimetilpropanoato di etile è più
o meno reattivo del propanoato di etile nella stessa reazione e spiegare perché.
27. a) Scrivere il meccanismo della reazione del cloruro di propanoile con bromuro di
fenilmagnesio. b) Scrivere il meccanismo della reazione del cloruro di propanoile con dietilcadmio;
c) il prodotto della reazione (b) si ottiene anche trattando il cloruro di propanoile con dietilcuprato di
litio: scrivere un meccanismo plausibile.
PER APPLICARE LE REAZIONI STUDIATE
28. Indicate come potete preparare i seguenti esteri, a partire da un cloruro acilico ed un alcool: a)
propanoato di etile; b) 3-metilesanoato di fenile; c) benzoato di benzile; d) cicloesancarbossilato di
ciclopropile.
29. Indicare come, partendo dagli opportuni cloruri acilici ed ammine si possano preparare le
seguenti ammidi: a) N,N-dimetiletanammide; b) acetanilide (= N-feniletanammide); c)
cicloesancarbammide.
30. Indicare come si possono sintetizzare i seguenti composti, (1) a partire da cloruro di benzoile e
tutti i reagenti necessari, (2) a partire da acido benzoico e tutti i reagenti necessari: a) N,Ndimetilbenzammide; b) benzoato di isopropile; c) benzoato di metile.
31. Scrivere le reazioni con cui è possibile trasformare l'etanoato di metile in: a) acido acetico; b)
etanolo; c) acetato di sodio; d) alcool terz-butilico; e) N-metiletanammide.
32. Indicate come si possa ottenere: a) l'acido esanoico dall'1-bromopentano; b) l'acido 2idrossiesanoico dal pentanale; c) l'N-metil-N-cicloesiletanammide dall'acido acetico.
33. Mostrare come si possono preparare i seguenti composti, a partire dagli opportuni cloruri acilici
e composti organometallici: a) 1-fenil-1-pentanone; b) 2-fenil-2-propanolo.
34. Gli acidi carbossilici reagiscono con due equivalenti di composto litioorganico, dando chetoni.
a) Scrivere un meccanismo plausibile per la reazione; b) scrivere la reazione dell'acido benzoico con
etillitio.
35. Mostrare come i seguenti chetoni si possano ottenere dagli acidi indicati: a) 1-fenil-1-propanone
da acido propanoico (due modi, uno dei quali un'acilazione di Friedel-Crafts); b) cicloesil metil
chetone, da acido cicloesancarbossilico.
36. Scrivere le reazioni che, partendo dagli opportuni alogenuri alchilici e cloruri acilici portano ai
seguenti chetoni, utilizzando cadmio-organici e/o cuprati: a) fenil isopropil chetone; b)
acetilcicloesano; c) 2,2-dimetil-3-pentanone; d) 2-fenil-4-metil-3-pentanone; e) 1-fenil-2-butanone;
f) 2-metil-3-pentanone; g) 1-fenil-2,2,4-trimetil-3-pentanone.
.
37. Un doppio legame coniugato con un carbonile aldeidico o chetonico può subire attacco da parte
di un reattivo di Grignard sulla posizione β. Che prodotti vi aspettate per reazione dell'acido 2pentenoico con bromuro di fenilmagnesio? [non siate precipitosi...].
38. Scrivere le reazioni che permettono di ottenere i seguenti alcooli, a partire dal propanoato di
metile: a) 2-metil-2-butanolo; b) 3-etil-3-pentanolo; c) 1,1-difenil-1-propanolo; d) 3-etil-2,4-dimetil3-pentanolo.
39. Mostrare come si possano effettuare le seguenti trasformazioni: a) da trans-1-bromo-2-butene ad
acido trans-3-pentenoico (due modi); b) da acido pentanoico a pentanoato di metile (due modi); c)
da 2-butenale ad acido 2-butenoico; d) da acido esanoico ad esanale; e) da 3-esene ad acido
propanoico (suggerimento: riguardare le reazioni degli alcheni...); f) da acido ciclopentancarbos-
silico a ciclopentilmetanolo; g) da acido 3-fenilpropanoico ad acido 2-ammino3-fenilpropanoico; h)
da 2-feniletanolo ad acido 3-fenilpropanoico; i) da metilenecicloesano ad acido 1metilcicloesancarbossilico; j) da metilenecicloesano ad acido cicloesiletanoico; k) da etanoato di
etile a 3-metil-3-pentanolo; l) da bromocicloesano a dicicloesilmetanolo; m) da metossibenzene a pmetossibenzammide.
40. Completare le seguenti reazioni, specificando i reagenti che occorrono per ciascuna trasformazione: a) alcool benzilico → cloruro di benzile → fenilacetonitrile → acido fenilacetico; b) cloruro
di terz-butile → cloruro di terz-butil magnesio → acido 2,2-dimetilpropanoico; c) 1-pentanolo →
acido pentanoico; d) 1-pentanolo → acido esanoico.
41. Per trasformare ciascuno dei seguenti composti nei prodotti richiesti, è necessaria una serie di
reazioni. Alcuni dei prodotti delle reazioni intermedie sono indicati, altri no. Scrivere le reazioni ed i
reagenti: a) 1-esanolo ad acido eptanoico, attraverso l'eptanonitrile; b) 1-esanolo ad acido 2metilesanoico, attraverso il 2-cloroesano.
42. Scrivere i prodotti (specificandone il nome) che si ottengono quando l'acido butanoico viene
fatto reagire con ciascuno dei seguenti composti: a) PBr3 e bromo; b) dicicloesilcarbodiimmide e
poi etanammina; c) diazometano
43. Scrivere il meccanismo della reazione dell'acido propanoico con Br2, PBr3.
44. Scrivere equazione chimica e meccanismo della reazione tra butanammide ed ipobromito di
sodio (trasposizione di Hofmann). b) Il composto ottenuto in (a) si può avere anche per riduzione
dell'opportuno nitrile: scrivere la reazione corrispondente.
45. Scrivere le equazioni chimiche relative alle seguenti reazioni: a) acido propanoico + bromo e
PBr3; b) il composto (a) + ammoniaca (eccesso).
46. Completare le seguenti reazioni, specificando il nome dei prodotti organici: a) 3-fenilpropanoato
di argento + Br2, sottoposto a riscaldamento; b) ciclobutancarbossilato di piombo + I2, sottoposto a
riscaldamento; c) decanoato d'argento + bromo, a caldo; e) acido cicloottancarbossilico + ossido di
mercurio + bromo (suggerimento: prima far reagire HgO con l'acido). Scrivere il meccanismo in un
caso.
47. Scrivere il meccanismo della decarbossilazione dell'acido 2-etilpropandioico.
48. Completare le seguenti serie di reazioni, specificando i nomi dei composti organici che si
ottengono: a) acido acetico + SOCl2 → A; A + 2-propanammina → B. b) Acido cicloesancarbossilico + PCl3 → C; C + 2-butanolo → D. c) Acido 2-etilpentanoico + SOCl2 → E; E + metantiolo
F. d) Malonato dietilico (= propandioato dietilico) + acqua e acido → G; G sottoposto a riscaldamento → H. e) Anidride butandioica + metanolo (un equivalente) → I; I + SOCl2 → J; J + fenolo,
in presenza di piridina → K.
49. Scrivere i risultati attesi per la reazione di ciascuna delle seguenti molecole (o combinazioni di
molecole) con etossido di sodio in etanolo: a) butanoato di etile; b) 3-fenilbutanoato di etile; c) 3fenil-2-metilpropanoato di etile; d) esandioato dietilico; e) feniletanoato di etile + metanoato di etile;
f) benzoato di etile + butanoato di etile.
50. Come è possibile preparare i seguenti chetoni, servendosi della sintesi con l'estere acetoacetico?
a) 5-metil-2-esanone; b) ciclobutil metil chetone; c) 3-benzil-5-esen-2-one.
51. Come è possibile preparare i seguenti acidi, servendosi della sintesi con il malonato dietilico? a)
acido ciclopentancarbossilico; b) acido ottandioico; c) acido butandioico; d) acido 2-benzilesanoico.
52. Preparare i seguenti composti ( a partire dal malonato dietilico o dall'estere acetoacetico): a)
acido 2-metilbutandioico; b) 4-fenil-2-butanone; c) acido 3-ciclopentilpropanoico; d) acido 2-(3ossociclopentil)etanoico.
53. Come si può ottenere, dall'estere acetoacetico, il 3-chetoestere 1-acetilciclopentancarbossilato di
etile?
54. I seguenti chetoni non possono essere sintetizzati con il metodo dell'estere acetoacetico
(perché?), ma si possono preparare con una variante che prepara (condensazione di Claisen) ed
utilizza un 3-chetoestere opportuno, RCOCH2CO2CH2CH3, dove R è il gruppo che compare nel
chetone finale. Preparare i seguenti chetoni ed i 3-chetoesteri necessari per la loro sintesi: a) 3pentanone: b) 1-fenil-2-metil-3-esanone.
55. Completare le seguenti reazioni, scrivendo le strutture per ciascuno dei composti indicati: a)
estere malonico (in eccesso) con etossido di sodio e 1,2-dibromoetano → C16H26O8; b) C16H26O8
con etossido di sodio e 1,2-dibromoetano → C18H28O8; c) C18H28O8 + OH-, poi H+ ed infine
riscaldamento → C8H12O4.
56. Dalle bottiglie che contenevano tre composti, un acido carbossilico e due esteri, di formula
molecolare C5H10O2, si sono staccate le etichette. I composti sono stati provvisoriamente chiamati
A, B e C e si sono fatti gli spettri riportati di seguito. Sulla base degli spettri, identificate i composti
e ... rimettete a posto le etichette.
A:
B:
C:
Esercitazione n. 17 - Reazioni e meccanismi di acidi carbossilici
e derivati.
1. Scrivere i prodotti (specificandone il nome) che si ottengono quando l'acido
butanoico viene fatto reagire con ciascuno dei seguenti composti:
a) LiAlH4 e poi acqua
OH
1. LiAlH4
CH3 CH2 CH2 C
CH3 CH2 CH2 CH2 OH
2. H2O
O
1-butanolo
b) cloruro di benzoile
Cl
C
..
OH
CH3 CH2 CH2 C
+
O
O
CH3 CH2 CH2 C
O C
O
O
anidride benzoica butanoica
c) etanolo, in ambiente acido
OH
CH3 CH2 CH2 C
+ CH3 CH2 OH
H+
O
CH3 CH2 CH2 C
O CH2 CH3
butanoato di etile O
+ H2O
d) metanammina e poi riscaldamento
OH
CH3 CH2 CH2 C
O
O-
+ CH3 NH2
CH3 CH2 CH2 C
+
CH3 NH3
O
butanoato di metilamonio
O
+ 2 CH3 CH2 CH2 CH2 NH2
CH3 C Cl
Δ
O
CH3 CH2 CH2 C
NH CH3
N-metilbutanammide
2. Scrivere i prodotti (specificandone il nome) che si ottengono quando il
cloruro di acetile viene fatto reagire con ciascuno dei seguenti composti:
a) ammoniaca (eccesso)
O
O
CH3 C NH2 + NH4Cl
CH3 C Cl + NH3 (eccesso)
etanammide
(acetammide)
b) acqua
O
O
CH3 C OH
CH3 C Cl + H2O
+ HCl
acido butanoico
c) 1-butanolo, in presenza di piridina
O
N
CH3 C Cl + CH3 CH2 CH2 CH2 OH
CH3 C
O CH2 CH2CH2 CH3
O etanoato di butile
(acetato di butile)
+N Cl
H
1
Non vi sarete già dimenticati le sostituzioni
elettrofile aromatiche. Vero?!?!
d) toluene + AlCl3
O
CH3 C
Cl + AlCl3
CH3
O
O +
CH3 CH3
C
O
AlCl3
CH3 C Cl +
+
CH3 C
CH3
C
O
+
H3C
HCl
(o-metilfenil)etanone
metil (o-metilfenil) chetone
e) H2 e Pd disattivato
-
AlCl4
O
CH3 C Cl + H2
(p-metilfenil)etanone
metil (p-metilfenil) chetone
O
Pd disatt.
CH3 C H
etanale (aldeide acetica)
f) metanammina (eccesso)
O
CH3 C Cl
+ 2 CH3 CH2 CH2 CH2 NH2
g) anilina (eccesso)
O
NH2
CH3 C
CH3 C Cl + 2
+ NH
O
NH
3
Cl-
+
N-feniletanammide
h) dimetilammina (eccesso)
O
CH3
CH3 C Cl + 2 CH3 NH
O
CH3 C
CH3
+
N CH3
CH3
CH3
+
NH2 Cl
N,N-dimetiletanammide
i) etantiolo, in presenza di piridina
O
CH3 C Cl + CH3 CH2 SH
N
CH3 C
S CH2 CH3
O
+
+
N H
Cl-
etantioato di metile
2
j) acetato di sodio; l) acido acetico
OCH3 C
Na+
O
O
CH3 C Cl
OH
O
O
(+ NaCl)
CH3 C O C CH3 anidride etanoica (anidride acetica)
CH3 C
(+ HCl)
O
m) fenolo, in presenza di piridina
OH
O
O
N
CH3 C Cl +
CH3 C
+
O
+
N H
Cl-
etanoato di fenile
n) bromuro di isopropilmagnesio e poi acqua
O
CH3 C Cl
1. (CH3)2CHMgBr
2. H2O
OH
CH3
CH3 C CH
CH CH3
H3C
CH3
2,3,4-trimetil-3-pentanolo
o) idruro di litio e alluminio e poi acqua
O
1. LiAlH4
CH3 C Cl
CH3 CH2 OH
etanolo
p) difenilcadmio
O
Cd
CH3 C Cl
O
CH3 C
+
feniletanone
fenil metil chetone
q) dietilcuprato di litio
O
O
CH3 C Cl
+ [(CH3CH3)2Cu]Li
CH3 C CH2 CH3
butanone
3
3. Scrivere i prodotti (specificandone il nome) che si ottengono quando
l'anidride acetica viene fatta reagire con ciascuno dei seguenti composti:
a) ammoniaca (eccesso)
O
O
O
O
CH3 C NH2
CH3 C O C CH3 + 2 NH3
+ CH3 C
O
-+
NH4
etanammide
b) acqua
O
O
2 CH3 C
CH3 C O C CH3 + H2O
OH acido etanoico
acido acetico
O
c) 1-propanolo
O
O
CH3 C O C CH3 + CH3 CH2 CH2 OH
CH3 C
O
O CH2 CH2CH3
+ CH3 C
O
OH
etanoato di propile
d) benzene + AlCl3
O
O
CH3 C O C CH3 +
+
CH3 C
AlCl3
O + [(CH3CO2)AlCl3]
O
O
O
C
AlCl3
CH3 C O C CH3 +
O
CH3
+ CH3 C OH
feniletanone
e) etanammina (eccesso)
O
O
O
O
CH3 C O C CH3 + 2 CH3CH2 NH2
CH3 C
CH
NH CH2CH3
C
O
-
+ CH 3
NH3
3 CH2
+
N-etiletanammide
f) dietilammina (eccesso)
O
O
CH CH
3
CH3 C O C CH3 + 2
2
NH
CH3 CH2
O
CH3 C
N
O
CH2 CH3
CH2CH3 + CH3 C O- +NH2
CH2 CH3
CH2 CH3
N,N-dietiletanammide
4
g) cicloesanolo
O
OH
O
O
CH3 C O C CH3 +
CH3 C
O
+ CH3 C OH
O
etanoato di cicloesile
h) p-bromofenolo
O
O
CH3 C O C CH3
O
OH
+
CH3 C
O
Br + CH3 C OH
O
Br
etanoato di p-bromofenile
i) piperidina (azacicloesano)
O
O
O
CH3 C O C CH3 +
CH3 C
N
H
+ CH3CO2H
N
1-acetilazacicloesano
j) etossido di sodio in etanolo
O
O
O
CH3 C O C CH3 + CH3 CH2 O
- +Na CH3 CH2 OH
CH3 C
O
-+
+ CH3 C O Na
O CH2 CH3
etanoato di etile
4. Scrivere le reazioni del cloruro di benzoile con ciascuno dei reagenti
dell’ Esercizio precedente.
a) ammoniaca (eccesso)
O
C
O
C
Cl + 2 NH
3
NH2
+ Cl +NH4
benzencarbammide
b) acqua
O
C
Cl
+ H2O
O
C
OH
+ HCl
acido benzencarbossilico
acido benzoico
5
c) 1-propanolo
O
C
Cl
O
C
+ CH3 CH2 CH2 OH
O CH2 CH2 CH3 + HCl
benzencarbossilato di propile
benzoato di propile
d) benzene + AlCl3
O
C
O
Cl
C
AlCl3
+
+ HCl
difenil chetone
e) etanammina (eccesso)
O
C
O
C
Cl + 2 CH3 CH2 NH2
+
+ CH3 CH2 NH3 Cl
NH CH2 CH3
N-etilbenzenammide
f) dietilammina (eccesso)
O
C
Cl + 2
CH3 CH2
CH3
O
C
NH
CH2
N
CH2CH3
CH2 CH3
+ Cl- + NH2
CH2 CH3
CH2CH3
N,N-dietilbenzenammide
g) cicloesanolo
O
C
O
C
OH
Cl +
O
O
+
CH3 C OH
benzoato di cicloesile
h) p-bromofenolo
O
C
OH
Cl
+
O
C
O
O
Br
+ CH3 C OH
Br
benzoato di p-bromofenile
6
i) piperidina (azacicloesano)
O
C
O
C
Cl + 2
+
N
N
H
+N
H
Cl-
H
1-benzoilazacicloesano
j) etossido di sodio in etanolo
O
C
Cl
+ CH3 CH2 O- +Na
O
C
CH3 CH2 OH
O CH2 CH3
Cl- +Na
benzoato di etile
5. Scrivere i prodotti (specificandone il nome) che si ottengono quando il
propanoato di etile viene fatto reagire con ciascuno dei seguenti composti:
a) acqua, H+
H+
O
O
CH3 CH2 C OH
CH3CH2 C O CH2 CH3 + H2O
+ CH3 CH2 OH
acido propanoico
b) acqua e OH-
O
CH3 CH2 C O CH2 CH3 + H2O
-OH
O
CH3 CH2 C O -
+ CH3 CH2 OH
propanoato
c) 1-ottanolo + HCl
O
CH3 CH2 C O CH2 CH3 + CH3 CH2CH2 CH2 CH2 CH2 CH2 CH2 OH
H+
O
CH3 CH2 C O CH2 CH2 CH2 CH2CH2 CH2 CH2 CH3 + CH3 CH2 OH
propanoato di ottile
7
d) metossido di sodio
O
-+
CH3CH2 C O CH2 CH3 + CH3 O Na
O
-+
CH3 CH2 C O CH3 + CH3CH2 O Na
propanoato di metile
e) metanammina
O
O
CH3 CH2 C O CH2 CH3 + CH3 NH2
+ CH3 CH2 OH
CH3 CH2 C NH CH3
N-metilpropanammide
e’) bromuro di fenilmagnesio e poi acqua
MgBr
O
OH
1.
CH3 CH2 C O CH2 CH3
CH3 CH2 C
2. H2O, H+
+
CH3 CH2 OMgBr
1,1-difenil-1-propanolo
f) LiAlH4 e poi acqua
O
CH3 CH2 C O CH2 CH3
1. LiAlH4
CH3 CH2 CH2 OH + CH3 CH2 OH
2. H2O
1-propanolo
6. Scrivere i prodotti (specificandone il nome) che si ottengono quando la
propanammide viene fatta reagire con ciascuno dei seguenti composti:
a) acqua ed acido
O
O
H+
CH3 CH2 C NH2 + H2O
+
CH3 CH2 C OH + NH4
acido propanoico
b) acqua e OH-
O
CH3 CH2 C NH2 + H2O
-OH
O
CH3 CH2 C O - + NH3
propanoato
b’) anidride fosforica, a caldo
O
CH3 CH2 C NH2
c) LiAlH4 e poi acqua
O
CH3 CH2 C NH2
bromo in ambiente basico
O
CH3 CH2 C NH2
P 2 O5
Δ
1. LiAlH4
2. H2O
Br2, NaOH
CH3 CH2 C N + H2O
propanonitrile
CH3 CH2 CH2 NH3
1-propanammina
CH3 CH2 NH3 etanammina
8
7. Scrivere i prodotti di esterificazione di:
a) acido p-metilbenzoico con 2-propanolo
O OH
C
OH
+
O
H+
C
O
CH3 CH CH3
CH3
CH CH3
CH3
CH3
b) acido p-benzendioico con etanolo (in eccesso)
O
C
O
OH
H+
C
O CH2 CH3
+ 2 H2O
+ 2 CH3 CH2 OH
O
C
C
O
OH
O CH2 CH3
c) acido acetico con (R)-2-butanolo.
O
CH3 C OH +
O
OH
H3C
CH2 CH3
H (R)
CH3 C
H+
O
H3C
CH2 CH3 + H O
2
H (R)
8. Scrivere la reazione di esterificazione acido catalizzata che porta
ai seguenti esteri, suggerendo un modo per portare la reazione a
completamento:
a) o-idrossibenzoato di metile
O
C
O
OH
OH
+ CH3 OH
H+
C
O CH3
OH
+ H2O
usare CH3OH come solvente
b) metanoato di metile (punto di ebollizione, 32°C)
O
H
H+
C OH + CH3 OH
p.e. 101°C
O
H
C O CH3 + H2O
fare la reazione a 32-33°C
p.e. 65°C
c) benzoato di etile
O
C
H+
OH + CH CH OH
3
2
O
C
O CH2 CH3
+ H2O
usare etanolo come solvente
9
9. Scrivere i prodotti (specificandone il nome) che si formano per
riscaldamento di:
a) acido propandioico
Δ
O
HO
C CH2 C
OH
O
O
acido etanoico (acetico)
CH3 C
OH
CO2
b) acido 2-metil-3-ossobutanoico
Δ
O
H3 C
C CH C
O CH3 OH
CO2
O
CH3CH2 C
CH3
butanone
c) acido 2-etil-3-ossopentanoico
O
O
Δ
O
CH3CH2 C CH C
CH2 OH
CH3
CH3CH2 C CH2 CH2 CH3
3-esanone
CO2
d) acido 5-ossoesanoico
Δ
O
CH3 C CH2 CH2 CH2 C
OH
O
non è un β-chetoacido
10. Completare le seguenti reazioni:
a) acido benzoico + 2-propanolo, in ambiente acido, a caldo
CO2H
O
OH
+ CH3 CH CH3
H+
Δ
CH3
CH
O
CH3
b) acido benzoico + 1,2-etandiolo, in ambiente acido, a caldo
CO2H
CO2H
OH
+ CH CH
2
2
OH
O
H+
Δ
O
OH
CH2 CH2
O
O
O
CH2 CH2
O
H+ Δ
10
c) acido formico (metanoico) + cicloesanolo, in ambiente acido
O
OH
H
O
H
OH
O
H+
+
Δ
d) acido benzoico + (S)-2-pentanolo, in ambiente acido
CO2H
CH2CH2CH3
CH2CH2CH3 H+
H
C
O
H
C
OH
+
3
3
Δ
H
H
O
11. Completare le seguenti reazioni:
a) soluzione concentrata di acido 10-idrossidecanoico, in ambiente acido,
a caldo
10
1 OH
HO
O
O
O
O
HO
OH
O
O n
b) soluzione diluita di acido 10-idrossidecanoico, in ambiente acido, a caldo
10
10
1
O
OH
HO
1
O
O
c) acido o-benzendioico + anidride benzoica
O
O
OH
+
OH
O
O
O
OH
O
O
CO2H
O
+
O
d) 3-ossobutanoato di etile + acqua, in ambiente acido
O
O
+ H2 O
OCH2CH3
H+
Δ
O
O
OH
+ CH3CH2OH
11
12. Completare le seguenti reazioni, specificando i nomi dei composti
organici che si ottengono:
a) benzoato di fenile + metossido di sodio
O
O-
O
O
O
+ CH3O(Na+)
CH3
(Na+)
+
benzencarbossilato
di metile
fenato di sodio
(o fenossido di sodio)
b) cloruro di propanoile + metanammina
O
CH3 CH2 C Cl + CH3 NH2
O
CH3 CH2 C NH CH3
+
+NH Cl4
N-metilpropanammide
c) anidride acetica + metanolo
O
CH3 CH2 C
CH3 CH2 C
O
O
O
CH3 CH2 C O CH3
+ CH3 OH
O
+ CH3 CH2 C OH
propanoato di metile
acido propanoico
d) acido benzoico + cloruro di tionile (SOCl2)
O
C
OH
O
C
+ SOCl2
Cl
+ SO +
2
HCl
cloruro di benzencarbonile
(cloruro di benzoile)
e) propanoato di isopropile + acqua, in ambiente acido
O
O
CH3
H+
CH3 CH2 C OH
CH3 CH2 C O CH + H2O
CH3
+
acido propanoico
CH3
HO CH
CH3
2-propanolo
f) acido propanoico + metanolo, in ambiente acido
O
CH3 CH2 C OH
+ CH3 OH
g) acetanilide + acqua, in ambiente basico
H
N
C
O
CH3
+ H2O
-OH
H+
O
CH3 CH2 C O CH3 + H2O
propanoato di metile
NH2
+
benzenammina
(anilina)
O
CH3 C O acetato
12
h) anidride butandioica + ammoniaca (due equivalenti)
O
O
O
+ 2
O
C
NH3
CH2 CH2 C
H2 N
O
O- + NH4
3-carbammoilpropanoato di ammonio
i) 1-naftalenammina + anidride acetica, in presenza di piridina
NH2
O
CH3 C
+
CH3 C
O
HN
O
C
N
CH3
O
CH3 C O-
+
O
N-(1-naftil)acetammide
N+
H
acetato di piridinio
13. Scrivere i prodotti che si ottengono per riscaldamento, in ambiente acido,
dei seguenti composti:
a) acido ossalico (= acido etandioico)
CO2H
CO2H
H+
Δ
CO2
O
+ H C
OH
b) acido acetoacetico (= acido 3-ossobutanoico)
O
O
CH3 C CH2 C
OH
H+
Δ
O
CO2 +
CH3 C CH3
c) acido lattico (= acido 2-idrossipropanoico)
2
OH O
H+
CH3 CH C
α
OH Δ
O
CH3
CH C
O
O
+ 2 H2O
C CH
CH3
O
13
d) acido ftalico (= acido o-benzendioico)
O
O
H+
OH
OH
O + H2O
Δ
O
O
e) acido 2-idrossibutanoico
O
OH
CH3 CH CH2 C
β
OH
O
+
CH3 CH CH C
OH
H+
Δ
H2O
f) acido 3-idrossibutanoico
O
OH
CH3 CH CH2 C
β
OH
O
+
CH3 CH CH C
OH
H+
Δ
H2O
g) acido 4-idrossibutanoico
O
OH
O
CH2 C
H+
CH2 CH2 CH2 C
γ
OH
+ H2O
O
CH2
Δ
CH2
h) acido malonico (= acido propandioico)
CO2H
CH2
CO2H
H+
CO2H
CH3
Δ
+ CO2
i) acido 2-amminopentanoico
2
NH2 O
CH3 CH2 CH2 CH C
OH
α
O
CH3 CH2CH2
CH C
+ 2 H 2O
HN
NH
C CH
CH2 CH2CH3
O
H+
Δ
l) acido 3-amminopentanoico
NH2
O
CH3CH2 CH CH2 C
OH
β
O
+ NH3
CH3 CH2 CH CH C
OH
H+
Δ
m) acido 4-amminopentanoico
NH2
CH3 CH CH2 CH2 C
γ
O
O
OH
H+
Δ
CH2 C
NH
CH2
+
H 2O
CH2
14
n) acido piruvico (= acido 2-ossopropanoico)
O
O
CH3 C C
OH
H+
Δ
O
CH3 C H + CO2
14. Scrivere i prodotti (specificandone il nome) che si ottengono quando il
cloruro di acetile viene fatto reagire con ciascuno dei seguenti composti:
a) ioduro di isopropilmagnesio e poi acqua ed acido
O
CH3 C Cl
1. (CH3)2CHMgBr
2. H2O
CH3
CH3 C CH
CH CH3
H 3C
CH3
2,3,4-trimetil-3-pentanolo
b) difenil cadmio
O
O
Cd
CH3 C Cl
OH
feniletanone
fenil metil chetone
CH3 C
+
c) dietilcuprato di litio
O
O
CH3 C Cl
+ [(CH3CH3)2Cu]Li
CH3 C CH2 CH3
butanone
15. Completare le seguenti reazioni, specificando i nomi dei composti
organici che si ottengono:
a) cloruro di propanoile + diallil cadmio
O
+ ( CH2 CH CH2) Cd
CH3 CH2 C
2
Cl
O
CH3 CH2 C CH2 CH CH2
5-esen-3-one
b) cloruro di propanoile + diisopropil cuprato di litio
O
CH3 CH2 C
O
+ [(CH3)2CH]2Cu-Li+
Cl
CH3 CH2 C CH CH3
CH3
2-metil-3-pentanone
c) cloruro di butanoile + dipropil cadmio
O
+
CH3 CH2 CH2 C
Cl
CH3CH2 CH2
Cd
CH3CH2 CH2
O
CH3 CH2 CH2 CH2 C CH2CH2 CH3
4-eptanone
15
16. Scrivere il meccanismo delle sostituzioni nucleofile al carbonio acilico
che portano:
a) al benzoato di etile dal cloruro di benzoile
O
C
Cl
O C O CH2 CH3
Cl
+
..
CH3 CH2 OH
O
C
O CH2 CH3
Cl-
b) all'N-metiletanammide dal cloruro di acetile (= etanoile).
O-
O
..
CH3 C Cl + CH NH
3
2
O
+
CH3 C NH3 CH3
Cl
+
CH3 C NH3 CH3
O
CH3 C NH CH3
H+
17. Scrivere il meccanismo della reazione acido-catalizzata dell'acido acetico
con etanolo.
+
O
O
CH3 C OH + H+
H
CH3 C OH
+
OH2
OH
CH3 C OH
CH3 C OH
+
H O CH2 CH3
O CH2 CH3
O
H
CH3 CH2 OH
CH3 C OH
+
+
O
H
O
H
H2O + CH C
CH3 C +
3
O CH2 CH3
O CH2 CH3
O
H+
+
CH3 C O CH2 CH3
16
18. a) Quando l'acido maleico (= cis-butendioico) viene scaldato a 200°C, perde una
molecola di acqua e si trasforma in anidride maleica (= cis-butendioica). Il
diastereomero dell'acido maleico, l'acido fumarico, richiede una temperatura molto
più alta per disidratarsi e quando lo fa, dà anch'esso anidride maleica. Spiegare.
O
H
H
H
C
O
C
OH
C
C
C
C
O
H
Δ
O
Δ
OH
OH
.
C
O
C
HO C C
H
HO C C
. H
O
O
O
H2O
H
OH
H
.
C
C
.
O
O
C
C
O
O
OH
Δ
O
OH
H2O
O
non può
ciclizzare
25. Scrivere i meccanismi delle seguenti reazioni:
a) cloruro di benzoile + ammoniaca (in eccesso)
O
C
OC
Cl + :NH
3
+
O
C
NH3
Cl
Cl-
NH3
O
C
:NH3
+
+NH
NH2
4
b) cloruro di esanoile + cicloesanammina (in eccesso).
..
OH2N
O
+
CH3 CH2 CH2CH2 CH2 C NH2
CH3 CH2 CH2CH2 CH2 C Cl +
Cl
Cl-
O
CH3 CH2 CH2CH2 CH2 C
H2N
+
NH2
+
O
CH3 CH2 CH2CH2 CH2 C
NH
NH3
26. a) Scrivere l'equazione chimica ed il meccanismo della reazione che
avviene trattando il propanoato di etile con etossido di sodio in etanolo.
equazione chimica:
O CH2 CH3
CH3 CH2 C
O
meccanismo:
O CH2 CH3
CH3 CH2 C
+ CH3 CH2 O
O
CH3 CH2 O-
CH3 O CH CH
2
3
CH3 CH2 C CH C
O
O
O CH2 CH3
CH3 CH C
O
O CH2 CH3
CH3 CH C
O-
17
O
CH3 CH C O CH2 CH3
CH3 CH2 C O CH2 CH3
OO
CH3 CH C O CH2 CH3
CH3 CH2 C
O CH2 CH3
O CH2 CH3
CH3 CH C
+ CH3 CH2 C
O
O
O
CH3 CH C O CH2 CH3
CH3 CH2 C O CH2 CH3
OCH3 CH2 O-
CH3 CH2 C
O
CH3 O
C C O CH2 CH3
-
O
b) Dire se il 2,2-dimetilpropanoato di etile è più o meno reattivo del propanoato di etile nella stessa reazione e spiegare perché.
CH3 O CH CH
2
3
CH3 C C
CH3 O
NON reagisce: manca dell’H alfa
27. Scrivere il meccanismo della reazione tra cloruro di metilpropanoile e
cicloesanolo.
: OH
O
CH3 CH C
CH3 Cl
O
O
+
OH
CH3 CH C
CH3
Cl
+
CH3 CH C
CH3
O
28. Indicate come potete preparare i seguenti esteri, a partire da un cloruro
acilico ed un alcool:
O
O
+ R'OH
R OR'
R
Cl
a) propanoato di etile
O
CH3 CH2 C Cl
O
CH3 CH2 C O CH2CH3
dal cloruro acilico
+ HO CH2CH3
dall'alcool
29. Indicare come, partendo dagli opportuni cloruri acilici ed ammine si
possano preparare le seguenti ammidi:
O
O
R
a) N,N-dimetiletanammide
O CH3
CH3 CH2 C N CH3
dal cloruro acilico dall'ammina
Cl
+
R'NH2
R
NHR'
O
CH2CH3
(eccesso)
CH3 CH2 C Cl + HN
CH2CH3
18
30. Indicare come si possono sintetizzare i seguenti composti, (1) a partire
da cloruro di benzoile e tutti i reagenti necessari, (2) a partire da acido
benzoico e tutti i reagenti necessari:
a) N,N-dimetilbenzammide
O
CH3
O N
CH3
C
(CH3)2NH
C
Cl
eccesso
Δ
O
C
O
O
C
OH
(CH3)2NH +
(CH3)2NH2+
+
O
(CH3)2NH
N
C
N
C
O
C NH
N
DCC
b) benzoato di isopropile
O
C
O
O
C
Cl
OH
CH3 CH CH3 +
CH CH3
CH3
O
C
OH
OH
CH3 CH CH3 + DCC +
c) benzoato di metile
O
C
O
Cl
+ CH3OH
C
O
CH3
O
C
OH
+
+ CH2 N N
19
31. Scrivere le reazioni con cui è possibile trasformare l'etanoato di metile in:
a) acido acetico
O
CH3 C OCH3
O
CH3 C OH
H2O, OH- e poi H+
(l'idrolisi acida è un equilibrio)
b) etanolo
O
CH3 C OCH3
LiAlH4 e poi H2O
CH3 CH2 OH
c) acetato di sodio
O
CH3 C OCH3
O
+
CH3 C O Na
H2O, OH-
d) alcool terz-butilico
O
CH3 C OCH3
OH
CH3 C CH3
CH3
CH3Li oppure CH3MgBr
e) N-metiletanammide
O
CH3 C OCH3
O
CH3 C NH CH3
CH3NH2
32. Indicate come si possa ottenere:
a) l'acido esanoico dall'1-bromopentano
O
CH3 CH2 CH2 CH2 CH2 C OH
CH3 CH2 CH2 CH2 CH2 Br
CH3 CH2 CH2 CH2 CH2 Br + -C N
CH3 CH2 CH2 CH2 CH2 Br
O
CH3 CH2 CH2 CH2 CH2 C OH
1 C in più
CH3 CH2 CH2 CH2 CH2 C N
H2O, H+
O
CH3 CH2 CH2 CH2 CH2 C OH
1.CO2
oppure
CH3 CH2 CH2 CH2 CH2 Br + Mg
2. H2O, H+
CH3 CH2 CH2 CH2 CH2 MgBr
20
b) l'acido 2-idrossiesanoico dal pentanale
OH O
CH3 CH2 CH2 CH2 CH C OH
O
CH3 CH2 CH2 CH2 C H
1 C in più
-C N
OCH3 CH2 CH2 CH2 C H
C N
OH
CH3 CH2 CH2 CH2 C H
C N
H+
H2O, H+
33. Mostrare come si possono preparare i seguenti composti, a partire
dagli opportuni cloruri acilici e composti organometallici:
O
O
R'
R'
R
+ R2Cd oppure R2Cu-Li+
Cl
a) 1-fenil-1-pentanone
O
C
O
C
CH2 CH2 CH2 CH3
O
C
+ (CH CH CH CH ) Cd
3 2 2 22
- +
oppure [(CH3CH2CH2CH2)2Cu] Li
R
R'
oppure
Cl
O
CH2 CH2 CH2 CH3
CH3 CH2 CH2 CH2 C
Cd
+
Cl
R'
R
34. Gli acidi carbossilici reagiscono con due equivalenti di composto litio organico,
dando chetoni. a) Scrivere un meccanismo plausibile per la reazione; b) scrivere la
reazione dell'acido benzoico con etillitio.
O
R
C
+ R'Li
OH
R
O
C
+ R'H
O-
reazione acido-base
R
O
C
H2O
O- Li+
O- Li+
R C O- Li+
R'
+ R'Li
OH
R C OH
R'
chetone idrato
non c’è un gruppo uscente,
NON si riforma C=O
O
C
H2O
R
R'
O
C
OH
O
C
+ 2 CH3 CH2 Li
CH2 CH3
21
35. Mostrare come i seguenti chetoni si possano ottenere dagli acidi indicati:
a) 1-fenil-1-propanone da acido propanoico (due modi, uno dei quali
un'acilazione di Friedel-Crafts)
O
C
Li
O
+ 2
CH3 CH2C
OH
CH2 CH3
O
PCl3 + CH3 CH2 C
OH
O
AlCl3
CH3 CH2 C
Cl
36. Scrivere le reazioni che, partendo dagli opportuni alogenuri alchilici e cloruri
acilici portano ai seguenti chetoni, utilizzando cadmio-organici e/o cuprati:
a) fenil isopropil chetone
O
C
CH3 O
CH3 CH C
Cl
CH CH3
CH3
Cd
+
oppure
Br
+ 2 Li
Li
LiBr
CdCl2
(
)
Cu Li+
2
oppure
CuI
40. Completare le seguenti reazioni, specificando i reagenti che occorrono
per ciascuna trasformazione:
a) alcool benzilico → cloruro di benzile fenilacetonitrile → acido fenilacetico
CH2OH
CH2 C N
CH2 Cl
SOCl2 o PCl3
o PCl5
-
C N
CH2 CO2H
H2O, H+
41. Per trasformare ciascuno dei seguenti composti nei prodotti richiesti, è
necessaria una serie di reazioni. Alcuni dei prodotti delle reazioni intermedie
sono indicati, altri no. Scrivere le reazioni ed i reagenti:
a) 1-esanolo ad acido eptanoico, attraverso l'eptanonitrile
CH3 CH2 CH2 CH2 CH2 CH2 CO2H
1 C in più
+
CH3CH2CH2 CH2 CH2 CH2 OH
PCl3
CH3CH2CH2 CH2 CH2 CH2 Cl
C N
H2O, H
CH3 CH2CH2 CH2 CH2 CH2 C N
22
42. Scrivere i prodotti (specificandone il nome) che si ottengono quando
l'acido butanoico viene fatto reagire con ciascuno dei seguenti composti:
a) PBr3 e bromo
OH
PBr3 + Br2
CH3 CH2 CH2 C
(2. H2O)
O
Br
OH
CH3 CH2 CH C
O
acido 2-bromobutanoico
b) dicicloesilcarbodiimmide e poi etanammina
O
OH
CH3 CH2 CH2 C
N
+
C
O
CH3 CH2 CH2 C
N
O
NH C
N
c) diazometano
OH
CH3 CH2 CH2 C
CH3 CH2 CH2 C
+ CH2N2
O
O CH3
O
N N
butanoato di metile
43. Scrivere il meccanismo della reazione dell'acido propanoico con Br2, PBr3.
v. lezione
44. Scrivere equazione chimica e meccanismo della reazione tra butanammide
ed ipobromito di sodio (trasposizione di Hofmann). b) Il composto ottenuto in
(a) si può avere anche per riduzione dell'opportuno nitrile: scrivere la reazione
corrispondente.
O
Br2, NaOH
CH3 CH2 CH2 NH2
CH3 CH2 CH2 C NH2
meccanismo: vedi lezione
+ Na2CO3
CH3CH2 C N + LiAlH4
45. Scrivere le equazioni chimiche relative alle seguenti reazioni: a) acido
propanoico + bromo e PBr3; b) il composto (a) + ammoniaca (eccesso).
O
Br O
Br2, PBr3
CH3 CH2 C OH
CH3 CH C OH
Br O
CH3CH C OH+ NH3
Br O
NH2O
NH3
+
+
CH3 CH C O NH4
CH3CH C O NH4
23
46. Completare le seguenti reazioni, specificando il nome dei prodotti organici:
Scrivere il meccanismo in un caso.
a) 3-fenilpropanoato di argento + Br2, sottoposto a riscaldamento
O
+ Br2
CH2 CH2 C
O- +Ag
Δ
CH2 CH2 Br
AgBr, CO2
47. Scrivere il meccanismo della decarbossilazione dell'acido 2-etilpropandioico.
O
HO
C
H
H
Δ
O
C
O
CH
CH2 CH3
O
C
HO
HO
O
O
C
C
#
O
O
CH
CH2 CH3
H
HO
C
H
O
+
C
CH
CH2 CH3
O
O
HO
CH CH2 CH3
C
CH2 CH2 CH3
48. Completare le seguenti serie di reazioni, specificando i nomi dei composti
organici che si ottengono:
a) acido acetico + SOCl2 → A; A + 2-propanammina → B.
NH2
O
CH3 C OH
SOCl2
O
CH3 CH CH3
CH3 C Cl
(A)
O
CH3
CH3 C NH CH CH3
(B)
N-isopropiletanammide
N-isopropilacetammide
cloruro di etanoile
cloruro di acetile
b) Acido cicloesancarbossilico + PCl3 → C; C + 2-butanolo → D
OH
O
O
OH
CH3 CH CH2 CH3
Cl
PCl3
(C)
cloruro di cicloesancarbonile
O
O CH CH2 CH3
(D)
CH3
cicloesancarbossilato
di 1-metilpropile
24
c) Acido 2-etilpentanoico + SOCl2 → E; E + metantiolo → F
O
CH3CH2 CH2CH C OH
CH2CH3
SOCl2
O
CH3CH2 CH2CH C Cl
CH2CH3
(E)
CH3SH
O
CH3CH2 CH2CH C S CH3
CH2CH3
(F)
2-etilpentantioato di metile
cloruro di 2-etilpentanoile
d) Malonato dietilico (= propandioato dietilico) + acqua e acido → G; G
sottoposto a riscaldamento → > H
CO2CH2CH3
H2O, H+
CH2
CO2CH2CH3
CO2H
CH2
CO2H
(G)
Δ
CO2H
CH3
(H)
acido acetico
acido etanoico
acido propandioico
e) Anidride butandioica + metanolo (un equivalente) → I; I + SOCl2 → J; J +
fenolo, in presenza di piridina → K.
O
O
O
CH3OH
C OH
CH2 1
CH2
OCH3
C
O
(I)
O
O
C Cl
SOCl2 CH2
CH2 1
OCH3
C
O
(J)
acido 3-metossicarbonil
propanoico
3-clorocarbonil
propanoato di metile
OH
O
C O
CH2
CH2
OCH3
C
O
(K)
propandioato di fenile
e di metile
50. Come è possibile preparare i seguenti chetoni, servendosi della sintesi
con l'estere acetoacetico?
a) 5-metil-2-esanone
R
O
CH3 C CH2 CH2 CH CH3
CH3
O
O
CH3 C CH2C
O CH2 CH3
25
51. Come è possibile preparare i seguenti acidi, servendosi della sintesi
con il malonato dietilico?
a) acido ciclopentancarbossilico
O
O CH2 CH3
C
CH2
C
O CH2 CH3
O
CO2H
R
O
O CH2CH3 CH CH O- O
O CH2CH3
O CH2CH3 Br CH CH CH CH Br O
2
3
C
C
2
2
2
2
C
- CH
CH2
CH CH2CH2CH2 CH2 Br
(1 equivalente)
C
C
C
O CH2CH3
O
O CH2CH3
O
O CH2CH3
O
CH3CH2O
O CH2CH3
C CH2 CH2
-C
CH
CH2 2
C
O
O
Br
CH2CH3
O
O
C
C
Br-
O
C
O CH2CH3
1. H2O, OH-
Δ
2. H3O+
CO2H
CO2
O CH2CH3
54. I seguenti chetoni non possono essere sintetizzati con il metodo dell'estere acetoacetico (perché?), ma si possono preparare con una variante che
prepara (condensazione di Claisen) ed utilizza un 3-chetoestere opportuno,
RCOCH2CO2CH2CH3, dove R è il gruppo che compare nel chetone finale.
Preparare i seguenti chetoni ed i 3-chetoesteri necessari per la loro sintesi: a)
3-pentanone; b) 1-fenil-2-metil-3-esanone
O
O
CH2 CH C CH2 CH2 CH3
CH3 CH2 C CH2 CH3
CH3
Perché non sono METIL CHETONI
a) 3-pentanone
O
CH3 CH2 C
O CH3
+ CH3O-
O
O
+ CH3 CH2 C
CH3 CH C
O CH3
O CH3
O
CH3 CH C
O CH3
+ CH3OH
O
CH3 CH2 C CH2 CH3 + CH3OH
26
55. Completare le seguenti reazioni, scrivendo le strutture per ciascuno
dei composti indicati:
a) estere malonico (in eccesso) con etossido di sodio e 1,2-dibromoetano →
C16H26O8
CH CH
2
O
O CH2CH3 CH CH O- O
O CH2CH3
2
3
C
Br CH2CH2 Br
C
- CH
CH2
(in difetto)
C
C
O CH2CH3
O
O CH2CH3
O
CH2CH3
O
3
O
O
O
C
C
CH CH2 CH2 CH
O
C
O
O
C
O
CH2CH3
CH2CH3
C16H26O8
b) C16H26O8 con etossido di sodio e 1,2-dibromoetano → C18H28O8
CH2CH3
CH2CH3
CH2CH3
CH2CH3
CH2CH3
O
O
O
O
O
O
O
O
O
O
O
C
C
CH2 CH2 C
CH3CH2O- C
C
Br CH2CH2 Br
C
- C CH CH
C
C
2
2 C
CH CH 2 CH2 CH
CH2 CH2
C
C
C
C
C
O
C
O
O
O
O
O
O
O
O
O
O
O
CH
CH
CH
CH
2
3
CH2CH3
CH2CH3
2
3
CH2CH3
CH2CH3
CH2CH3
O
C18H28O8
c) C18H28O8 + OH-, poi H+ ed infine riscaldamento → C8H12O4
CH2CH3
O
CH2CH3
OH
O
O
O
O
OH
C
C
Δ
CH2 CH2 C
CH2 CH2 C
1. H2O, OHC
C
C
C
CH2 CH2
CH2 CH2
2. H+
CO2
C
C
C
C
O
OH
O
O
O
OH
O
O
CH2CH3
CH2CH3
O
CO2H
CO2H
C8H12O4
27












