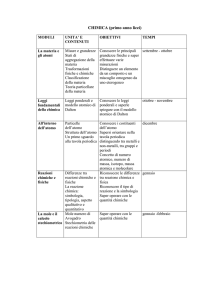
PROGRAMMA DI CHIMICA
Classe: 4a I
sez.
Ore previste : 99
A.S. 2008-2009
Ore effettive di lezione: 86
Libro di Testo: Le idee della chimica - G. Valitutti, Tifi, Gentile. Zanichelli
Docente : Maria A. Leoni
MODULO 1
U.D. 1
LA MATERIA: ASPETTI E TRASFORMAZIONI
MATERIA ED ENERGIA
La Materia e le sue proprietà intensive ed estensive
L’Energia e le sue proprietà
La temperatura e le scale termometriche
U.D. 2
LA MATERIA NEI SUOI STATI FISICI
Gli stati fisici della materia
I passaggi di stato
Fenomeni fisici e fenomeni chimici
I Sistemi
Elementi, Miscugli e Composti
Le Soluzioni: aspetti generali, la concentrazione.
Studio e Leggi dei Gas: Legge di Boyle
Legge di Charles e Legge di Gay-Lussac
Equazione di stato dei gas perfetti
Equazione di Van der Waals
Gas ideali e Gas reali
Legge di Avogadro e Numero di Avogadro
Il concetto di Mole o Grammomolecola
Legge di Graham e Legge di Dalton
1
MODULO 2
U.D. 1
DALLA MATERIA ALL’ATOMO
DALL’ATOMO DI DALTON ALL’ATOMO DI BOHR
La Teoria atomica di Dalton
L’Atomo e la sua struttura: cenni sulla scoperta delle particelle
sub-atomiche fondamentali. Carica e massa delle p. fondamentali.
Il fenomeno della Radioattività.
Il modello atomico di Thomson
Il modello atomico di Rutherford
Il modello atomico meccanico-quantistico di Bohr- Sommerfeld
I numeri quantici
Il principio di esclusione di Pauli
U.D. 2
L’ ATOMO OGGI
Ipotesi di De Broglie: duplice natura della materia, corpuscolare ed
ondulatoria.
Il principio d’indeterminazione di Heisenberg
Il contributo di Schrödinger
Modello atomico quantistico ondulatorio o modello atomico ad orbitali
Il concetto di orbitale, visualizzazione dei diversi tipi di orbitali
U.D. 3
PERIODICITA’ E CONFIGURAZIONE ELETTRONICA
Regole pratiche per descrivere la struttura elettronica dei vari atomi.
Principio di Aufbau, principio di Pauli, principio di Hund
Numero atomico e Numero di Massa
Ioni ed Isotopi
Concetto di peso atomico assoluto e relativo e di peso molecolare
assoluto e relativo
La Tavola periodica degli elementi
2
MODULO 3
L’INFINITAMENTE PICCOLO
U.D. 1
LE PARTICELLE DI MATERIA
La classificazione tradizionale e le proprietà fisiche delle particelle di
materia.
La classificazione e la fisica delle particelle elementari
Modello standard
U.D. 2
LE FORZE FONDAMENTALI DELLA NATURA
La forza gravitazionale,
La forza elettromagnetica,
Le forze nucleari: la forza nucleare forte
La forza gluonica o di colore
La forza nucleare debole
Le particelle di forza: i Bosoni.
Le forze unificate: l’elettrodebole, la G.U.T. e la TOE
MODULO 4
U.D. 1
LE MOLECOLE
I LEGAMI CHIMICI
Il concetto di valenza e numero di ossidazione
I legami chimici: caratteristiche fondamentali
Il legame ionico
Il legame covalente puro e polare
Il legame a idrogeno
Il legame dativo
Il legame metallico
Il legame di Van der Waals
U.D. 2
IL LEGAME SECONDO LA MECCANICA ONDULATORIA
La geometria delle molecole: teoria VSEPR
Teoria del legame di valenza - Teoria dell’orbitale molecolare
Orbitali molecolari di tipo σ e π. Orbitali ibridi sp, sp 2, sp3, sp3d, sp3d2.
3
MODULO 5
U.D. 1
LE REAZIONI CHIMICHE
LE REAZIONI CHIMICHE
Le leggi delle combinazioni chimiche: legge di Lavoisier
legge di Dalton
legge di Proust
Caratteristiche chimiche e fisiche dei metalli e dei non-metalli
Reazioni chimiche: aspetti generali
Vari tipi di reazioni
I Composti: classificazione, nomenclatura e preparazione dei composti
inorganici: Ossidi e Anidridi
Idruri
Idrossidi o Basi
Idracidi e Ossiacidi
Sali
IL DOCENTE
4