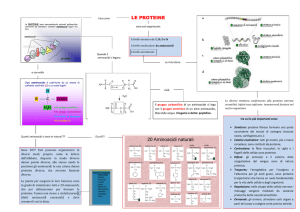
AMINOACIDI
Struttura
Funzione
Classificazione
Proprietà
1
STRUTTURA
Composti caratterizzati dalla presenza di un gruppo aminico (NH2)
e di un gruppo acido (COOH) legati al medesimo carbonio (C).
In soluzione acquosa il gruppo acido è dissociato (COO-) ed il
gruppo aminico è protonato (NH3+).
2
FUNZIONI
!!Gli aminoacidi (aa) sono i costituenti delle proteine. Sono 20 gli
aa che costituiscono le proteine ma esistono aa liberi che non
partecipano alla formazione delle proteine.
!!Precursori di ormoni (Tirosina => ormoni tiroidei).
!!Precursori di catecolammine (Tirosina => dopamina, adrenalina
noradrenalina).
!!Neurotrasmettitori (Glutammato) e precursori di
neurotrasmettitori (Triptofano => serotonina).
3
Al carbonio tetraedrico C-! sono legati:
!!il gruppo amminico
!!il gruppo carbossilico
!!un H (ad eccezione della prolina).
Ogni aminoacido è caratterizzato da una catena laterale (R)
anch’essa legata al C-!.
Peso molecolare medio: 110 Daltons.
Gli aminoacidi che costituiscono le proteine sono classificati,
sulla base della catena laterale in:
!!ALIFATICI NON POLARI
!!AROMATICI
!!POLARI NON CARICHI
!!CARICHI POSITIVAMENTE
!!CARICHI NEGATIVAMENTE
4
5
6
7
ALIFATICI NON POLARI
Catene laterali alifatiche non polari.
Generalmente localizzati nella parte interna delle proteine.
8
AROMATICI
Catene laterali aromatiche, ingombranti
Solo la Phe è completamente non polare
Generalmente localizzati nella parte interna delle proteine.
La Tyr può essere fosforilata sull’ossidrile.
9
POLARI NON CARICHI
Catene laterali alifatiche con gruppi polari non-ionizzabili.
La Ser e la Thr possono essere fosforilate sull’ossidrile.
La Asn e la Gln hanno gruppi ammidici spesso occupati in ponti
idrogeno.
La Cys (e la Met) contengono
zolfo.
La Cys può formare ponti
disolfuro (legame covalente)
con un’altra Cys.
Cys e Ser spesso fanno parte
dei siti catalitici di molti
enzimi.
10
CARICHI POSITIVAMENTE O BASICI
Catene laterali con carica positiva.
La His spesso fa parte del sito catalitico degli enzimi.
Generalmente localizzati nella parte esterna delle proteine.
11
CARICHI NEGATIVAMENTE O ACIDI
Catene laterali cariche negativamente.
Spesso fanno parte del sito catalitico degli enzimi.
Generalmente localizzati nella parte esterna delle proteine
12
13
Alcuni aminoacidi modificati
14
Fosforilazione degli aminoacidi
15
Ossidazione delle cisteine: ponti disolfuro
16
Alcune molecole derivanti da aminoacidi
17
18
19
20
Gli ormoni tiroidei
21
22
Sintesi delle melanine
23
PROPRIETA’ FISICHE
Il C-! è detto chirale dal momento che porta quattro diversi
sostituenti (esclusa la Glicina).
Gli aa ruotano il piano della luce polarizzata verso destra
(destrogiri o R) oppure verso sinistra (levogiri o L).
Gli aa che compongono le proteine sono tutti L-!-aa.
I gruppi aromatici delle catene laterali degli aa assorbono luce a
280 nm.
Hanno elevata costante dielettrica.
Hanno un elevato punto di fusione (> 200°C).
24
25
PROPRIETA’ CHIMICHE
Gli aa sono solubili in acqua e insolubili in solventi apolari.
In ambiente acquoso il gruppo COOH si dissocia in COO- + H+
In ambiente acquoso il gruppo NH2 si protona a NH3+:
COOH " COO- + H+
NH2 + H+ " NH3+
Il gruppo amminico aumenta
l’acidità del gruppo carbossilico (da
pKa = 4.7 a pKa = 2.0-2.2).
Il gruppo carbossilico aumenta
l’acidità del gruppo amminico (da
pKa = 10.6 a pKa = 9.2-9.6).
Gli aa sono quindi degli zwitterioni,
con carica netta = 0 a pH=7.0
26
27
28
PROPRIETA’ ACIDO-BASE
Equazione di Henderson-Hasselbalch:
pH = pKa + log [accettore di protoni]/[donatore di protoni]
La carica di un aa varia la variare del pH della soluzione.
Il pH al quale la carica netta
è zero è detto Punto
isoelettrico (pI)
Titolazione di un aa.
29
30
31
Gli aa cairchi negativamente o positivamente possiedo un ulteriore
gruppo carbossilico o amminico che contribuisce alla carica netta
dell’aminoacido.
32
33
Gli aa che compongono le proteine sono classificati anche in:
ESSENZIALI:
Triptofano
Lisina
Metionina
Fenilalanina
Treonina
Valina
Leucina
Isoleucina.
NON ESSENZIALI:
Arginina
Tirosina
Glicina
Serina
Acido glutammico
Acido aspartico
Cisteina
Istidina,
Prolina
Alanina.
34
35
Il legame peptidico
36
37