La chimica della pelle
1
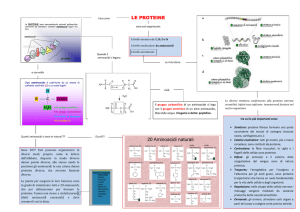
Gli amminoacidi
Queste unità hanno la particolare caratteristica di contenere nella stessa
molecola un gruppo acido (- COOH) ed uno basico (- NH2), legati tra loro
attraverso un atomo di carbonio.
Hanno formula generale:
HO
O
C
CH
R
NH2
La catena laterale R può contenere anche un altro
gruppo acido o amminico, in questi casi l’aminoacido
acquista carattere polare.
Gli aminoacidi più importanti presenti in natura sono
circa duecento, ma quelli che costituiscono le proteine
sono molti meno. Alcuni di questi sono detti
aminoacidi fondamentali perché gli organismi umani
ed animali non riescono a sintetizzarli e sono perciò
costretti ad assumerli con l’alimentazione.
Gli aminoacidi più comuni presenti nelle proteine sono
circa una ventina e differiscono tra loro per il gruppo
funzionale R.
2
Gli amminoacidi
Aminoacidi acidi
Aminoacidi neutri
CH3
OH
O
O
O
CH3
NH2
NH2
Acido glutammico
Valina
Aminoacidi basici
NH2
O
NH
NH
NH2
Arginina
3
I peptidi
Sono quei composti in cui due o più aminoacidi sono
legati assieme in una sequenza lineare, ed il gruppo
carbossilico di ciascuno di essi è legato al gruppo
amminico del seguente.
In dipendenza del numero di aminoacidi legati, si può
parlare di dipeptidi, tripeptidi e così via. Peptidi
costituiti da numerosi aminoacidi sono chiamati
polipeptidi.
4
Le proteine
Molecole azotate ad alto peso molecolare, solubili o insolubili, che
rappresentano i maggiori costituenti del protoplasma e dei tessuti animali.
Sono composti da aminoacidi, uniti tra loro da legami peptidici in una o più
catene polipeptidiche. A volte tali complessi sono legati ad un gruppo
prostetico.
Conformazione:
struttura tridimensionale della proteina
Proteine globulari: catena polipeptidica disposta in una
struttura sferica
Proteine fibrose:
catene polipeptidiche disposte
parallelamente lungo un unico asse, in
modo da generare lunghe fibre o strati
5
Le proteine
Struttura primaria: indica la sequenza degli aminoacidi nella
catena.
Struttura secondaria: si riferisce alla conformazione estesa
o avvolta a spirale delle catene polipeptidiche, come sono
soprattutto nelle proteine fibrose.
Struttura terziaria: si riferisce alla maniera in cui è ripiegata
o avvolta la catena polipeptidica per formare la struttura
compatta, strettamente arrotolata, delle proteine globulari.
Struttura quaternaria: denota la maniera in cui sono
disposte o raggruppate nello spazio le singole catene
polipeptidiche di una proteina formata da più catene.
6
Le proteine
A seconda della conformazione spaziale che la proteina può
assumere, esse si suddividono in fibrose o globulari:
nelle proteine fibrose le singole catene polipeptidichethe, ciascuna delle quali
è costituita da macromolecole, sono orientate lungo un asse preferenziale e sono
legate attraverso legami trasversali (per lo più legami idrogeno). In questo modo la
struttura acquista stabilità e perciò diventano insolubili in acqua. sono proteine
fibrose il Collagene, l’Elastina e la Cheratina.
nelle proteine globulari, le molecole sono disposte in una forma rozzamente
sferica, per l’azione di deboli legami trasversali (elettrostatici o legami idrogeno)
tra diverse parti della catena polipeptidica. La rottura di questi legami provoca una
irreversibile modifica nella struttura proteica, con conseguente denaturazione della
proteina, la quale perde gran parte delle sue proprietà biologiche, pur mantenendo
inalterata la sequenza degli aminoacidi nella catena. L’Albumina e la Globulina
sono le proteine più importanti in questa categoria.
7
Le proteine
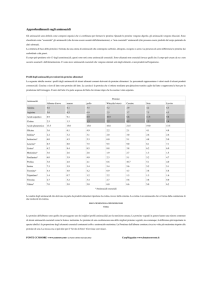
Punto isoelettrico
Punto o intervallo in una scala di pH al quale la concentrazione della parte
anionica di un anfolita equivale alla parte cationica, il pH in cui l’anfolita stesso
non viene attratto in un campo magnetico. Il punto isoelettrico della maggior parte
delle proteine si trova in un intervallo compreso tra 4 e 7.
Il punto isoelettrico del cuoio conciato è diverso da quello della pelle grezza, ed a
sua volta è differente da quello di una pelle in trippa. Esso infatti viene shiftato
dalla concia al vegetale verso pH acidi, e verso l’alcalinità dalla tradizionale
concia cationica al cromo.
Punto isoelettrico del
collagene
Fase di lavorazione
pH
Pelle grezza
7,2
Pelle calcinata
4,5
Pelle conciata al Cr
5,5
8
Il collagene
Il Collagene costituisce senza dubbio la parte proteica
principale della pelle. Si forma essenzialmente dalla
polimerizzazione del protocollagene in composti più
complessi, le microfibrille (di diametro circa 0,001µ).
Queste molecole sono legate, grazie a particolari
sostanze, in strutture sempre più organizzate: le fibrille
(0,1µ), le fibre (5-10 µ) e fasci fibrosi (possono
raggiungere anche i 100 µ).
Il protocollagene è una catena di aminoacidi (lunga
2800Å e spessa 15Å) costituite da tre catene
polipeptidiche, disposte a formare una spirale, e
composte principalmente da glicina (ca. 30%), prolina
(25%) ed idrossiprolina (25%).
Le catene aminoacidiche del collagene hanno una
struttura periodica che deriva dalla ripetizione di
sequenze di tre aminoacidi, il primo dei quali è sempre la
glicina, mentre gli altri due sono variabili (Gly-X-Y).
Le tre catene polipeptiche che costituiscono il collagene
sono disposte tridimensionalmente in una struttura
elicoidale (helix coil).
9
Le cheratine
Le cheratine sono diffuse in natura e costituiscono la parte
principale di lana, capelli, unghie, corna, piume, scaglie ecc …
A seconda della loro struttura si dividono in:
α-cheratine: contengono alte concentrazioni di un aminoacido
solfonato, la cistina. Questo aminoacido è in grado di formare
legami a ponte -S-S- tra catene proteiche, allungando la
struttura, rendendola più dura e resistente. Una alta
concentrazione di queste cheratine è presente infatti nelle
unghie e negli zoccoli degli animali. Se il contenuto di cistina
diminuisce, si ha una maggiore elasticità della catena proteica,
come nel caso dei capelli o della lana.
β-cheratine: non contengono cistina, e si trovano nelle fibre
secrete dai ragni o dai bachi da seta. Hanno una struttura
detta “a libro aperto”, diversa dalla struttura α-elica delle αcheratine.
Tutte le cheratine sono insolubili in acqua, nei normali solventi
organici ed in soluzioni alcaline, possono però essere
attaccate da agenti riducenti ed ossidanti. I primi trasformano il
ponte disolfuro (-S-S-) in gruppi tiolici –SH, i secondi originano
10
gruppi –SO3.
Le globuline
Sono una immensa classe di
proteine comprendenti
numerose molecole di interesse
biologico quali gli enzimi, gli
anticorpi ecc …
Sono assai diffusi in natura e
spesso si trovano associate ad
altre proteine globulari, le
albumine. Entrambe hanno la
caratteristica di essere solubili
in acqua ed in soluzione salina.
11