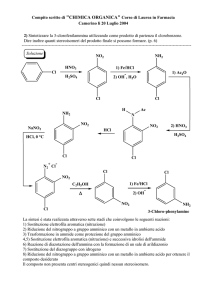
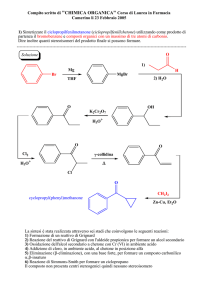
Scoperta del benzene
Composti aromatici
Prof.ssa Silvia Recchia
Il capofamiglia... il benzene
Una molecola può essere definita aromatica se contiene almeno un
anello aromatico, cioè un anello composto da atomi con ibridazione sp2,
tutti coinvolti in un sistema di doppi legami coniugati che deve contenere
un numero particolare di elettroni π dato dalla regola di Huckel,
4n + 2, con n = 1, 2, 3, .... ecc.
I composti aromatici vengono classificati come gruppo perchè presentano
alcune anomalie di stabilità, struttura e reattività.
• Isolato nel 1825 da Michael Faraday
che determinò in 1:1 il rapporto C:H.
• Sintetizzato nel 1834 da Eilhard
Mitscherlich che determinò la formula
molecolare come C6H6.
• Altri composti con rapporti inferiori
di C:H avevano un odore piacevole per
cui furono chiamati aromatici.
• La struttura fu proposta da Friedrich
Kekulé nel 1866.
Erich Huckel
1) Stabilità
La molecola del benzene, in alcune reazioni come
l’idrogenazione e la combustione, libera meno energia rispetto
ad altre molecole non aromatiche.
2) Struttura
I sei carboni dell’anello benzenico sono uniti da sei legami tutti
uguali che hanno una lunghezza intermedia tra quella di un
singolo legame e quella di un doppio legame.
Se il benzene fosse una molecola ciclica con tre doppi legami non
coniugati (un cicloesatriene non coniugato) il suo calore di idrogenazione
dovrebbe essere il triplo di quello del cicloesene cioè dovrebbe liberare
3 · 28,6 Kcal/mol = 85,8 Kcal/mol.
Invece il calore di idrogenazione del benzene è di 49,8 Kcal/mol, quindi
36 Kcal/mol meno del previsto.
•Anche la misura delle lunghezze di legame conferma che
il benzene ha una struttura anomala.
•Si osserva infatti che i sei legami C-C hanno tutti la
stessa lunghezza (1,40 A) un po’ maggiore di quella di un
normale doppio legame (1,33 A) e un po’ più corta di
quella di un singolo legame (1,53 A).
•Questo indica che nel benzene i sei legami carbonio-
Energia di coniugazione
36
Kcal/mol
Questa maggiore stabilità di 36 Kcal/mol è chiamata
energia di coniugazione.
Benzene secondo la teoria VB
La teoria della risonanza descrive il benzene come un ibrido che
può essere rappresentato dalle due forme limite di risonanza.
La molecola vera non corrisponde a nessuna delle due strutture
rappresentate, ma è una via di mezzo tra queste (ibrido di
risonanza), in ogni caso è più stabile di ciascuna.
forme limite di risonanza
carbonio hanno ordine di legame circa 1,5.
molecola vera
Benzene secondo la teoria VB
Benzene secondo la teoria VB
Dato poi che le due forme limite di risonanza sono entrambe
stabili e identiche, allora si può prevedere una particolare stabilità
dell’ibrido di risonanza, in questo modo la teoria VB giustifica le
36 Kcal/mol osservate.
Anche le lunghezze di legame anomale trovano una semplice
spiegazione con la teoria della risonanza.
Basta osservare che ogni legame è rappresentato doppio in una
struttura e singolo nell’altra, quindi si può prevedere che ogni
legame sia uguale agli altri e che abbia ordine di legame 1,5.
Benzene
C6 H6
H
H
H
H
H
H
• esagono planare, tutti angoli di 120º
• tutti i legami C–C = 140 pm
• tutti ibridizzati sp2
=
=
Ibrido di due strutture contributive equivalenti
OM
0
π6*
π4*, π5*
π2 , π3
π1
tutti gli elettroni
in orbitali leganti
Esempi di sistemi di Hückel (4n+2)
Criteri per l’aromaticità
1. Il sistema deve essere ciclico
2. Il sistema deve essere planare
3. Ogni atomo dell’anello deve far parte di un
sistema π esteso
4. Il sistema π esteso deve contenere (4n+2)
elettroni π che è chiamato numero di Hückel.
Antiaromatico e Nonaromatico
• Composti antiaromatici sono ciclici, coniugati con 4n
elettroni in orbitali p che si sovrappongono, ma con
energia maggiore del sistema lineare corrispondente.
ciclopropenil
carbanione
ciclopentadienil
carbocatione
cicloeptatrienil
carbanione
• Composti non aromatici non hanno un anello con orbitali p
che si sovrappongono e non sono planari.
n=0
n=1
ciclopropenil
carbocatione
ciclopentadienil
carbanione
H
B
O
n=0
n=1
n=1
n=2
n=1
cicloeptatrienil
carbocatione
ione tropilio
N
O
N
n=1
S
N
n=1
n=2
Stabilità del Benzene
• La grande stabilità del benzene determina la sua
reattività:
Quando reagisce perde l’aromaticità ma ha la
tendenza a tornare aromatico (con tutti i doppi
legami coniugati): le reazioni saranno di
addizione – eliminazione, ossia di sostituzione.
Non reagisce come gli alcheni che possono
perdere il doppio legame, dando reazioni di
addizione.
Stabilità del Benzene
Nomenclatura
Br
Br2
Alcuni nomi comuni:
addizione
CH3
CH3
Br
Br2
nessuna reazione
Non decolora le
soluzioni di bromo
CH3
p-xilene
ma
Br2
FeBr3
Br
sostituzione:
bromo sostituisce
idrogeno
CH3
mesitilene
CH3
cumene
CH3
CO2H
OH
H
H3C
OH
N
O
Nelle reazioni di sostituzione del benzene non si formano mai
isomeri, pertanto tutti e sei gli atomi di carbonio sono
chimicamente equivalenti
o-cresolo
acido salicilico
N,N-dietil-m-toluammide
Come abbiamo detto, i prefissi o-, m- e p- sono usati comunemente nella
nomenclatura dei benzeni disostituiti, tuttavia si può anche usare la
numerazione per indicare la posizione dei sostituenti.
Idrocarburi aromatici policiclici (PAH)
8
• Amorfo: piccole particelle di grafite; carbone, fuliggine,
nero di carbone.
• Diamante: uno scheletro di carboni tetraedrici.
• Grafite: strati di anelli aromatici fusi.
1
2
7
3
6
5
4
naftalene
10 elettroni π
n=2
CH3
Allotropi del Carbonio
antracene
14 elettroni π
n=3
fenantrene
14 elettroni π
n=3
OH
NH2
CH3
1,4-dimetilnaftalene
1-naftolo
(α-naftolo)
2-naftilammina
(β-naftilammina)
diamante
grafite
Reattività di composti aromatici
Allotropi del Carbonio
• Fullereni: anelli a 5 e 6 termini arrangiati in forma di
pallone da calcio.
• Nanotubi: metà sfera C60 fusa a un cilindro di anelli
aromatici fusi.
Come alcheni e alchini, gli
aromatici reagiscono con E+,
ma con reazioni di
sostituzione non di addizione
L’anello può essere
idrogenato ma in
condizioni spinte
La catena laterale può
essere ossidata senza
toccare l’anello
I sostituenti W
(attrattori)
consentono a L
(leaving group)
di uscire come
nucleofilo
1. SE aromatica (addizione-eliminazione)
H
E
+ E-Nu
+ H-Nu
G
G
2. Riduzione dell’anello
H2/Pt
alta p
G
G
3. Ossidazione della catena laterale
R
COOH
KMnO4
∆
G
G
4. SN aromatica (addizione-eliminazione)
L
Due
meccanismi
di SN ar
W
Nu
Nu–
(W)
+ L–
W
(W)
5. SN aromatica (eliminazione-addizione)
L
G
B–
B
B–
H
H–
G
H
G
H
+
G
B
6. Metallazione
X
MgX (Li)
Mg (Li)
G
G
Sostituzione
elettrofila
1. Sostituzione
Elettrofila
Aromatica
aromatica
alchene:
Sostituzione elettrofila
aromatica
aromatico:
C C
Br2
Br2
FeBr3
Br
C C
Br
Br
addizione
elettrofila
sostituzione
elettrofila
aromatica
Meccanismo della SEA
• Tutte queste reazioni sono legate da un unico
meccanismo.
– Formazione di un elettrofilo E+: l’elettrofilo è legato
a un nucleofilo (Nu o Y); può staccarsi da solo o con
un catalizzatore.
• La reazione procede con meccanismo a 2 stadi:
I. L’aromatico attacca E+, perdendo l’aromaticità.
2. L’intermedio perde H+, riacquistando l’aromaticità.
Meccanismo generale
sostituzione = addizione + eliminazione
B. Alogenazione
• Nella alogenazione, il benzene reagisce con Cl2 o Br2 in
presenza di un acido di Lewis come FeCl3 o FeBr3, per
dare clorobenzene o bromobenzene.
• Reazioni analoghe con I2 e F2 non sono utili perché I2 è
troppo poco reattivo, F2 reagisce troppo violentemente.
Br
Br Br
Fe
Br
+
–
Br–Br–Fe–Br
Br
Br
Br
Br
+
–
Br–Br–Fe–Br
–
Br–FeBr3
H
base
Br
Br
Br
H
Br
ione nitronio
(elettrofilo)
base
• Nella solfonazione, il benzene reagisce con triossido di
zolfo in presenza di acido solforico, per dare acido
benzensolfonico.
O
S
O
NO2
N
O
H
H
HSO4
NO2
base
+ H2SO4
La nitrazione è utile perché il nitro gruppo può essere ridotto a NH2.
O
O
••
••
• Nella nitrazione, il benzene reagisce con la miscela
solfonitrica (acido nitrico e acido solforico) per dare
nitrobenzene.
– H2O
••
••
NO2
O=N=O
H2SO4 + HNO3
HSO4 + H2O –NO2
O N O
il catalizzatore
viene rigenerato
D. Solfonazione
C. Nitrazione
acido
+ F eBr 3 + H Br
O
O
O
S
H–O–SO3H
O
S+
OH
+ O–SO3H
elettrofilo
O
OH
+
O
S OH
H
H
HSO4
SO3H
+ H2SO4
SO3H
La reazione è reversibile: l’acido solfonico, riscaldato in H3O+, ridà l’aromatico.
E. Alchilazione di Friedel-Crafts
E. Alchilazione di Friedel-Crafts
• Un aromatico, trattato con un alogenuro alchilico e un
acido di Lewis (AlCl3) (o con un alcool o con un alchene
e un acido protico o di Lewis), dà un alchilbenzene.
R Cl + AlCl3
coppia ionica
R + AlCl 4
2° e 3°
δ+ δR–Cl–AlCl3
R Cl + AlCl3
1°
Cl– AlCl3
H
R
– H+
R
H
+ AlCl3 + HCl
R
F. Acilazione di Friedel-Crafts
• Nella acilazione di Friedel-Crafts, un anello aromatico è
trattato con un cloruro acilico (RCOCl) o un’anidride
(RCOOCOR) e AlCl3 per dare un chetone aromatico.
• Dato che il nuovo gruppo legato al benzene (RCO) è
chiamato un gruppo acile, il trasferimento di un gruppo
acile da un atomo a un altro è chiamato acilazione.
••
C ••
Cl
••
Al Cl3
C
O
R
C
O
R
C
O
+ AlCl4
ione acilio
(non riarrangia)
AlCl4
O
H O
R
– H+
R
+ HCl + AlCl3
RCO– acile
ma non
AlCl3
H
H
1,2-shift
+ –
CH3–C–CH2–Cl–AlCl3
CH3–C–CH3
+
H
F. Acilazione di Friedel-Crafts
• Anidridi come agenti acilanti:
O
CH3
O
R
•
Alogenuri vinilici e arilici non reagiscono nelle
alchilazioni di Friedel-Crafts.
Si verificano riarrangiamenti anche se non si formano
carbocationi liberi.
Cl
R
R
•
C
O
O
O
C
Al Cl3
CH3
+ CH3CO2H
Limiti delle reazioni di Friedel-Crafts
1. Alchilazione:
G. Come ottenere catene lineari
• Acilazione-riduzione ⎯→ alchilbenzeni 1°
• Si formano prodotti di polialchilazione perché il prodotto
(aromatico alchilato) è più reattivo del substrato.
• Trasposizioni.
R
SEA su Benzeni sostituiti
• La SEA è una reazione generale di tutti i composti
aromatici, compresi i PAH, gli eterociclici aromatici e i
benzeni sostituiti.
• Un sostituente influenza la SEA in due aspetti:
– La velocità della reazione in rapporto al benzene — Un
benzene sostituito reagisce più velocemente o più
lentamente del benzene.
– L’orientamento — Il nuovo gruppo entra in posizione
orto, meta o para rispetto al primo.
• È la natura del primo sostituente a determinare la velocità
della reazione (attivazione o disattivazione) e la posizione
del secondo sostituente (orientamento).
O
R
Cl
AlCl3
2. Alchilazione & Acilazione
Le reazioni di F. C. danno resa bassa quando sull’anello
aromatico vi siano gruppi
• elettron attrattori:
NO2, +NMe3, COOH, COR, CF3, SO3H
• un gruppo amminico:
NH2, NHR, NR2 (legano ad AlCl3 e diventano elettron
+
–
attrattori –NR2–AlCl3)
O
C
riduzione
R
nessun
riarrangiamento
agenti riducenti: Zn(Hg), HCl (riduzione di Clemmensen)
NH2NH2, NaOH, calore (riduzione di WolffKishner)
O
O
Cl
Zn(Hg)
HCl
AlCl3
Reattività e orientamento delle SEA
Velocità
relativa
Orientamento
OH
OH
OH
NO2
HNO3
+
H2SO4
NO2
CH3
CH3
1,000,000
CH3
NO2
HNO3
+
H2SO4
25
NO2
HNO3
H2SO4
NO2
1
• I gruppi OH e
CH3 rendono
l’anello
aromatico più
reattivo
rispetto al
benzene e
orientano in
o-, p• sono gruppi
attivanti, o-,
p-orientanti
Reattività e orientamento delle SEA
Velocità
relativa
Orientamento
NO2
HNO3
1
H2SO4
Cl
Cl
HNO3
Cl
+
H2SO4
NO2
0.03
Cl è un gruppo
disattivante,
o-, p-orientante
NO2
NO2
NO2
HNO3
H2SO4
•
•
NO2
0.000001
Attivazione, Disattivazione, Orientamento
• I gruppi o-, p- orientanti hanno lone pair di elettroni
sull’atomo legato all’anello aromatico.
• I gruppi m- orientanti hanno una carica positiva, parziale o
totale sull’atomo legato all’anello aromatico.
• Per capire come i sostituenti attivano o disattivano l’anello
alle sostituzioni elettrofile, dobbiamo considerare il primo
stadio della SEA (lo stadio lento) che porta alla formazione
di un intermedio carbocationico stabilizzato per risonanza.
NO2 è un
gruppo
disattivante,
m-orientante
Attivazione, Disattivazione, Orientamento
Attivazione, Disattivazione, Orientamento
Secondo il postulato di Hammond è possibile predire la
velocità relativa della reazione dalla stabilità
dell’intermedio carbocationico.
– Più stabile è il carbocatione, minore sarà l’energia
dello S.T. da cui deriva, minore l’Ea, più veloce la
reazione.
Per valutare l’effetto di un sostituente:
1. Disegnare tutti gli intermedi che derivano da attacco in
orto, meta, para e valutarne la stabilità.
2. L’elettrofilo attacca la posizione che genera un
intermedio più stabile.
I+ stabilizzano il carbocatione,
• Gruppi elettron donatori (D)
rendendo più veloce la reazione.
– attivano un anello aromatico verso l’attacco elettrofilo.
I- destabilizzano il
• Gruppi elettron attrattori (W)
carbocatione, rendendo più lenta la reazione.
– disattivano un anello aromatico verso l’attacco
elettrofilo.
I+D
H
E
I-W
H
E
carbocatione più stabile
carbocatione meno stabile
Effetto induttivo +
Attivazione
Effetto induttivo Disattivazione
Attivante +
aumenta la densità
di carica in anello
→ aumenta la reattività
Disattivante -
Orientazione
diminuisce la densità
di carica in anello
→ diminuisce la reattività
All’effetto induttivo dei sostituenti si aggiunge un effetto
di coniugazione che può portare carica in anello (R+) in
posizione orto-para o meta.
L’effetto di coniugazione può anche sottrarre carica
all’anello (R-).
I gruppi con coppie di elettroni sull’atomo legato all’anello sono
ATTIVANTI
I gruppi con coppie di elettroni sull’atomo legato all’anello sono
ATTIVANTI e ORTO-PARA ORIENTANTI
I gruppi con carica positiva sull’atomo legato all’anello sono
DISATTIVANTI e META ORIENTANTI
I gruppi con carica positiva sull’atomo legato all’anello sono
DISATTIVANTI
Sostituenti attivanti: o-p, I+
Sostituenti attivanti +I, +R: orientazione
Energia degli Intermedi
C-cat
terziario
OH
OH
NO2
Attacco
orto
OH
H
OH
H
NO2
NO2
C-cat
terziario
OH
H
NO2
OH
H
stabilizzato
OH
OH
OH
NO2
Attacco
meta
H
H
H
NO2
NO2
NO2
OH
OH
Attacco
para
preferito
OH
OH
NO2
NO2
OH
OH
NO2
OH
OH
NO2
H NO2
H NO2
stabilizzato
H NO2
H NO2
NO2
preferito
Sostituenti disattivanti –I, –R: orientazione
Effetto dei sostituenti
Energia degli Intermedi
NO2
NO2
NO2
Attacco
orto
NO2
H
NO2
H
NO2
NO2
H
NO2
sostituenti attivanti
NO2
NO2
E
NO2
NO2
E
benzene
destabilizzato
NO2
sostituenti disattivanti
orto, para
m eta
NO2
NO2
meta
orto, para
Attacco
meta
NO2
H
H
H
H
NO2
NO2
NO2
δ+
NO2
benzene
E
H
δ+
δ+
preferito
δ+ OH
NO2
NO2
NO2
NO2
NO2
NO2
H NO2
H NO2
H NO2
δ+
δ+ NO2
NO2
HO
Attacco
para
E
NO2
destabilizzato
Alogeni –I, +R: disattivanti o-, p-orientanti
Alogeni: orientazione
• Per effetto induttivo l’alogeno disattiva l’anello: la velocità
sarà < che nel benzene.
• Per effetto mesomerico l’alogeno stabilizza l’intermedio
quando l’elettrofilo è entrato in orto o para.
meta
Cl
orto, para
N O2
Attacco
orto
&
para
Cl
benzene
Cl
H
NO2
Cl
Cl
H
NO2
H
NO2
H
NO2
E
H
δ+
Attacco
meta
Cl
Cl
H
H
H
NO2
NO2
NO2
nessun effetto
δ+
δ+ Cl
l’alogeno stabilizza
Cl
E
Cl
Effetto dei sostituenti: riassunto
R
Y
attivanti, o-, p-orientanti
Y
Z
NR3
Effetto dei sostituenti: riassunto
Eff. Induttivo
I+
IIII-
-CH3
-NH2
-NO2
-COOH
-X
Eff. risonanza
R+
RRR+
L’effetto complessivo di attivazione viene dato dalla somma algebrica dell’effetto induttivo e di risonanza.
L’effetto di orientazione è determinato dall’effetto di risonanza.
ATTIVANTI
disattivanti, m-orientanti
X
disattivanti, o-, p-orientanti
Orientazione
o-p
o-p
m
m
o-p
DISATTIVANTI
FORTI
-NH2, -NHR, -NR2 (R+)
-OH (R+)
-O- (R+)
-NO2 (R-, I-)
-NR3+ (I-)
MEDI
-OR (R+, I-)
-NHR (R+, I-)
-CN, -CHO, -COR
-SO3H, -COOH -COOR (R-, I-)
-Ph (I+)
-R (I+)
-X (R+, I-)
DEBOLI
L’effetto di risonanza di un gruppo attivante forte prevale su quello di un
attivante debole che a sua volta prevale su quello di un disattivante.
Limitazioni nelle SEA
• Aromatici fortemente attivati (OH, NH2 e derivati, OR,
NHR, NR2) vengono polialogenati se trattati con X2 e FeX3.
– Per avere il prodotto monoalogenato, si alogena senza
catalizzatore.
• Un aromatico fortemente disattivato non dà reazioni di
Friedel-Crafts.
• Reazioni di F.-C. non avvengono in presenza di NH2 perché
questi si complessa con AlCl3 disattivando l’anello.
• L’alchilazione di F.-C. condotta con alogenuri alchilici porta
alla polialchilazione perché il monoalchilato è più attivato
del substrato.
• La polisostituzione non avviene con la acilazione di F.-C.
Effetto di sostituenti multipli
1. Il gruppo più attivante prevale nell’indirizzare la sostituzione.
2. La posizione tra due gruppi meta è troppo ingombrata per
poter essere sostituita.
CH3
troppo
ingombrata
CH3
CH3
O2N
HNO3
H2SO4
CH3
CH 3
CH3
NO2
HNO3
H2 SO4
CH3
CH3
CH3
CH3
CH3
CH3
HNO3
H2 SO4
O2N
CH3
+
O2N
CH3
Effetto di sostituenti multipli
OH
Sintesi regioselettive:
la sequenza di reazioni determina il prodotto
OH
Br
Br2
FeBr3
CH3
NO2
CH3
OH
OH
OH
CH3
Br2
HNO3
Cl2
H2SO4
FeCl3
CH3
CH3
Br
Br
HNO3
FeCl3
H2SO4
+
NO2
SO3H
SO3
Cl
NO2
Cl2
OCH3
OCH3
Cl
Cl
Cl
+
FeBr3
NO2
H2SO4
NO2
NO2
Sintesi regioselettive:
la sequenza di reazioni determina il prodotto
O
O
È l’attività del gruppo a determinare la scelta delle condizioni
CH3
HNO3
H2SO4
AlCl3
HNO3
H2SO4
Br
AlCl3
OH
OH
Br
Br2
H2O
O
Cl
+
OH
NO2
NO2
CH3
Br
Br2
FeBr3
O
Cl
CH3
+
Br
nessuna reazione
NH2
NH2
Br2
H2O
Br
Br
Br
non si ferma al
primo stadio
2. Riduzione dell’anello benzenico
a. Idrogenazione catalitica
H2/Pt, EtOH, 2000 psi
o H2/Rh/C, EtOH, 1 atm
b. Riduzione di Birch
Na, NH3 (l)
1,4-cicloesadiene
CH3 OH
CH3
Na, NH3 (l)
ma non
CH3 OH
alchene più stabile
Fine
3. Ossidazioni della catena laterale