Università di Bergamo
Soluzioni del compito del 10 Luglio 2013 per Ingegneria Gestionale ed
Informatica
B
1) Si aggiunge la stessa quantità di una soluzione di NaOH a due bicchieri, il primo contenente una
soluzione di HCl ed il secondo contenente una soluzione di HCN. In quale dei due recipienti si
avrà la maggiore variazione di pH?
Nel primo caso si ha reazione degli H3O+ con OH- per formare acqua, nel secondo caso, a
causa della stessa reazione, per rispettare la costante di equilibrio, si ha la produzione di altri
H3O+. La maggiore variazione di pH si avrà di conseguenza nel primo caso.
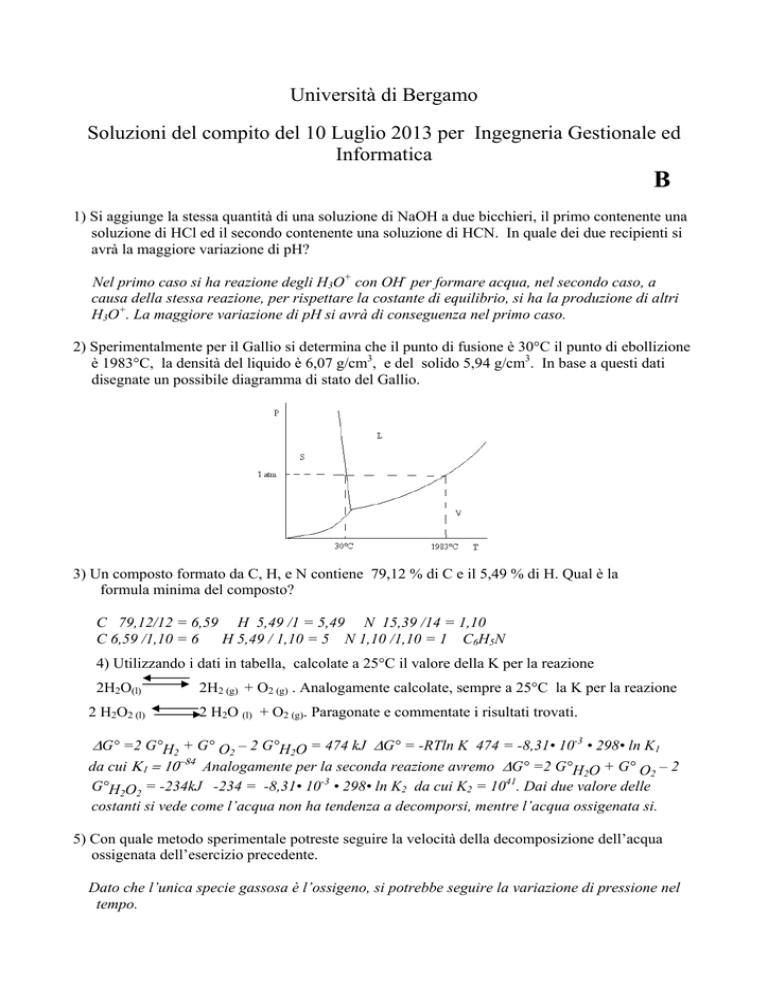
2) Sperimentalmente per il Gallio si determina che il punto di fusione è 30°C il punto di ebollizione
è 1983°C, la densità del liquido è 6,07 g/cm3, e del solido 5,94 g/cm3. In base a questi dati
disegnate un possibile diagramma di stato del Gallio.
3) Un composto formato da C, H, e N contiene 79,12 % di C e il 5,49 % di H. Qual è la
formula minima del composto?
C 79,12/12 = 6,59 H 5,49 /1 = 5,49 N 15,39 /14 = 1,10
C 6,59 /1,10 = 6 H 5,49 / 1,10 = 5 N 1,10 /1,10 = 1 C6H5N
4) Utilizzando i dati in tabella, calcolate a 25°C il valore della K per la reazione
2H2O(l)
2 H2O2 (l)
2H2 (g) + O2 (g) . Analogamente calcolate, sempre a 25°C la K per la reazione
2 H2O (l) + O2 (g). Paragonate e commentate i risultati trovati.
ΔG° =2 G°H2 + G° O2 – 2 G°H2O = 474 kJ ΔG° = -RTln K 474 = -8,31• 10-3 • 298• ln K1
da cui Κ1 = 10−84 Analogamente per la seconda reazione avremo ΔG° =2 G°H2O + G° O2 – 2
G°H2O2 = -234kJ -234 = -8,31• 10-3 • 298• ln K2 da cui K2 = 1041. Dai due valore delle
costanti si vede come l’acqua non ha tendenza a decomporsi, mentre l’acqua ossigenata si.
5) Con quale metodo sperimentale potreste seguire la velocità della decomposizione dell’acqua
ossigenata dell’esercizio precedente.
Dato che l’unica specie gassosa è l’ossigeno, si potrebbe seguire la variazione di pressione nel
tempo.
6) Guardando la posizione dei seguenti elementi nella tabella periodica, spiegare quale o quali dei
seguenti elementi F2, Xe, Cs, Pd non vi aspettereste di trovare in natura allo stato elementare.
Il Fluoro appartiene al settimo gruppo e quindi ha una affinità elettronica molto elevata. Il
Cesio appartiene al primo gruppo e quindi ha una energia di ionizzazione molto bassa. Questi
due elementi saranno presenti in natura allo stato combinato e non allo stato elementare, mentre
il Palladio, metallo nobile elo Xeno, gas nobile si troveranno in natura .
7) Scrivete le formule di struttura degli acidi ipocloroso e perclorico. In base ad un parametro
ricavabile dalla formula si può dedurre che uno ha proprietà ossidanti maggiori dell’altro. Dire in
base a quale ragionamento lo individuereste.
O
Cl
O
H
H
O
Cl
O
O
Un metodo potrebbe essere quello di calcolare il numero di ossidazione del Cloro nei due
composti; nel primo caso il numero di ossidazione è +1 e nel secondo è + 7. Considerando che
il Cloro ha una elevata elettronegatività, nel secondo composto ci sarà una maggiore tendenza a
passare allo stato ridotto.
8) L’Acido Nitrico reagisce con il Rame secondo la reazione (da bilanciare):
Cu (s) + HNO3 (sol)
Cu++(sol) + NO3- (sol) + NO2 (g) + H2O (l) , se si fanno reagire 6 g di Cu
con 200 mL di una soluzione 0,1 M di HNO3 che volume di NO2 otterrete a 35°C e 0,9 atm.
Cu
Cu++ + 2e
+
2 NO3 + e + 2 H
NO2 + H2O
Cu + 2 NO3- + 4 H+
Cu++ + 2 NO2 + 2 H2O
Cu++ + 2 NO3- + 2 NO2 + 2 H2O. Metteremo a
Da cui avremo Cu + 4 HNO3
reagire 4/ 63,5 = 0,063 mol di Cu con 0,1• 200 / 1000 = 0,020 mol di HNO3 che di conseguenza è
il reagente in difetto. Si formeranno 0,010 mol di NO2 che occuperanno 0,010•0,082•308/0,9 =
0,28L.
9) L’ossido di Bario si ottiene per decomposizione del suo carbonato secondo la reazione
BaCO3 (s)
BaO (s) + CO2 (g)
Stabilire le migliori condizioni di temperature e pressione per fare avvenire questa reazione,
motivando le vostre scelte.
Dato che si devono rompere dei legami e si forma una specie gassosa, la reazione sarà
endotermica con aumento di entropia. Quindi sarà favorita dalle alte temperature. Dato che si ha
sviluppo di un gas, sarà favorita dalle basse pressioni.
10) Calcolare la f.e.m. per la pila Pt / MnO4- 0,2 M, Mn++ 0,1 M, H3O+ 1 M // Ag+ 0,5 M / Ag
indicando la polarità dei semielementi e le reazioni che vi avvengono.
E1 = 1,51 + 0,059/5 lg 0,2• 18/0,1 = 1,51 V
E2 = 0,80 + 0,059/1 lg 0,5 = 0,78 V
ΔE = E+ - E- = 1.51 – 0,78 = 0,73 V
+ MnO4- + 8 H3O+ + 5e
Mn++ + 12 H2O - Ag
Ag+ + e