Esame di Elementi di Chimica
Corso di Laurea in Fisica
Soluzioni I Prova di esonero
5/5/2014
1) Scrivere la formula bruta dei seguenti composti, indicando il numero di ossidazione di tutti gli
elementi. Scrivere inoltre formula di struttura dell’anione, indicando gli angoli di legame e le
eventuali strutture di risonanza.
a) Solfato di bario
b) Idrogenocarbonato di calcio
c) Nitrito di sodio
d) Clorato di potassio
Scrivere inoltre formula di struttura dell’anione, indicando gli angoli di legame e le eventuali
strutture di risonanza.
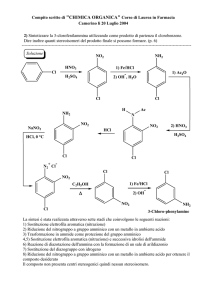
2) Bilanciare in forma ionica ed in forma molecolare la seguente reazione:
S + NO3- + H+ SO42- + NO2 + H2O
S + HNO3 H2SO4 + NO2 + H2O
Calcolare:
a) il volume di soluzione 0,10 M di HNO3 che reagisce con 2,0 g di S;
b) il volume di NO2, misurato a 30°C e alla pressione di 0,95 atm che si sviluppa nella reazione.
3) La pressione osmotica di una soluzione acquosa di urea CO(NH2)2 avente densità 1,02 g/ml è
6,11 atm a 25°C. Calcolare la temperatura di congelamento di questa soluzione alla pressione di
1,00 atm, sapendo che per l’acqua kCR=1,86 °C mole-1 kg.
4) Un composto ha la seguente composizione percentuale in peso:
C: 14,3%
H: 1,2%
Cl: 84,5%
Sapendo che 1,0 g di questo composto, vaporizzato a 120° C e alla pressione di 752 mmHg occupa
un volume di 194 ml, calcolare peso molecolare e formula molecolare del composto
Esame di Elementi di Chimica
Corso di Laurea in Fisica
Soluzioni I Prova di esonero
5/5/2014
1) Scrivere la formula bruta dei seguenti composti, indicando il numero di ossidazione di tutti gli
elementi. Scrivere inoltre formula di struttura dell’anione, indicando gli angoli di legame e le
eventuali strutture di risonanza.
+2 +6 -2
a) Solfato di bario
O-
O
BaSO4
O- O
O
S
-
O
S
109°
-
S
-
O
O
+2 +1 +4 -2
O-
-
+1 +3 -2
c) Nitrito di sodio
NaNO2
120°
d) Clorato di potassio
KClO3
-
-
O
O
N
C
O
O-
O
S
O
O
O
O
O-H
O-H
120°
-
S
O
Ca(HCO3)2
O-
O
O
O
S
b) Idrogenocarbonato di calcio
-
O-
O
O
O
C
O
O
O
O-
N
O-
+1 +5 -2
O-
O
Cl
angolo109°
-
O
Cl
O
O
2) Bilanciare in forma ionica ed in forma molecolare la seguente reazione:
0
+6
S + 4 H2O SO42- +6e-+ 8H+
+5
+4
-
-
+
NO3 + e + 2 H NO2 + H2O
-
+
x6
2-
S +6 NO3 + 4 H SO4 + 6 NO2 +2 H2O
S + 6 HNO3 H2SO4 + 6 NO2 +2 H2O
Calcolare: a) il volume di soluzione 0,10 M di HNO3 che reagisce con 2,0 g di S;
nS=
gS
2,0
=
= 0,0625
PA S 32
nHNO3= 6nS= 0,375
VHNO3=
n HNO3
M HNO3
O
=
0,375
= 3,75 l
0,1
Cl
O
O
O-
b) il volume di NO2, misurato a 30°C e alla pressione di 0,95 atm che si sviluppa nella reazione.
nNO2= nHNO3= 0,375 T=303 K
VNO2=
n NO 2 RT
P
=
0,375 × 0,0821 × 303
= 9,8 l
0,95
3) La pressione osmotica di una soluzione acquosa di urea CO(NH2)2 avente densità 1,02 g/ml è
6,11 atm a 25°C. Calcolare la temperatura di congelamento di questa soluzione alla pressione di
1,00 atm, sapendo che per l’acqua kCR=1,86 °C mole-1 kg.
Τ= 298 Κ π =MRT M =
Π
6,11
=
= 0,2497 M
RT 0,0821x 298
Per 1 litro di soluzione
gsoluz= dxV=1020 g
nCO(NH2) 2= 0,25 PMCO(NH2) 2 = 60 g/mol
gCO(NH2) 2= nCO(NH2) 2xPMCO(NH2) 2 = 0,2497x60=14,98 g
gH2O= gsoluz- gCO(NH2) 2= 1020-14,98=1005 g
mCO(NH2)2=
n CO(NH 2 ) 2
kg H2O
=
kgH2O= 1,005 kg
0,2497
= 0,2485 m
1,005
∆TCR=m kCR=1,86x0,2485 = 0,46 °C
TCR= - 0,46 °C
4) Un composto ha la seguente composizione percentuale in peso:
C: 14,3%
H: 1,2%
Cl: 84,5%
Sapendo che 1,0 g di questo composto, vaporizzato a 120° C e alla pressione di 752 mmHg occupa
un volume di 194 ml, calcolare peso molecolare e formula molecolare del composto.
C
H
Cl
%
14,3
1,2
84,5
T=393 K
PV =nRT =
PA
12
1
35,45
%/PA= n
1,192
1,2
2,38
1
1
2
Formula minima: CHCl2
peso formula: Pf= 83,9 g/mol
P=0,989 atm V=0,194 l
g
g
1,×0,0821 × 393
RT PM =
RT =
= 168 g/mol=2Pf
PM
PV
0,989 x0,194
Formula molecolare:
C2H2Cl4