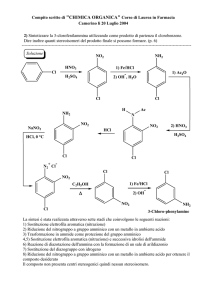
VELOCITA’ DI REAZIONE
•
Analogamente alla velocità di un corpo (velocità = distanza percorsa / tempo impiegato) la
velocità di reazione è definita come la variazione di concentrazione dei prodotti o dei
reagenti nell’unità di tempo.
NO(g) + O3(g) = NO2(g) + O2(g)
v=
d [NO2 ] ∆[NO2 ]
≅
dt
∆t
∆t = t2-t1 = tempo finale- tempo iniziale
∆[NO2] = [NO2]t2 - [NO2]t1 = [NO2]finale - [NO2]iniziale
Ma anche :
•
v=
d [NO2 ] d [O2 ]
d [NO ]
d [O3 ]
=
=−
=−
dt
dt
dt
dt
La variazione di concentrazione dei prodotti è positiva (∆[NO2] > 0), mentre quella dei
reagenti è negativa (∆[NO] < 0). Affinchè il valore della velocità sia positivo
indipendentemente dal considerare i reagenti o i prodotti, si pone un segno – davanti ai
reagenti.
2HI(g) = H2(g) + I2(g)
v=
•
d [H 2 ] d [I 2 ]
1 d [HI ]
=
=−
dt
dt
2 dt
N2(g) + 3H2(g) = 2NH3(g)
v=
d [N 2 ]
1 d [NH 3 ]
1 d [H 2 ]
=−
=−
2 dt
3 dt
dt
Nel primo esempio, per ogni mole di H2 o I2 formate, ne scompaiono 2 di HI. Ciò vuol dire
che ∆[HI] è doppia che non ∆[I2] o ∆[H2]. Per questo si divide la variazione di
concentrazione di ogni componente per il suo coefficiente stechiometrico.
[v] = [concentrazione tempo-1] = [moli volume-1 tempo-1]
(esempio, moli l-1 min-1 oppure moli l-1 sec-1 ecc.)
Per misurare sperimentalmente la velocità, si analizza la variazione di una grandezza legata a uno
dei reagenti o dei prodotti. (Es. se un prodotto è colorato, analizzo come varia l’intensità del colore
della miscela reattiva in funzione del tempo ecc.).
•
La velocità di reazione non è sempre costante nel tempo, ma varia con il procedere della
reazione. All’inizio, quando sono presenti solo i reagenti, è in genere più elevata e tende a
diminuire con l’avanzare della reazione.
Per la reazione CO(g) + NO2(g) = CO2(g) + NO si ha:
v =−
[CO]
[NO2]
-1
(mol l ) (mol l-1)
0.100
0.100
t
(s)
d [C O
dt
] = − d [N O 2 ]
dt
(mol l-1 s-1)
0
3.30E-03
0.067
0.067
10
0.050
0.050
20
0.040
0.040
30
0.033
0.033
40
0.017
0.017
100
0.002
0.002
1000
1.70E-03
1.00E-03
7.00E-04
2.67E-04
0.10
0.10
0.08
0.08
∆t
0.06
[CO2] (mol l-1)
[CO] (mol l-1)
1.67E-05
∆ [CO]
0.04
0.06
∆t
∆ [CO2]
0.04
α
0.02
0.02
tg α = v= -d[CO]/dt
0.00
0.00
0
20
40
60
t (s)
80
100
0
20
40
60
t (s)
80
100
FATTORI CHE INFLUENZANO LA VELOCITA’ ED EQUAZIONI
CINETICHE
La velocità di reazione dipende da diversi fattori:
1. concentrazione dei reagenti
2. temperatura
3. catalizzatori
4. azione di radiazioni
Influenza della concentrazione dei reagenti
Come visto, la velocità di una reazione è tanto più elevata quanto maggiore è la concentrazione dei
reagenti e diminuisce al diminuire di questi. Tuttavia la definizione di velocità indica solo quale è la
velocità istantanea di reazione ad un certo tempo t. Non dice nulla su quale sia la velocità di
reazione per una data concentrazione di reagenti, né come varia la concentrazione di reagenti e
prodotti con il trascorrere del tempo.
Sperimentalmente si osserva che per una reazione generica
aA + bB = cC + dD
la velocità di reazione ad una data temperatura è regolata da una equazione del tipo
v = k [A]α·[B]β
che è detta EQUAZIONE CINETICA
nella quale non necessariamente a=α, b=β, anzi in genere essi sono diversi.
•
•
•
•
•
La costante di proporzionalità k è detta costante di velocità della reazione e dipende dalla
temperatura. La sua unità di misura dipende da α e β in modo tale che v abbia le dimensioni
di [mol volume-1 tempo-1].
I coefficienti α e β sono determinabili solo sperimentalmente. α è detto ordine di reazione
rispetto ad A, β ordine di reazione rispetto a B ecc. (α+β) è detto ordine complessivo della
reazione.
La maggior parte delle reazioni sono di ordine complessivo 1 e 2, raramente di ordine 3. Il
decadimento radioattivo dipende solo dalla concentrazione dei nuclidi instabili ed è una
reazione del primo ordine (vedi appendice).
In prima approssimazione l’ordine della reazione ci dice quante e quali molecole sono
implicate nel processo reattivo che porta alla formazione dei prodotti.
Esistono reazioni complesse che possono portare ad un ordine di reazione non intero oppure
anche 0.
MECCANISMI DI REAZIONE
Le reazioni possono avvenire in 1 stadio:
NO(g) + O3(g) = NO2(g) + O2(g)
Una molecola di NO(g) e una di O3(g) collidono trasferendo così un atomo di O da una all’altra
specie.
v = k [NO][O3]
Questo è anche un esempio di reazione di ordine 2 dove si ha anche a=α ecc.
Altre reazioni possono avvenire in più stadi, che possono coinvolgere dissociazioni di molecole,
trasferimenti di atomi, riarrangiamenti strutturali, trasferimenti di elettroni ecc. L’insieme di questi
stadi o processi elementari è detto meccanismo di reazione. L’equazione cinetica in questi casi
generalmente non corrisponde alla stechiometria della reazione (a≠α ecc.) e può essere piuttosto
complicata.
•
In generale, se più processi intervengono nel meccanismo di reazione, lo stadio più lento è
quello che determina la velocità complessiva della reazione (rate determining step).
Esempio:
2NO2(g) + F2(g) = 2NO2F(g)
Sperimentalmente:
v = k [NO2][F2] (e non v = k [NO2]2[F2] !!!!!!)
In fatti il meccanismo è
NO2(g) + F2(g) = NO2F(g) + .F(g)
.
F(g) + NO2(g) = NO2F(g)
k1, stadio lento
k2, stadio veloce
Lo stadio lento ha equazione cinetica: v = k1 [NO2][F2]
che di fatto è la legge cinetica della
reazione complessiva (v. sopra). (Presenza di intermedi radicalici = meccanismo radicalico)
Influenza della temperatura
•
•
•
In prima approssimazione, affinchè una reazione possa avvenire le molecole di reagente
devono collidere tra di loro. In questo modo possono avvenire trasferimenti di atomi o di
elettroni ecc.
Un urto sarà tanto più efficace (ovvero porta alla formazione dei prodotti) quanto più le
molecole collideranno con urti ad alta energia, ovvero quanto più le molecole saranno veloci
(molecole con maggiore energia cinetica). (H2 + O2 innescata da fiamma)
Non tutti gli urti saranno efficaci, in quanto l’orientazione delle molecole influenzerà il
decorso della collisione.
Collidendo in un urto efficace, le molecole arrivano a formare una specie transiente labile di alta
energia che può o evolvere a prodotti, o ripristinare i reagenti. Tale specie transiente è detta
COMPLESSO ATTIVATO e la sua energia è detta ENERGIA DI ATTIVAZIONE.
•
Tanto maggiore è l’energia di attivazione, tanto più difficile sarà, per le molecole che
collidono, il superamento della collina energetica (v. figura 14.6).
(In ascissa va indicata una grandezza detta coordinata di reazione e non il tempo. La coord. di
reazione indica il cammino della reazione, includendo con questo le distanze degli atomi, le
orientazioni delle molecole ecc.).
Schema della variazione dell’energia per la reazione A + BC = AB + C
(A-B-C)≠ = Complesso attivato
E = Energia di attivazione reagenti verso complesso attivato.
∆E = Differenza di energia fra reagenti e prodotti
•
La frazione di molecole reagenti che raggiunge il complesso attivato dipende dalla loro
energia. Maggiore è questa, maggiore è la probabilità che l’urto sia efficace. In senso stretto
un urto è detto efficace se porta alla formazione del complesso attivato.
UN AUMENTO DELLA TEMPERATURA DEL SISTEMA REATTIVO AUMENTA
L’ENERGIA DELLE MOLECOLE RENDENDO MAGGIORE IL NUMERO DI URTI
EFFICACI RISPETTO AGLI URTI TOTALI.
Sperimentalmente si osserva che la costante di velocità varia con questa legge:
k = A⋅e
− Ea
RT
R = cost. dei gas, T = temperatura, Ea = Energia di attivazione
(equazione di Arrhenius)
A è detto fattore di frequenza, di fatto indipendente dalla temperatura. Esso indica in prima
approssimazione la % di urti con corretta orientazione delle molecole rispetto agli urti totali.
Da qui si dimostra come la costante k sia influenzata solo dalla temperatura.
Influenza dei catalizzatori
•
•
•
Un catalizzatore è una sostanza in grado di aumentare o diminuire la velocità di una
reazione abbassando o aumentando l’energia di attivazione.
NON INTERVENGONO SULL’EQUILIBRIO. Infatti essi promuovono, in linea di
principio, la reazione in un senso ma anche nel senso opposto.
Di fatto un catalizzatore agisce sul sistema reattivo permettendo meccanismi di reazione
alternativi per i quali l’energia di attivazione è minore.
I meccanismi di azione dei catalizzatori sono molteplici: possono accettare specie atomiche da A
per trasferirle a B, possono trasferire elettroni, possono aiutare a rompere certi legami per formarne
altri ecc.
•
Marmitta catalitica: sostanze solide sulla cui superficie avvengono reazioni di
combustione (C + O2 = CO2), trasferimenti di ossigeno (da NO a CO per dare N2 + CO2 ad
esempio).
Esempio di meccanismo di reazione per 2N2O = 2N2 + O2 catalizzata da oro metallico.
•
Enzimi: catalizzatori biologici. Macromolecole che possono inglobare o formare legami con
altre molecole (chiamate substrato) permettendo reazioni più veloci fra queste ultime. Esse
possono agire come segue:
1. Rendendo alcuni legami più deboli, in modo che si possano rompere più facilmente.
2. Posizionando le molecole A in modo opportuno in modo che gli urti con B siano,
almeno per l’orientazione, sempre efficaci.
3. Interagire con due molecole A e B contemporaneamente in modo che esse possano
reagire nella corretta orientazione ecc.
Reazione non catalizzata
A+B=P
Reazione catalizzata dall’enzima E
A + E = (AE)
(AE) + B = E + P
Lipasi: idrolisi (rottura) degli acidi grassi
Tripsina: idrolisi di proteine ad amminoacidi
DNA polimerasi: costruisce filamenti di DNA partendo dai nucleotidi ecc.
•
Catalizzatori che rendono la reazione più lenta che in caso di loro assenza (ovvero che
innalzano l’energia di attivazione) sono detti INIBITORI.
Influenza delle radiazioni
•
Intuitivamente, radiazioni elettromagnetiche ad alta energia interagiscono con gli elettroni in
una molecola. Irragiando con radiazioni intense di opportuna lunghezza d’onda si possono
rompere legami, formare radicali ad alta reattività ecc. Tutto questo contribuisce ad
aumentare la velocità di reazione.
Es. H2 + Cl2 = 2HCl al buio avviene lentamente (con meccanismo radicalico).
Alla luce è più rapida in quanto
Cl2 = 2Cl.
Stadio promosso dalla luce
H2 + Cl. = HCl + H.
H. + Cl2 = HCl + Cl.
e così via…
La reazione procede finchè:
2H. = H2
2Cl. = Cl2
APPENDICE:
UN CASO DI ESEMPIO DI REAZIONE DEL 1° ORDINE:
IL DECADIMENTO RADIOATTIVO
Il numero di particelle radioattive (es. atomi di uranio 238, 238U) che decadono nella unità di tempo
è proporzionale al numero di particelle presenti in quel momento. Questo significa che data una
certa quantità x di particelle per le quali in 1 minuto misuro 200 decadimenti, per una quantità 2x
dovrei misurare 400 decadimenti e così via.
In altre parole, la variazione di concentrazione di particelle radioattive nella unità di tempo (ossia la
velocità di decadimento) è proporzionale alla concentrazione stessa.
−
dC
= k ⋅C
dt
dC
= − k ⋅ dt
C
da cui separando le variabili:
ed integrando:
C = C0 ⋅ e − k ⋅t
dove C0 è la concentrazione a t = 0 e c la concentrazione al tempo t.
Nel caso di una reazione del 1° ordine la concentrazione del reagente diminuisce esponenzialmente
nel tempo.
Osservando la prima equazione si ricava che la costante k ha le dimensioni dell’inverso del tempo.
[k] = [t-1] (es. min-1 ecc.).
Si definisce tempo di dimezzamento (τ0.5) il tempo necessario affinché la concentrazione C0 iniziale
si riduca alla metà. Dopo questo tempo, inserendo nell’ultima equazione vista:
C=
C0
= C0 ⋅ e − k ⋅τ 0.5
2
da cui con un paio di passaggi:
τ 0.5 =
1
= e − k ⋅τ 0.5
2
log e
1
= −k ⋅ τ 0.5
2
e quindi:
0.693
k
Il tempo di dimezzamento per una reazione del 1° ordine è indipendente dalla concentrazione ed è
funzione solo della costante di velocità k.
In altre parole, per una particella radioattiva il tempo di dimezzamento è funzione del tipo di
particella (238U o 226Ra ad esempio) e non della loro concentrazione. Esistono isotopi o elementi
con tempi di dimezzamento di pochi secondi, altri di anni e così via…