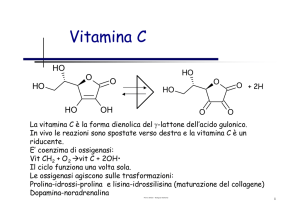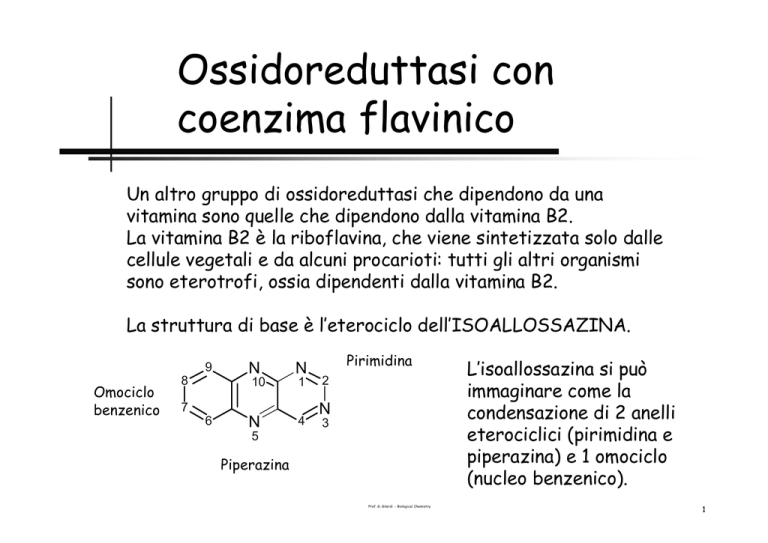
Ossidoreduttasi con
coenzima flavinico
Un altro gruppo di ossidoreduttasi che dipendono da una
vitamina sono quelle che dipendono dalla vitamina B2.
La vitamina B2 è la riboflavina, che viene sintetizzata solo dalle
cellule vegetali e da alcuni procarioti: tutti gli altri organismi
sono eterotrofi, ossia dipendenti dalla vitamina B2.
La struttura di base è l’eterociclo dell’ISOALLOSSAZINA.
9
Omociclo
benzenico
8
N
N
10
1
N
4
7
6
Pirimidina
2
N
3
5
Piperazina
Prof. G. Gilardi - Biological Chemistry
L’isoallossazina si può
immaginare come la
condensazione di 2 anelli
eterociclici (pirimidina e
piperazina) e 1 omociclo
(nucleo benzenico).
1
Vitamina B2
Nella forma naturale della vitamina la
porzione pirimidinica è sostituita (come
nell’uracile) nelle posizioni 2 e 4 da due
funzioni ossigenate. L’equilibrio è
totalmente spostato nella forma
lattamica.
Il nucleo benzenico è totalmente
aromatizzato, il nucleo piperazinico è
anch’esso in forma lattamica e si hanno
ulteriori sostituzioni:
In 7 e 8: sostituzioni metiliche
In 10: catena polialcolica a 5 atomi di
carbonio del ribitolo, ottenibile dal
riboso per idrogenazione.
Prof. G. Gilardi - Biological Chemistry
HO
H3C
HO
H
HO
H
HO
H
H
H
N
H
N
O
NH
H3C
N
H
O
Forma ridotta = vitamina B2
2
Vitamina B2
La possibile comparsa di ulteriori insaturazioni e l’equilibrio tra
forma lattamica e lattimica fa sì che questa struttura possa
funzionare da CROMOFORO (ha colorazione gialla).
Quando viene assunta da un organismo eterotrofo o dopo la
biosintesi in un autotrofo, la B2, per poter diventare coenzima,
deve venire MARCATA PER FOSFORILAZIONE.
Gli enzimi responsabili di questa marcatura sono transferasi ( o
CINASI) che hanno nel sito catalitico un metallo di transizione che
destabilizza il legame pirofosforico, formando un fosfato-catione
che può dare attacco elettrofilo sui gruppi alcolici, in questo caso
sul gruppo alcolico primario 5’ del ribitolo.
Prof. G. Gilardi - Biological Chemistry
3
Flavinmononuleotide (FMN)
La fosforilazione produce un composto
5’
H2 C O
dove non è presente un vero saccaride
ma un prodotto di trasformazione di
HO
C
H
un saccaride per riduzione. Inoltre è
HO
C
H
presente un gruppo fosforico e un
eterociclo azotato (particolare base
HO
C
H
azotata): si può quindi definire un
H
C
H
NUCLEOTIDE, il flavinmononucloetide
o FMN.
H3C
N
Questo composto è già coenzima di
molte ossidoreduttasi flaviniche che
nelle cellule eucariotiche hanno
N
H3C
H
distribuzione
EXTRAMITOCONDRIALE.
Flavinmononuleotide (FMN)
Prof. G. Gilardi - Biological Chemistry
O
P
O-
O-
H
N
O
NH
O
4
FAD
(flavinadenildinucleotide)
Il secondo tipo di coenzima flavinico (FAD) si ottiene per intervento di una
reazione a cui partecipa l’ATP. Il promotore della costruzione del FAD è un
ENZIMA MANGANESE-DIPENDENTE: Il Mn destabilizza il legame
pirofosforico tra i fosforili α e β, ne promuove la scissione con la comparsa
di un catione sul fosforile α. Il catione subisce attacco nucleofilo da parte
dell’ossigeno del fosforile dell’FMN.
O
FMN
H 2C
O
HO
C
H
HO
C
H
HO
C
H
P
O-
NH2
O-
N
O
O
O
+
N
HO P O P O P O
H
H3C
C
N
H
OH
H
N
O
OH
N
N
O
OH
α
OH OH
NH
H3C
Mn-Enzima
N
H
O
Prof. G. Gilardi - Biological Chemistry
5
FAD:
(flavinadenildinucleotide)
Il FAD è composto da due nucleotidi: FMN e AMP.
O
H3C
H2 C
O
HO
C
H
HO
C
H
HO
C
H
H
C
H
N
O
P
O
P
NH 2
N
N
N
N
O CH 2
O
OH
O-
OH OH
H
N
O
NH
H3C
N
H
O
Prof. G. Gilardi - Biological Chemistry
6
FAD
Le due reazioni stechiometriche sono:
rF + ATP
ADP + FMN
FMN + ATP
FAD + Ppi
Dove rF = riboflavina
Ppi = residuo pirofosforico
Nelle cellule eucariotiche il FAD è caratteristico delle
ossidoreduttasi INTRAMITOCONDRIALI.
La fosforilazione rende riconoscibile il coenzima da parte della
propria apoproteina. I fosforili intervengono solo parzialmente nel
legame con la proteina. Infatti si hanno interazioni deboli e apolari.
Prof. G. Gilardi - Biological Chemistry
7
FAD: legame alla apoproteina
L’interazione tra coenzima e apoproteina avviene tramite
legami deboli e interazioni apolari.
Nel sito attivo dove ha posto il coenzima si realizzano
interazioni tra i gruppi dissociabili del sito attivo e i
fosforili e le posizioni 2, 3, 4 del FAD.
Si formano ponti H e le posizioni 2, 3, 4 subiscono processi
di protonazione e deprotonazione.
Prof. G. Gilardi - Biological Chemistry
8
FMN: interazioni con il
sito attivo
L’ FMN occupa uno spazio più ridotto nel sito attivo e gli
enzimi FMN-dipendenti hanno nel sito attivo aminoacidi
acidi disposti a simmetria ottaedrica e quindi in grado di
accogliere FERRO.
Le flavoproteine FMN sono FERROFLAVOPROTEINE.
Anche le FAD-flavoproteine sono spesso ferroproteine, ma
per il funzionamento del FAD, oltre al ferro, sono necessari
gli ioni cofattori.
Prof. G. Gilardi - Biological Chemistry
9
Equilibri forma RED. e OX.
La molecola del FAD è ripiegata in modo che i due eterocicli
dell’isoallossaziona e dell’adenina si trovano su piani paralleli e
affacciati. Calcio, magnesio e manganese (ioni cofattori),
trasportando elettroni, possono regolare le interazioni tra le
forme lettimiche e lattamiche degli eterocicli, mettendoli in
condizione di accettare o cedere idrogeno. L’equilibrio
interessa le posizioni 1 e 5.
H1
1
H3C
H3C
N
N
H3C
N
N
NH
N
5
O
NH
H3C
O
Forma ossidata (1, 5 deidrogenata)
O
5
N
H
O
Forma ridotta (1, 5 idrogenata)
Prof. G. Gilardi - Biological Chemistry
10
Substrati delle
ossidoreduttasi flaviniche
1. Unità a due atomi di carbonio
2 gruppi metilenici o metinici contigui possono venire
idrogenati o deidrogenati a seconda del tipo di enzima e quindi
del potenziale a cui l’enzima si trova.
Si tratta di due carboni che devono essere sempre molto
prossimi ai terminali che a loro volta devono essere portatori
di parziale carica positiva.
CH2
CH2
+
FAD
CH
CH
FMN
Prof. G. Gilardi - Biological Chemistry
+
FADH2
FMNH2
11
Substrati delle
ossidoreduttasi flaviniche
2. Interazione con i coenzimi piridinici
Entrambi i coenzimi sono inseriti nelle rispettive strutture
apoenzimatiche
FADH2
NAD+
FAD
+
+
FMNH2
NADH + H+
NADP+
FMN
NADPH + H+
In vivo l’equilibrio è spostato verso sinistra (nella serie
elettrochimica degli enzimi redox il senso del trasporto di unità
riducenti è dal coenzima piridinico a quello flavinico)
Prof. G. Gilardi - Biological Chemistry
12
Substrati delle
ossidoreduttasi flaviniche
3. Interazione con i coenzimi chinonici
FADH2
FAD
+
+
CoQ
FMNH2
CoQH2
FMN
Le unità riducenti vengono trasportate dalla struttura
isoallossazinica alla struttura chinonica che diventa fenolica e
viceversa. Anche queste reazioni sono modulabili in vitro. In vivo
i CoQ nella serie elettrochimica stanno dopo i coenzimi flavinici:
l’equilibrio in vivo sarà spostato a destra.
Prof. G. Gilardi - Biological Chemistry
13
Substrati delle
ossidoreduttasi flaviniche
4. Ossigenasi flaviniche: DIOSSIGENASI
FADH2
FAD
+
+
O2
FMNH2
2 OH•
FMN
Le ossigenasi flaviniche usano come substrato l’ossigeno
molecolare. Le reazioni sono irreversibili e la resa in radicale
OH• è doppia rispetto alle ossigenasi con coenzimi piridinici.
Anche in questo caso l’enzima può accogliere nel sito attivo un
substrato a cui l’ OH• viene addizionato per fenomeni di
sostituzione radicalica.
Prof. G. Gilardi - Biological Chemistry
14
Proteine flaviniche
Le proteine a cui si legano i coenzimi flavinici possono essere:
Albumine
Globuline
La grande maggioranza delle flavoproteine ha lunghe sequenze di
aminoacidi poco polari che costituiscono estesi domini idrofobici.
La maggior parte delle flavoproteine sono inserite in membrane,
sia del reticolo endoplasmatico (enzimi extramitocondriali), sia
nelle membrane dei mitocondri (nelle cellule eucariotiche).
Prof. G. Gilardi - Biological Chemistry
15
Lesione biochimica da
carenza di vitamina B2
Comporta una lesione dei processi ossidoreduttasici che riguarda sia il
semplice trasporto delle unità riducenti (e quindi la rigenerazione dei
coenzimi piridinici) con effetti sulla catena respiratoria e la respirazione
cellulare, sia sulla ossidoriduzione delle unità bicarboniose, con effetto
sul metaqbolismo lipidico che si traduce in una CARENZA della SINTESI
di FOSFO e GLICOLIPIDI.
Risultano colpiti, per quanto riguarda la respirazione, il tessuto nervoso,
muscolare e epiteliale.
Il tessuto nervoso risulta doppiamente colpito per la riduzione del
turnover dei lipidi, che danneggia le membrane mieliniche.
La carenza si manifesta quindi con NEVRITI e può causare lesioni
cerebrali.
Il fabbisogno quindi viene calcolato per ciascuna specie su:
1: flusso ossidoreduttasico
2: turnover dei lipidi
Prof. G. Gilardi - Biological Chemistry
16
Ossidoreduttasi chinoniche
In queste ossidoreduttasi il gruppo prostetico porta una struttura
benzenica (benzochinoni) con la struttura del paradifenolo che
può diventare un parachinone.
In posizione 2 abbiamo sempre un metile
Se le posizioni 5 e 6 erano sede di un gruppo fenolico, questo
viene bloccato per metilazione.
In 3 è presente un sostituente che servirà da aggancio con la
proteina.
Il sostituente in 3 ricorda la struttura del fitolo della clorofilla,
ossia una lunga catena apolare (idrofobica) che interagisce con un
sito idrofobico molto sviluppato in lunghezza superficiale della
proteina globulare (solco). La porzione reattiva (nucleo
benzochinonico, naftochinonico o anello del cromano) sporge verso
l’esterno.
Prof. G. Gilardi - Biological Chemistry
17
Coenzima Q
O
CH3
H3C O
Benzochinone
H3C O
X
O
X:
H2C
CH C
H
CH3 5/10
Prof. G. Gilardi - Biological Chemistry
Es. Nei coenzimi Q5
la sequenza si ripete
5 volte.
18
Vitamina K
O
CH3
naftochinone
X
O
H2 C
CH C
CH3
Prof. G. Gilardi - Biological Chemistry
CH2 CH3
5,6
19
Vitamina E
CH3
HO
CH3
H3C
O
CH3
CH3
CH3
CH3
CH3
Derivati del cromano
Prof. G. Gilardi - Biological Chemistry
20
Vitamina E: attivazione
CH3
HO
X=
4
3
OH 2
H3C
1 HO
CH3
CH 3
CH3
CH 3
CH3
X
CH3
La vitamina E per funzionare deve subire, dopo l’inserzione a gruppo
prostetico, un processo di attivazione specifico. Si tratta di una
reazione ossigenasica operata da una ossidoreduttasi specifica con
coenzima piridinico. Si ha sostituzione radicalica con un OH• in
posizione 2. Si ha l’apertura dell’eterociclo tra 1 e 2 con formazione di
un omociclo difenolico (con ossidrili in para). Si possono avere
transizioni in forma chinonica
Prof. G. Gilardi - Biological Chemistry
21
Vitamina E: effetto redox
CH3
CH3
HO
O
HO
H3C
OH
CH3
HO
X
CH3
H3C
O
CH3
X
CH3
Vit E H2 + O2 à 2 OH• + Vit E
Gli OH • sono specificamente indirizzati alla trasformazione del
carotene verso i precursori della vitamina A.
Carotene + 4 OH • à ciclocitrale + carotenale
Prof. G. Gilardi - Biological Chemistry
22
CoQ: collocazione nella
serie elettrochimica
FADH2
FAD
+
+
CoQ
FMNH2
CoQH2
FMN
I CoQ hanno potenziale di riferimento confrontabile con quello
dell’elettrodo a idrogeno.
L’equilibrio redox tra CoQ e CoQH2 prevede una transizione del
benzochinone a fenolo ( e corrispondentemente del naftochinone a
naftolo nella vit. K e chinone-difenolo della vit. E).
O
CH3
Es. vit K
HO
CH3
X
X
OH
O
Prof. G. Gilardi - Biological Chemistry
23
CoQ: collocazione nella
serie elettrochimica
CoQ + 2 Cyt Fe++ + 2H+
CoQH2 + 2Cyt Fe+++
I Coenzimi chinonici (Q, K e E) possono interagire con i citocromi.
In vivo l’equilibrio è spostato a destra.
Prof. G. Gilardi - Biological Chemistry
24
Vitamina K: coinvolgimento
nella coagulazione del sangue
L’enzima specifico che ha come coenzima la vitamina K è in
grado di promuovere sulla protrombina neosintetizzata la
formazione di ponti disolfuro che la organizzano in una
struttura terziaria stabile e ben precisa. La protrombina
assume così la sua struttura funzionalmente efficace.
La vitamina K prende quindi il nome di vitamina
antiemorragica, per il controllo esercitato sui fattori di
coagulazione (anche se NON è un fattore di coagulazione).
Prof. G. Gilardi - Biological Chemistry
25
Vitamina K nei tessuti vegetali
La vitamina K in forma ridotta, nei tessuti vegetali viene riconosciuta
da enzimi che marcano le molecole con fosforile, ma in questo caso è
riconosciuta da una semplice idrolasi (enzima di classe 3). Con nessun
dispendio energetico si passa alla vitamina nella sua forma fosforilata.
OH
Vit KH2 + H3PO4 àVit K P
O
Si forma una struttura
Semiossidata METASTABILE,
in disequilibrio.
Si passa da estere fenolico a
estere enolico, a più alta energia.
Si forma ATP e la vit K da metastabile
torna nella forma ossidata stabile.
Vit K P + ADPàVit K + ATP
Prof. G. Gilardi - Biological Chemistry
P
HO
OH
O
O
CH3
P
HO
O
CH3
+
X
O
X
O
O
CH3
X
O
26
Vitamina A
CH3
H3C CH3
CH3
OH
CH3
Retinolo
Prof. G. Gilardi - Biological Chemistry
27
β-carotene: produzione
della vitamina A
H3C
H3C
CH3
17
CH3
16
1
7
2
6
3
5
CH3
19
11
13
10
12
15
14'
14
15'
12'
13'
20'
CH3
10'
11'
CH3
4
5'
3'
6'
2'
20
9
8
4'
18'
8'
9'
7'
1'
CH3
H3C
19'
CH3
16'
17'
18
H3C
CH3
17
CH3
16
1
2
7
6
3
20
9
8
11
10
H
13
12
15
14
14'
15'
12'
13'
10'
11'
CH3
5
4
CH3
19
CH3
20'
18
OH
8' OH
H3C
18'
9'
CH3
19'
4'
5'
3'
6'
H
HO
2'
7'
1'
OH
H3C
16'
Prof. G. Gilardi - Biological Chemistry
CH3
17'
28
β-carotene: produzione
della vitamina A
H3C
CH3
17
CH3
16
1
2
7
6
3
CH3
19
20
9
8
11
10
H
13
12
15
14
14'
15'
13'
10'
11'
CH3
5
4
12'
CH3
18
20'
O
8'
9'
CH3
19'
carotenale
H3C
18'
Viene trasformata in acido e trasferita sul CoA
4'
5'
3'
6'
H
O
2'
7'
1'
H3C
16'
CH3
17'
ciclocitrale
Prof. G. Gilardi - Biological Chemistry
29
β-carotene: produzione della
vitamina A
H3C
CH3
17
CH3
16
1
7
2
6
3
5
4
CH3
19
20
9
8
11
10
O
13
12
15
14
14'
15'
12'
13'
CH3
20'
CH3
10'
11'
8'
9'
S-CoA
CH3
19'
18
§ L’accorciamento avviene fino alla posizione 1515’, dove l’orientamento del legame trans è
caratteristico (centro dei fenomeni di
florescenza) e quindi riconosciuto dall’enzima
che si blocca
Prof. G. Gilardi - Biological Chemistry
30
β-carotene: produzione della
vitamina A
H3C
CH3
17
CH3
16
1
2
7
11
8
O
20
9
6
3
CH3
19
13
10
12
15
S-CoA
14
5
4
CH3
§ Scissione reduttasica
18
H3C
CH3
17
CH3
16
1
7
2
6
3
5
4
CH3
19
9
8
O
20
11
10
13
12
15
14
H
Vitamina A1
CH3
18
Prof. G. Gilardi - Biological Chemistry
31