Vitamina C
HO
O
HO
HO
O
O
O + 2H
HO
HO
OH
O
O
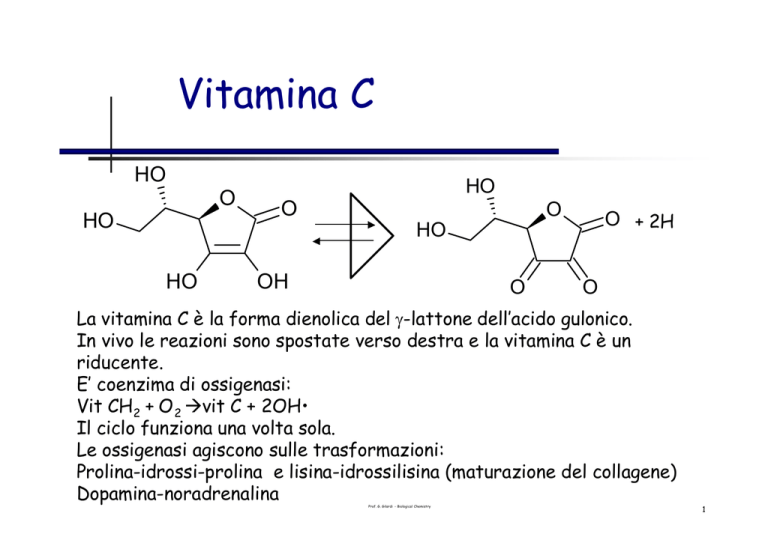
La vitamina C è la forma dienolica del γ-lattone dell’acido gulonico.
In vivo le reazioni sono spostate verso destra e la vitamina C è un
riducente.
E’ coenzima di ossigenasi:
Vit CH2 + O 2 àvit C + 2OH•
Il ciclo funziona una volta sola.
Le ossigenasi agiscono sulle trasformazioni:
Prolina-idrossi-prolina e lisina-idrossilisina (maturazione del collagene)
Dopamina-noradrenalina
Prof. G. Gilardi - Biological Chemistry
1
Vitamina B8 (Pterina)
O
4
N
N
5
3
2
H2 N
6
H
H
C
C CH3
OH
OH
Pterina
7
N
H
N
8
1
O
HN
H2 N
H
N
H
H
C
C CH3
OH
OH
N
N
H
Diidropterina (PtH2)
OH
H
HN
H2N
H
N
H
H
C
C CH3
OH
OH
N
N
H
Tetraidropterina (PtH4)
PtH4 + O2 à2OH• + PtH2 Gli OH• servono per la trasformazione F à Y
Prof. G. Gilardi - Biological Chemistry
2
Derivazione della Pterina
dalla Guanosina
O
O
OH•
N
HN
H
N
HN
O
8
H2N
N
H2N
N
O
H2C
N
N
OH
O
OH
OH
H2C
OH
OH
OH
Prof. G. Gilardi - Biological Chemistry
3
Derivazione della Pterina
dalla Guanosina
O
HN
8
H2N
N
O
OH•
H
N
OH•
N
O
OH
H2C
OH
H2 N
+ H2CO3
NH2
HN
O
NH
N
O
OH
OH-
Prof. G. Gilardi - Biological Chemistry
OH
H2 C
OH
OH
4
Classe 2 _ TRANSFERASI
§
§
§
§
§
§
§
§
§
§
§
§
CLASSE 2 di ENZIMI: TRANSFERASI
Meccanismo di trasferimento gruppi
Classe delle transferasi
CODICE a 4 numeri
2.b.c.d.
La seconda cifra indica la sottoclasse: il tipo di gruppo trasferito (es. sottoclasse
relativa ai trasferimenti delle unità ad 1 C o a unità saccaridiche)
La sottosottoclasse (3°) definisce esattamente il tipo di gruppo trasferito.
(Definizione completa della reazione catalizzata).
Es. Nella sottoclasse delle transferasi che trasferiscono gruppi ad un solo atomo di C. Ci
saranno le metiltransferasi che trasferiscono gruppi metilici oppure metilenici ecc…..
Es. Sottoclasse: glicosiltransferasi (sottosottoclasse: esosi, pentosi); viene precisato il
gruppo che viene trasferito.
Anche le transferasi hanno sempre un gruppo prostetico (derivato vitaminico o atomo di
Me di transizione).
Eccezionalmente: alcune, attraverso una associazione di R aa formano di per se il gruppo
transferasico (eccezioni: senza gruppo prostetico).
Molti derivano dalle vit. Gruppo B.
Prof. G. Gilardi - Biological Chemistry
5
Classe 2 _ TRANSFERASI: coenzimi
§
§
§
Alcune transferasi sono proteine coniugate (apoenzima + coenzima).
Il coenzima di molte transferasi deriva dalla trasformazione di una
vitamina del gruppo B
Nel dettaglio vedremo le caratteristiche di reazione di transferasi
che contengono come coenzima:
§ TIAMINPIROFOSFATO o TPP (derivato dalla VITAMINA B1)
§ FOSFOPANTOTEINA E COENZIMA A (derivati dalla
VITAMINA B3 )
§ PIRIDOXALFOSFATO o PALP (derivato dalla VITAMINA B6 )
§ TETRAIDROFOLATO o FH4 (derivato dalla VITAMINA B8 )
§ ACQUACOBALAMIDE COENZIMA (derivato dalla VITAMINA
B12 )
Prof. G. Gilardi - Biological Chemistry
6
Classe 2 _ TRANSFERASI: coenzimi
NH2
CH3
N
H3C
CH3
N
N
Cl
+
S
-
OH
NH2
N
H3C
CH3
N
N
-
Cl
+
S
-
OH
§ TIAMINPIROFOSFATO o TPP (derivato dalla
VITAMINA B1)
Prof. G. Gilardi - Biological Chemistry
7
NH2
4
Vitamina B1
3N
H3C 2 N 1
CH3
3’+
5
N
6
4’
2’ S
1’
5’
Cl
-
OH
§ La vit B1, viene sintetizzata da vegetali e
alcuni procarioti deriva dall’unione di 2
strutture eterocicliche: PIRIMIDINA e
TIAZOLO.
§ L’unione coinvolge il metile in 5 (metilene
e l’N in 3 del tiazolo N + quaternario).
§ VITAMINA B1= TIOAMINA
Prof. G. Gilardi - Biological Chemistry
8
Vitamina B1
§
§
§
§
Il passaggio a CoE prevede il consumo di una mole di ATP per mole.
L’ATP viene scomposto in AMP e pirofosfato ed il pirofosfato viene
trasferito sulla struttura idrossimetilica.
L’enzima che opera questa trasformazione ha l’atomo di Mn nel sito
attivo; questo destabilizza il primo legame dianidride e permette
così la scissione ed il trasferimento del catione pirofosfato sull’OH.
La molecola così strutturata è riconosciuta ed accettata
dall’apoproteina. Le strutture pirofosforiche hanno alto potenziale
(quindi il potenziale complessivo è stato aumentato). L’unione
coinvolge il metile in 2 (metilene) è COVALENTE.
NH2
Il metilene
N
interagisce con il
2
carbocatione
H3C
N
ottenuto da un
residuo di Ser per
sottrazione dell’OH.
CH3
Cl
+
N
O
S
OH
P
+
OH
Prof. G. Gilardi - Biological Chemistry
O
O
P
OH
OH
9
Classe 2 _ TRANSFERASI: TPP
§
§
§
§
§
TIAMINPIROFOSFATO o TPP (derivato dalla VITAMINA B1)
La vit B1 sotto forma di TIAMINPIROFOSFATO è CoE di transferasi
ma anche di LIASI. (stesso meccanismo).
La molecola è piegata attorno al gruppo metilenico ed i 2 eterocicli si
trovano su piani paralleli, affacciati.
Anche in questo caso avremo non cofattori (Mg, Ca, Mn) che tra i 2
eterocicli stabilizzano (amplificano) la trasformazione delle forme
pirimidinica da lattimica a semilattamica.
Queste transizioni promuovono, attraverso la ridistribuzione delle
forme tautomeriche mediata dagli ioni cofattori, il passaggio della
struttura tiazolica da una forma con N3’ N + quaternario ad uno dove il
doppio legame è indirizzato verso l’esterno (sul 2’).
CH3
CH
3
N
+
N
+
S
S
Prof. G. Gilardi - Biological Chemistry
10
TPP: effetto catalitico
Le transferasi (cl. 2) che usano il tiaminpirofosfato come CoE sono le
TRANSCHETOLASI; riconoscono come substrati i chetosi.
In posizione 1: gruppo alcolico primario; posizione 2: chetone.
Accettano nel sito attivo solo i chetosi col C3 in L configurazione
Il sito che lega il substrato è il carbonio in 2’. Il C carbonilico (in 2) del
substrato è sede di δ + sul C, si ha attacco nucleofilo del carbanione. Il
carbanione è riducente e il legame covalente che forma riduce il gruppo
chetonico a gruppo alcolico terziario.
CH3
H 2C
OH
δ+ C=O
HO
CH2
X
H 2C
CH3
N
+
S
HO
C
HO
CH2
OH
N
+
S
X
Prof. G. Gilardi - Biological Chemistry
11
TPP: effetto catalitico
Quando si ha la catalisi il doppio legame si realizza tra C2’ e C2 del substrato a
spese degli e− di legame tra C2 e C3 del substrato.
C3: carbocatione che viene neutralizzato dagli ossidrili del mezzo
§ 1° prodotto di reazione è la porzione C3-Cn: si ottiene un aldoso con 2 atomi
di C in meno. Questo primo prodotto può uscire dal sito attivo dell’enzima
mentre nel sito restano gli atomi ex 1 e 2 del chetoso.
CH3
H2C
HO
OH
C
CH 2
X
+
OH
S
+
HO
N
HO
CH2
1° prodotto
Aldeide idrata
Aldoso con n-2 C
X
OH -
Prof. G. Gilardi - Biological Chemistry
12
TPP: effetto catalitico
Il ritorno dell’equilibrio degli eterocicli alla forma più insatura porta alla
comparsa della struttura in cui il substrato (in forma anionica) è legato
con legame semplice al CoE.
CH3
CH3
+
CH2 OH
N
+
CH2 OH
N
HO
C
S
δ+ CH
O
aldoso
X
C
HO
Il cosubstrato che entra nel
sito dopo che era uscito il
primo prodotto di reazione
deve poter accettare
l’attacco del carbanione
è un altro saccaride (con un
gruppo carbonilico)
ALDOSO.
HO
3
S
CH Il carbonile è
ridotto a gruppo
alcolico con L
configurazione.
X
Prof. G. Gilardi - Biological Chemistry
13
TPP: effetto catalitico
Il manganese nel sito attivo legandosi all’O in 2 promuove la scissione
dell’enzima
con ripartizione ineguale degli e− (il C 2 ha struttura
carbanionica)
La molecola poi si attesta creando un doppio legame C=O e dissociando 1 H + .
LE TRANSCHETOLASI sono presenti in:
ciclo dei PENTOSI
ciclo di CALVIN
reazioni anaplerotiche che servono a ricostruire i substrati
I saccaridi quando partecipano a queste reazioni sono fosforilati (marcati) nel
terminale.
CH 2 OH
H+
O
HO
CH3
C
CH
X
N
+
S
Prof. G. Gilardi - Biological Chemistry
14
TPP: esempio di catalisi
H 2C
C
HO C
H C
H C
H 2C
OH
O
H
OH
OH
§
+
HC
H C OH
H2 C O P
OP
Fruttoso 6 fosfato
F⋅6⋅P (chetoso)
§
§
§
O
Gliceraldeide fosfato
GAP (aldoso)
OH
H2 C
C O
HO C H
H C OH
H2 C
OP
+
Xiluloso 5 fosfato
Xu 5 P (chetoso)
O
HC
H C OH
H C OH
H2 C
OP
Eritroso 4fosfato
E 4 P (aldoso)
F⋅6⋅P + GAP à Xu⋅5P + E−4−P
La transferasi trasferisce il chetolo:
il GAP accetta 2 C e diventa un nuovo chetolo con L conf. del C3
Xiluloso 5 P mentre il fruttoso che aveva 6C ne perde 2 e 4C danno
l’eritroso 4 fosfato.
Le reazioni transferasiche sono sempre reversibili (in vivo ed in vitro) e lo
spostamento dell’equilibrio è dovuto solo all’attività dei composti.
Prof. G. Gilardi - Biological Chemistry
15












