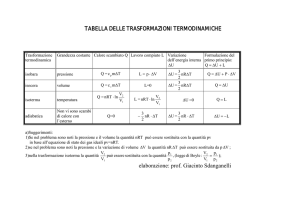
Calori specifici Capacità termica e calore specifico - Il calore si trasferisce da un corpo ad un altro
fintanto che i corpi sono a temperature differenti.
Potremo scrivere quindi: Q = C ΔT = C (Tf – Ti)
- Naturalmente questo trasferimento di calore
dipenderà da quanta massa è coinvolta.
- La costante C che compare nella relazione è detta
capacità termica ed è l’inerzia termica di un corpo al
variare della temperatura.
- Più grande è la massa di un corpo più grande è la
sua inezia termica
- Pertanto risulta conveniente definire un calore
specifico come la capacità termica per unità di massa,
che tiene conto solo della diversa natura del materiale
e non dalla massa coinvolta nel processo
Q = cs m (Tf –Ti)
Sostanza stato J/(kg K) Acqua Ghiaccio liquida solido 4186 2090 Alluminio Acciaio Solido solido 880 502 Diamante Grafite 502 720 Rame Oro 385 129 Aria (secca) Ossigeno 1005 920 Silice (fusa) Silice Solido gassoso 703 2020 Etanolo PolisKrene Liquido solido 2460 1450 Calore specifico:
gas monoatomici
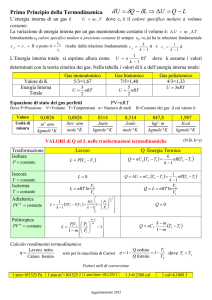
Supponiamo di avere n moli di gas confinato in un cilindro e il suo stato sia descriNo dal punto p. Dando calore al sistema, bloccato a volume costante, aumenterà la pressione e la temperatura. Per il I
°Principio deve essere: ΔEint = Q – w dove Q = n cv ΔT e w = 0 (cv è il calore specifico a volume costante) Quindi per un processo isocoro ΔEint = n cv ΔT ed il calore specifico a volume costante è: cv = ΔEint/nΔT. Per un gas perfe9o, c’è solo energia cine?ca, quindi ΔEint = (3/2)nR ΔT e quindi avremo 3 2 nRΔT 3
cv =
= R = 12,5 J ⋅ mol −1K −1
nΔT 2
La Eint si potrà anche esprimere come Eint = n cv T [
]
Transformazioni e calori specifici Per un gas ideale la variazione di Eint non dipende dalla trasformazione termodinamica subita, ma solo dall’en?tà della variazione di temperatura subita P
isobara
isocora
adiabatica
T + ΔT
T
V
ΔEint = nCV ΔT
Valida per qualunque trasformazione di un gas perfetto
Calore specifico
a pressione
costante
Supponiamo ora di fornire
calore al solito sistema,
mantenendo costante la
pressione e lasciando
variare il volume:
Q = n cp ΔT.
cp sarà > di cv poiché il calore Q dovrà inalzare la temperatura e
compiere lavoro esterno. Ricordiamo che ΔEint = Q – w potremo
riscriverla come:
n cv ΔT = n cp ΔT – p ΔV
n cv ΔT = n cp ΔT – (n R ΔT)*
Dividendo tutto per nΔT
cv = cp – R
* Differenziale dell’equazione di stato dei gas perfetti
cp = cv + R
pΔV = nRΔT
Calore specifico molare molecola
esempio
cv [J/(mol K)]
monoatomica
Ideale
He
Ar
3/2 R = 12,5
12,5
12,6
biatomica
Ideale
N2
O2
5/2 R = 20,8
20,7
20,8
poliatomica
Ideale
NH4
CO2
3R = 24,9
29,0
29,7
• Per tutti i gas che possono
essere assimilati a gar perfetti il
calore specifico dovrebbero
valere 3/2R, ma per i gas
biatomici o poliatomici i cv sono
diversi.
• Teorema dell’equipartizione dell’energia:
Sono i gradi di libertà posseduti dalle molecole a definire in quanti
modi si possa immagazzinare energia. Per ogni grado di libertà
posseduto, una molecola può assorbire ½ kT di energia
cv = (f/2) R = 4,16 f [J/(mol K)]
Gradi di libertà, cv e cp Si deve a J.C. Maxwell la soluzione del
problema relativo alla deviazione dei cv in
relazione dei valori previsti.
Lavoro di un gas perfeNo • Una curva isoterma, nel piano V-­‐p, è rappresentata da una iperbole. InfaN essa è il risultato di pV = nRT (p = nRT/V). Se T è costante pV = cost • Il lavoro svolto dal gas durante una espansione isoterma è: Vf
Vf
Vi
Vi
w = ∫ pdV = ∫
Vf
w = nRT ∫
Vi
nRT
dV
V
per una mole
Vf
dV
Vf
= nRT [ln V ]Vi = nRT ln
V
Vi
Ricordiamo che il Lavoro, w, per una trasformazione isocora è nullo, per una trasformazione isobara è w = p (Vf – Vi) e per una isoterma è w = nRT ln(Vf/Vi). Processi adiabaKci § Se durante un processo Q = 0 il processo è adiaba?co ed il lavoro è w = pdV = -­‐dEint § Tale situazione si verifica, sia se il processo è rapidissimo, sia se avviene lentamente in un sistema ben isolato. U?lizzando l’equazione di stato dei gas ideali § La conclusione sarà γ = cost p
V
pV = nRT e risolvendo rispe9o alla pressione p dove γ è il rapporto cp/cv avremo: ⎛ nRT ⎞ γ
⎜
⎟V = cos t § Scorrendo l’adiaba?ca si a9raversano molte isoterme. ⎝ V ⎠
§ Il processo è completamente Se nR viene incluso nella costante avremo: γ = p V γ
descri9o d
a p
V
i
i
f f
TVγ -­‐1 = cost TiViγ -­‐1 = TfVfγ -­‐1 Dimostrazione di Vγ
l Supponiamo di eseguire una lenta espansione, quindi Q = 0. l Quindi il primo principio diventa dEint = -­‐ pdV e ricordando (dEint= ncvdT) avremo: ncvdT = -­‐ pdV ndT = -­‐ (pdV)/cv l differenziando l’equazione di stato dei gas perfe\ (pV = nRT): pdV + Vdp = nRdT l sosKtuendo R con cp – cv (vedi poi) e ndT con -­‐ (pdV)/cV : (
c
pdV + Vdp = −
p
− cV )
cV
pdV = −(γ − 1) pdV
dp ⎛ c p ⎞ dV
+ ⎜⎜ ⎟⎟
=0
p ⎝ cV ⎠ V
Ma il rapporto dei calori specifici è γ e integrando o9eniamo: ln p + γln V = cost ovvero ln pVγ = cost Relazione fra CV e Cp In una trasformazione a volume costante il primo principio porta a dire che
dQ = dU + pdV e dovendo essere dV = 0 ne segue che dQ = nCv dT o anche
nCv dT = dU
Per una trasformazione a pressione costante dovrà essere nCpdT = dU + pdV.
Essendo dU|v = dU|p risulterà nCv dT = nCp dT – p dV o meglio
n (Cp – Cv) dT = pdV
Per l’equazione di stato dei Gas Perfetti pV = nRT e pdV = nRdT quindi
n (Cp – Cv) dT = nRdT
Cp – C V = R
ovvero
Espansione libera L’espansione libera è un processo
adiabatico in cui il Lavoro è nullo.
C’è equilibrio solo allo stato iniziale
e allo stato finale dell’espansione.
Le temperature iniziale e finale
sono eguali Ti = Tf e per un gas
ideale anche pVi = pVf
Riassumendo: per un gas ideale
le trasformazioni più
interessanti sono riportate nel
grafico: