dU Q L U Q L
Primo Principio della Termodinamica
U nc v T dove cv è il calore specifico molare a volume
L’energia interna di un gas è
costante.
La variazione di energia interna per un gas mantenendone costante il volume è: U nc v T
Introducendo cp calore specifico molare a pressione costante (è sempre cp >cv)si ha la relazione fondamentale
c
c p c v R e posto k p risulta dalla relazione fondamentale c p k R e c v 1 R
cv
k 1
k 1
1
RT dove k assume i valori
L’Energia interna totale si esprime allora come U n
k 1
determinati con la teoria cinetica dei gas. Nella tabella i valori di k e dell’energia interna totale:
Valore di K
Energia Interna
Totale
Gas monoatomico
5/3=1,67
U
3
nRT
2
U
Equazione di stato dei gas perfetti
Dove P=Pressione
Valore
Unità di
misura
Gas biatomico
7/5=1,40
3
m atm
kgmole K
U 3nRT
5
nRT
2
PV=nRT
V=Volume T=Temperatura n= Numero di moli
0,0826
Gas poliatomico
4/3=1,33
R=Costante dei gas il cui valore è:
0,0826
8314
8,314
847,8
1,987
litri atm
mole K
Joule
kgmole K
Joule
mole K
kgf m
kgmole K
Kcal
kgmole K
(N.B. k=)
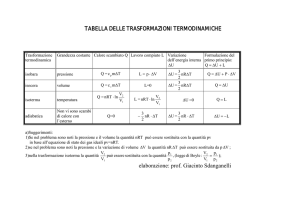
VALORI di Q ed L nelle trasformazioni termodinamiche
Trasformazione
Isobara
Lavoro
P costante
Isocora
V costante
Isoterma
Adiabatica
PV K costante
L PV2 V1
Q nC p T2 T1
L0
Q U nCV T2 T1
L nRT ln
T costante
Q Energia Termica
V2
V1
V2
V1
Q0
m 1
P1V1 P2 m
1
L
1 m P1
PV m costante
1
nR T2 T1
k 1
Q L nRT ln
k 1
P1V1 P2 k
1
P1V1 P2V2
L
1
k 1
k 1 P1
Politropica
k
nRT2 T1
k 1
Q nCV
k m
T2 T1
1 m
Calcolo rendimento termodinamico
Lavoro netto
Calore fornito
solo per la macchina di Carnot 1
T
Q ceduto
1 1 dove T1 T2
Q fornito
T2
Fattori utili di conversione
1 atm=101325 Pa
1 atm m3=101325 J 1 atm litro=101,325 J
Aggiornamento 2012
1 J=0.2388 cal
1 cal=4,1868 J