Lavoro termodinamico
si ha scambio di energia mediante lavoro termodinamico quando si ha un cambiamento
macroscopico della configurazione di un sistema meccanico
attenzione: in termodinamica e’ il sistema che compie lavoro sull’ambiente circostante
( segno positivo ) e/o l’ ambiente circostante sul sistema (segno negativo)
nel calcolo del lavoro termodinamico non si tiene conto del lavoro delle forze interne
intramolecolari che compongono il sistema o degli scambi di energia tra le varie parti del sistema
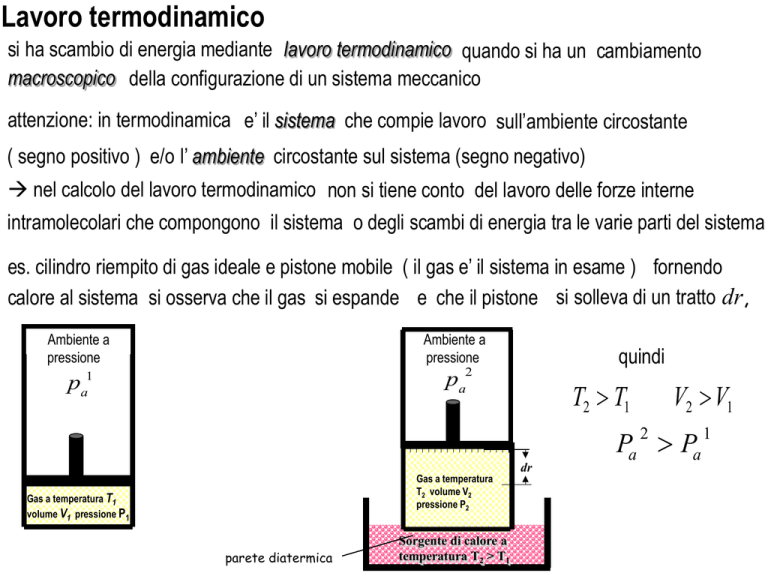
es. cilindro riempito di gas ideale e pistone mobile ( il gas e’ il sistema in esame ) fornendo
calore al sistema si osserva che il gas si espande e che il pistone si solleva di un tratto dr,
Ambiente a
pressione
Ambiente a
pressione
quindi
2
a
p
pa1
T2 > T1
V2 > V1
Pa > Pa
2
Gas a temperatura
T2 volume V2
pressione P2
Gas a temperatura T1
volume V1 pressione P1
parete diatermica
Sorgente di calore a
temperatura T2 > T1
dr
1
se ne deduce che il sistema sta facendo lavoro motore verso l’esterno mentre le forze esterne
compiono lavoro resistente
se si avesse attrito nullo e si supponesse che il peso del pistone fosse trascurabile
la sola forza agente sarebbe quella dovuta alla pressione esterna
pa
e per uno spostamento infinitesimo dr il lavoro infinitesimo dL sarebbe esprimibile come
Fdr = paSdr = pa dV e per una trasformazione finita dal volume del gas Va al volume Vb
il lavoro effettuato dal sistema sull’ambiente risulterebbe
VB
L = ∫ pa dV
VA
ma l’ integrale puo’ essere calcolato solo se durante tutta la trasformazione si conosce
ad ogni istante il valore della pressione esterna pa
e cio’ avviene soltanto in casi particolari :
se la pressione esterna non varia durante la trasformazione
nella espansione libera del gas nel vuoto pressione esterna nulla
durante una trasformazione reversibile
dove
p
e’ la pressione del gas
pa = p
pa = costante
pa = 0
ad ogni istante di tempo
se la trasformazione e’ reversibile, o anche se fosse “quasi statica” si puo’ determinare il lavoro
in funzione delle sole coordinate termodinamiche del sistema stesso
( pressione, volume e temperatura del gas ) sempre se e’ noto come varia la pressione
del sistema al variare del volume
in conclusione:
se le variabili di stato subiscono modifiche infinitesime
inoltre se le trasformazioni sono reversibili
dU = d Q − d L
dL = pdV
e in questo caso il primo principio della termodinamica diviene
VB
L = ∫ p dV
VA
dU = d Q − pdV
nel piano di Clapeyron il lavoro durante una trasformazione reversibile e’ dato
dall’area sottesa dalla curva che descrive la trasformazione termodinamica
P
P
L>0
V1
V2
V
L<0
V1
V2
V
lavoro ( termodinamico ) di un gas perfetto in trasformazioni reversibili
a pressione costante :
L
VB
p dV
∫=
VA
p∫
VB
VA
dV = p(VB - VA )
a volume costante :
L=∫=
p dV
VA
VA
VA
pdV
∫=
VA
0
a temperatura costante :
L=
∫
VB
VA
p dV =
VB
= nRT ln
VA
∫
VB
VA
VB dV
nRT
dV = nRT ∫
VA V
V












