La costante (p0V0/273) la si riesprime come = n R
dove R è una costante universale il cui valore dipende
solo dalle unità di misura usate:
R=8.31 Joule/(K mole)
e n è il numero di moli
L’equazione di stato dei gas perfetti diventa quindi:
PV=nRT
Gas reali
pV = nRT
Equazione di stato dei gas perfetti
a ⎞
⎛
⎜ p + 2 ⎟ (V − b ) = nRT
V ⎠
⎝
a e b dipendono dal gas
Equazione di van
der Waals
Scambio di calore Q
Un sistema non isolato può interagire con l’ambiente circostante sia
attraverso lo scambio di energia sia meccanica che termica
Il CALORE è l’ENERGIA scambiata fra sistema e ambiente a
causa della loro diversa temperatura. Il calore è trasferito al
sistema quando la sua temperatura TS è minore di quella
dell’ambiente Ta: per convenzione si assume che in questo caso il
CALORE Q sia POSITIVO. In questo processo l’energia interna al
sistema aumenta. Per TS > Ta si ha Q<0
Il calore è una forma di energia: la sua unità di misura nel SI è il
Joule. Un’altra unità di misura è la CALORIA
1 cal=4,186 J
1 Cal=1 Kcal=1000 cal=4186 J
1 cal = quantità di calore necessaria per innalzare la
temperatura di 1 gr di acqua da 14,5 a 15,5 °C
Il calore NON è una proprietà intrinseca del sistema
EQUILIBRIO E TRASFORMAZIONI
EQUILIBRIO
TRASFORMAZIONI
Meccanico
Risultante delle forze nulla
Termodinamico Stessa temperatura
Non reazioni in corso
Chimico
Adiabatiche
Quasi-statiche
Cicliche
Reversibili
Fra stati di equilibrio
CAPACITA’ TERMICA E CALORE SPECIFICO
Lo stato di un sistema può essere variato attraverso lo scambio di
energia con l’ambiente. In particolare può variare la temperatura
del sistema. Quando la temperatura di un corpo viene modificata
in seguito allo SCAMBIO DI CALORE, la VARIAZIONE DI
TEMPERATURA ΔT prodotta da una certa quantità Q di calore
scambiata dipende dalle proprietà del corpo. Se in particolare lo
scambio di calore avviene mantenendo il volume (o la pressione)
del gas INVARIATO, il rapporto fra calore scambiato e variazione
di temperatura definisce una grandezza C*, detta CAPACITA’
TERMICA A VOLUME (o PRESSIONE) COSTANTE del corpo:
Q
C =
ΔT
*
Si parla anche di CAPACITA’ TERMICA MOLARE A VOLUME
(PRESSIONE) COSTANTE (n = numero di moli):
Q
C=
nΔT
La capacità termica per unità di massa è detta CALORE SPECIFICO A
VOLUME (PRESSIONE) COSTANTE ed è CARATTERISTICA del
MATERIALE di cui è composto il corpo.
Tale grandezza in generale DIPENDE dalla TEMPERATURA, ma alle
temperature comuni i calori specifici possono essere considerati costanti.
C*
Q
=
c=
m mΔT
Per determinare il calore che deve essere fornito ad un corpo di massa
m e calore specifico c(T), per modificarne la temperatura dal valore TA
al valore TB si calcola:
N incrementi finiti
ΔT, cn costante e noto
in ogni intervallo
N
Q = ∑ mcn ΔTn
n =1
al limite per ΔTJ0
Nota la
dipendenza
di c da T
TB
Q = m ∫ c dT
TA
Es: valori del calore specifico a pressione costante per
rame: cCu=387 J/kg K, vetro: cvetro=840 J/kg K; acqua: cH O=4190 J/kg K
2
N.B. Gli intervalli di temperatura espressi in °C e K sono uguali
CALORI LATENTI
Quanto detto finora è corretto se lo scambio di calore fra corpo e ambiente
NON determina una TRANSIZIONE DI FASE cioè un passaggio da uno
stato (solido, liquido, gassoso) ad un altro. Se al contrario questo avviene
parte del calore scambiato è impiegato nella transizione di fase e NON
CONTRIBUISCE alla variazione della temperatura del corpo
La quantità di calore per unità di massa trasferita durante il passaggio
di stato è definito CALORE LATENTE (L)
Q = Lm
Q = calore scambiato per la sola transizione di fase
m = massa del corpo che cambia fase
Ad esempio per l’ acqua:
Tfusione=273 K; Lfusione=333 kJ/kg
Tevaporazione=373 K; Levaporazione=2256 kJ/kg
LAVORO TERMODINAMICO
Lo scambio di energia fra sistema e ambiente può avvenire mediante
scambio di calore, ma anche mediante l’esecuzione di LAVORO sia
dal sistema sull’ambiente (LAVORO POSITIVO), sia dall’ambiente
sul sistema (LAVORO NEGATIVO)
Il lavoro termodinamico è un LAVORO ESTERNO: non include gli scambi
di energia fra le varie parti del sistema (es: dovuti a forze intermolecolari)
In genere scambi di energia mediante lavoro termodinamico determinano
nell’ambiente variazioni macroscopiche nella configurazione di un sistema
meccanico, ad es. l’innalzamento del coperchio di un recipiente cilindrico in
cui è posto un gas. Qual’ è il lavoro compiuto dal gas?
JJG G
dL = F ⋅ d r = p Adh = p dV
L è il lavoro compiuto dal gas
Il lavoro compiuto dal sistema nello spostare un pistone, che determina una
variazione del volume del gas dal valore iniziale VA al valore finale VB si ottiene
dal calcolo dell’integrale:
LAB =
VB
∫ p dV
e
VA
il calcolo può essere effettuato se durante
tutta la trasformazione sono noti i valori
della pressione esterna e del volume del gas
• pe sostanzialmente non varia
LAB =
VB
VB
∫ p dV = p ∫ dV = p (V
e
e
VA
• pe ≈ 0 (espansione libera in vuoto)
• trasformazione quasi-statica
pe≈ p
e
B
− VA )
VA
LAB = 0
LAB =
VB
VB
∫ p dV = ∫ pdV
e
VA
VA
Il lavoro è espresso in termini delle coordinate macroscopiche del sistema
Un aumento del volume del sistema corrisponde ad un lavoro POSITIVO
Una riduzione del volume del sistema corrisponde ad un lavoro NEGATIVO
Quando stato iniziale e finale del sistema coincidono (CICLO TERMODINAMICO)
il lavoro è espresso dall’area della curva chiusa che rappresenta il ciclo nel
piano di Clapeyron: il lavoro è POSITIVO o NEGATIVO a seconda che il ciclo sia
compiuto in senso orario (ciclo TERMICO) o antiorario (ciclo FRIGOROFERO)
Lavoro in un ciclo: ≠ 0
Il lavoro esterno elementare NON
è un differenziale esatto (δL)
IL LAVORO TERMODINAMICO NON E’ UNA FUNZIONE DI STATO
Come il calore il lavoro NON è una proprietà intrinseca del sistema
LAVORO dei GAS IDEALI
Si può calcolare il lavoro eseguito da un GAS PERFETTO in
trasformazioni quasi-statiche reversibili
pressione costante
B
B
A
A
LAB = ∫ pdV = p A ∫ dV = p A (VB − VA )
volume costante
B
LAB = ∫ pdV = 0
A
temperatura costante
B
LAB
B
B
nRT
1
= ∫ pdV = ∫
dV = nRT ∫ dV =
V
V
A
A
A
VB
pA
= nRT ln
= nRT ln
VA
pB
processo adiabatico
B
B
A
A
LAB = ∫ pdV = ∫
p AVAγ
1
γ
dV = p AVA ∫ γ dV =
γ
V
V
A
B
p AVAγ 1−γ
=
(VB − VA1−γ )
1− γ
γ=
Cp
Cv
gas monoatomico: γ=5/3
gas biatomico:
γ=7/5
I PRINCIPIO DELLA TERMODINAMICA
Il calore fornito AL sistema
(Q>0) aumenta l’energia
interna del sistema
Il lavoro compiuto DAL sistema
(L>0) riduce l’energia interna
del sistema
Si può portare il sistema da uno stato iniziale A (di equilibrio) ad uno
stato finale B (di equilibrio) eseguendo trasformazioni diverse: il calore
scambiato ed il lavoro esterno sono diversi nelle diverse trasformazioni.
Si trova che in queste trasformazioni si MANTIENE COSTANTE la
quantità Q-L, uguale alla ENERGIA INTERNA del sistema. L’energia
interna dipende solo dallo stato iniziale e finale del sistema, perciò è
una VARIABILE DI STATO
ΔU = Q − L
I PRINCIPIO DELLA
TERMODINAMICA
FORMULAZIONE PIÙ GENERALE DEL PRINCIPIO DI
CONSERVAZIONE DELL’ENERGIA
per variazioni infinitesime:
dU = δ Q − δ L
Calore e lavoro esterno non sono variabili
di stato (non sono differenziali esatti)
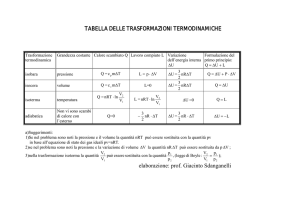
Processi isotermi
La temperatura rimane costante perciò anche l’energia interna
Q−L=0⇒Q = L
Processi isocori
Il volume rimane costante perciò il lavoro esterno è nullo
ΔEint = Q = nCV ΔT
L=0
Processi isobari
La pressione rimane costante
Q = nC p ΔT
L = pΔV
Processi ciclici
Lo stato iniziale e finale coincidono
Q−L=0
Espansione libera
Il sistema è isolato e nel processo non viene compiuto lavoro
Q=0
L=0
ΔEint = 0
Poiché l’energia interna del
gas nel processo non cambia
la temperatura del gas
rimane costante
Non si tratta di un processo
quasi statico (trasformazione
IRREVERSIBILE): solo gli stati
iniziale e finale possono essere
rappresentati nel piano p-V