Classi di composti organici
Prof. Paolo Abis
Lic. Classico “D. A. Azuni”
SASSARI
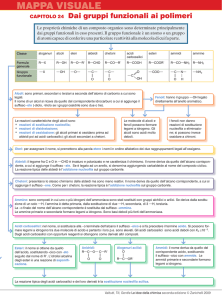
Gruppi funzionali
Diversi composti organici contengono, oltre a
carbonio ed idrogeno, altri elementi come : Ossigeno,
Azoto, Zolfo e Alogeni
Dal punto di vista della classificazione possono
essere considerati derivati dai corrispondenti
idrocarburi per sostituzione di uno o più atomi di
idrogeno con particolari gruppi :
Gruppi funzionali
Gruppi funzionali
R - OH
alcoli
R - C = O aldeidi
H
R - C - R’ chetoni
ll
O
R – O – R’
eteri
R - C - O - R’ esteri
ll
O
R - N - R” ammine
l
R’
R - C - OH acidi
R - C - NH2 ammidi
ll
carbossilici
ll
O
O
I principali composti organici
I principali composti organici
L’importanza dei gruppi funzionali
Nella maggior parte delle reazioni organiche
le trasformazioni chimiche avvengono a
livello del gruppo funzionale
Il gruppo funzionale conferisce le proprietà
chimiche
I composti che hanno lo stesso gruppo
funzionale danno le stesse reazioni chimiche.
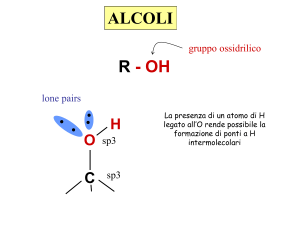
Alcoli
Gli
alcoli possono essere considerati
derivati dagli alcani per sostituzione di
un idrogeno con un gruppo ossidrilico :
In base al n. di atomi di carbonio legati al C. che
porta il gruppo ossidrilico gli Alcoli si suddividono
in
primari
secondari
terziari
OH
OH
H3C—CH2 —OH
|
|
H3C—C —CH3
H3C—CH —CH3
|
CH3
etanolo
2-propanolo
ter-butanolo
2-metil-2-propanolo
Il nome convenzionale degli alcoli alifatici si
costruisce aggiungendo la desinenza -olo al nome
dell’idrocarburo.
H H
H
H C OH
H
metanolo
alcoli primari
H C C OH
H H
etanolo
alcole etilico
alcole metilico
H H H
H C C C OH
H H H
1-propanolo
alcole n-propilico
H H H
CH3
H C C C H
CH2
H O H
H
alcol
secondario
2-propanolo
alcole isopropilico
alcol
terziario
H3C C CH3
OH
2-metil-2-butanolo
alcole isobutilico terziario
Alcoli
Formula
peb (°C)
metanolo
CH3OH
64,5
etanolo
CH3CH2OH
78,3
n-propanolo CH3(CH2)2OH
97
n-butanolo
CH3(CH2)3OH
118
n-pentanolo CH3(CH2)4OH
138
n-esanolo
156
CH3(CH2)5OH
Caratteristiche deducibili dalla struttura
L’immagine mostra il potenziale elettrostatico del
metanolo. Più rossa è un area, maggiore è la
densità elettronica; più blu è un area, minore è la
densità elettronica.
dO
H
d+
•L’atomo di ossigeno mostra una regione ad
alta densità elettronica (rosso) dovuta alla
presenza di due doppietti elettronici solitari.
•Il gruppo OH è un gruppo polare
•Può formare legami idrogeno, pertanto gli
alcoli a corta catena carboniosa sono solubili
in acqua.
•Se aumenta il numero di atomi di carbonio
prevalgono le caratteristiche idrofobiche
della catena idrocarburica e la solubilità
diminuisce.
•Gli alcoli a basso peso molecolare sono liquidi
•Quelli a lunga catena sono solidi
Caratteristiche Chimiche
d-
•L’atomo di ossigeno mostra una regione
ad alta densità elettronica (rosso)
dovuta alla presenza di due doppietti
elettronici solitari.
O
H
d+
lone pairs
H
O
sp3
• Gli atomi di ossigeno alcolici sono basi di
Lewis.
• Quindi gli alcoli possono comportarsi come
basi deboli.
•La loro forza come base è paragonabile a
quella dell’acqua.
• L’atomo di idrogeno della funzione alcolica
mostra una bassa densità elettronica (blu),
quindi ha carattere acido.
•Quindi gli alcoli sono acidi deboli (più deboli
dell’acqua)
C
sp3
Utilizzo degli alcoli
Gli alcoli sono molto più reattivi degli alcani
perché la presenza dell’ossigeno provoca la
polarizzazione dei legami.
Sono molto usati come solventi di sostanze
ioniche e soluti molecolari (es. tintura di Iodio)
Sono utilizzati come materiali di partenza per
la preparazione di altri composti organici
come aldeidi, chetoni e acidi.
Gli alcoli più importanti
Metanolo
o alcool metilico è un liquido volatile (p.d.e. 64.5 °C),
ha formula CH3OH, non è ionizzato ed è sia lipofilo che idrofilo.
Possiede un proprio odore caratteristico, brucia con fiamma azzurra
non lucente. Dato che il metanolo si può ottenere dalla distillazione
secca del legno (Boyle, 1661) è anche detto alcool di legno.
E' usato come additivo per carburanti, o esso stesso è usato come
carburante solido (Pile a combustibile alimentate a metanolo),
nell'industria chimica è usato come solvente per coloranti, collanti,
poliesteri, svernicianti... e in chimica organica è un importante agente
metilante.
Altamente tossico, anche se ingerito in piccole quantità può provocare
cecità e morte.
Gli alcoli più importanti
Etanolo
è un alcol a corta catena, noto anche come alcol etilico
o spirito di vino, la sua formula chimica è CH3CH2OH.
A temperatura ambiente si presenta come un liquido incolore dall'odore
caratteristico. È tendenzialmente volatile ed estremamente
infiammabile.
Si prepara industrialmente per sintesi dall’acetilene
Prodotto in natura dalla fermentazione degli zuccheri, è l'alcol più
diffuso e l'unico adatto al consumo alimentare.
L'etanolo è tossico. Un suo abuso produce effetti dannosi per il
metabolismo, specialmente a carico del fegato.
In molti paesi del mondo, sopratutto in quelli economicamente più
svantaggiati, viene usato come combustibile al posto della comune
benzina,dato il suo costo molto contenuto.
Per le sue proprietà antisettiche è anche usato come disinfettante.
Etanolo - Alcol Etilico
preparazione : fermentazione degli zuccheri
C6H12O6
glucosio
2 C2H5OH + 2 CO2
etanolo
contenuto di etanolo:
birra circa 4 %
vini
circa 12%
gin, whisky, brandy dal 40 al 50 %
Polialcoli
Si chiamano polialcoli i composti con più
gruppi alchilici.
Il più importante è il glicerolo (glicerina)
è un triolo, un composto organico nella cui
struttura sono presenti tre gruppi -OH.
Componente dei grassi e degli oli
Si trova nei fosfolipidi
Viene utilizzato nelle creme per la pelle
Aldeidi e chetoni
O
R C
O
R C
H
aldeide
R
chetone
Le Aldeidi
Le aldeidi sono caratterizzate dal gruppo funzionale
carbonile C=O . Il legame C=O è composto da un
legame di tipo σ e da uno di tipo π ;
Nelle aldeidi un gruppo carbonilico è legato a uno o a
due atomi di idrogeno e a non più di un radicale
alchilico, secondo la formula generale :
In cui l’atomo di carbonio è legato ad almeno un
atomo di idrogeno
p
s
R
H
xy
R
H
C
O
Le Aldeidi
Il loro nome deriva da "alcol deidrogenato",
che è una delle possibili modalità di
preparazione. (In natura vengono prodotte nei processi di
fermentazione degli zuccheri.)
La nomenclatura IUPAC assegna alle aldeidi
il suffisso -ale
Metanale
(formaldeide)
Etanale
(acetaldeide)
La formaldeide
Utilizzo
La formaldeide è un potente battericida; le soluzioni acquose
di formaldeide trovano largo impiego come disinfettanti
(Lysoform e simili).
Nella formalina vengono anche conservati campioni di
materiale biologico. Trova del resto vasto impiego anche
nelle tecniche di imbalsamazione.
La maggior parte della formaldeide prodotta è destinata però
alla produzione di polimeri e di altri composti chimici.
Per reazione con il fenolo polimerizza dando la bachelite,
una resina termo-indurente.
Effetti sulla salute
L'ingestione o l'esposizione a quantità consistenti sono
potenzialmente letali.
La cancerogenicità è stata accertata sui roditori.
Acetaldeide
L'acetaldeide, nota anche come aldeide acetica o etil aldeide
o etanale,
Ha formula chimica CH 3CHO,
è un liquido con odore pungente e fruttato, incolore, volatile ed
estremamente infiammabile.
Viene utilizzata per la produzione di farmaci, materie plastiche,
altri importanti composti chimici come l'acido acetico (o acido
etanoico), l'alcol butilico (o butanolo).
Nell'uomo è un metabolita degli zuccheri e dell'etanolo, ma la
sua presenza è stata evidenziata anche in estratti di piante,
fumo da tabacco, motori esausti, nell'aria (sia in ambienti aperti
che chiusi), e nell'acqua.
l'UE classifica questa sostanza come sospetta per i possibili
effetti cancerogeni sull'uomo
I Chetoni
I chetoni contengono l gruppo carbonile C=O come
le aldeidi.
Nei chetoni il carbonio del gruppo carbonilico è legato
a due radicali alchilici, secondo la formula generale :
Ciò significa che il gruppo carbonile non si trova mai
al termine della catena carboniosa.
p
s
R2
R1
xy
R2
R1
C
O
I Chetoni
La nomenclatura IUPAC assegna il suffisso -one.
Spesso i chetoni sono chiamati con i loro nomi
convenzionali.
O
H3C C
CH2CH3
O
butanone
O
H3C C
CH3
H3C C
CH2CH2CH3
Propanone (acetone).
2-pentanone
I Chetoni
i chetoni, largamente diffusi in natura, hanno profumi piacevoli,
e per questo motivo vengono spesso usati nell'industria
cosmetica e nella produzione di sapori artificiali.
L’acetone è il composto più semplice appartenente alla classe
dei chetoni. Nell’organismo l’acetone si forma come
sottoprodotto del metabolismo dei grassi.
Altri chetoni sono la canfora, molti steroidi, alcuni aromi e
alcuni zuccheri. I chetoni sono relativamente reattivi, e sono
quindi utili per la sintesi di altri composti.
Acetone
Acetone Liquido incolore infiammabile di formula CH3COCH3,
caratterizzato da odore pungente;
E’ un ottimo solvente, utilizzabile su piccola e larga scala.
Grandi quantità di acetone sono usate come solvente per
l'acetato di cellulosa durante la produzione del rayon e come
additivo gelatinizzante nella preparazione di esplosivi.
Viene impiegato nei solventi per vernici, per paste adesive e per
alcuni detergenti, ed è inoltre in grado di sciogliere gomme e
resine.