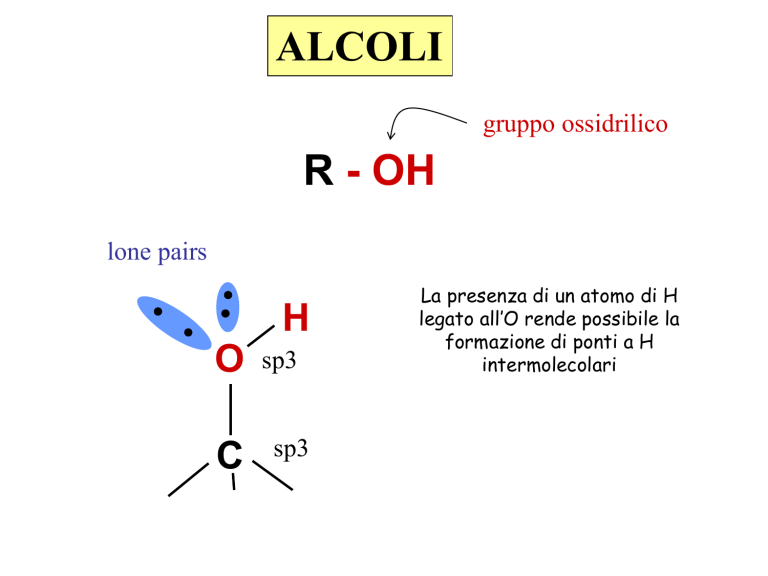
ALCOLI
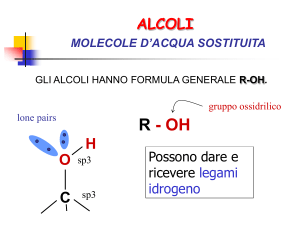
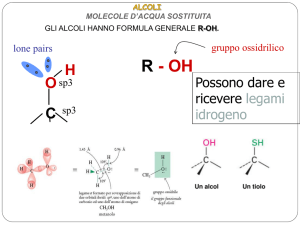
gruppo ossidrilico
R - OH
lone pairs
H
O
C
sp3
sp3
La presenza di un atomo di H
legato all’O rende possibile la
formazione di ponti a H
intermolecolari
Il nome convenzionale degli alcoli alifatici si costruisce
aggiungendo la desinenza -olo al nome dell’idrocarburo..
Il nome dell’idrocarburo si compone, a sua volta, identificando
la catena lineare più lunga e numerando i carboni in modo
che nel nome compaiano i numeri più piccoli possibile.
primario
H3C—CH2 —OH
etanolo
secondario
terziario
OH
|
H3C—CH —CH3
OH
|
H3C—C —CH3
|
CH3
2-propanolo
ter-butanolo
2-metil-2-propanolo
Caratteristiche deducibili
dalla struttura
dO
H
d+
L’immagine mostra il potenziale elettrostatico del
metanolo. Più rossa è un area, maggiore è la
densità elettronica; più blu è un area, minore è la
densità elettronica.
•L’atomo di ossigeno mostra una regione ad
alta densità elettronica (rosso) dovuta alla
presenza di due doppietti elettronici solitari.
•Gli atomi di ossigeno alcolisi sono basi di
Lewis.
•Quindi gli alcoli possono comportarsi sia
come basi che come nucleofili.
•L’atomo di idrogeno della funzione alcolica
mostra una bassa densità elettronica (blu),
quindi ha carattere acido.
•Quindi gli alcoli sono acidi (pKa ~ 16).
•La dissociazione di un protone genera un
alcossido.
•Il gruppo –OH è un cattivo gruppo uscente e
deve essere convertito in un buon gruppo
uscente perché si possa avere una reazione di
sostituzione o di eliminazione.
Gli alcoli sono acidi molto deboli.
In assenza di gruppi elettron-attrattori (che ne
aumentano l’acidità) e di gruppi elettron-repulsori
(che ne diminuiscono l’acidità) i valori di Ka sono
intorno a 1·10-15.
H
C H
H
O H
H
H
O
H
pKa 15.5
C H
H
O
H
H O
H
F
F
C
F
F
C H
H
O H
F
F
C H
H
O
H
O
H
C
H
H O
pKa 12.5
La presenza dei tre atomi di fluoro stabilizza
l’anione trifluoroetanoato. Di conseguenza,
il trifluoroetanolo è un acido meno debole
dell’etanolo.
H
L’anione fenato è stabilizzato
dalla risonanza fra più forme
limite. Ciò comporta la
conseguenza che i fenoli
sono acidi più forti degli alcoli.
O
H
H
O H
O
H
H O
pKa 10.0
O
O
H
H
H
C
H
H
H
O
O
Na
H
H
C
H
H
O
O
H
Na
Gli alcoli non reagiscono con gli idrossidi dei metalli
alcalini (l’equilibrio è completamente spostato a sinistra),
mentre i fenoli si convertono quantitativamente in fenati
H
H
O
Na
O
H
O
O
H
Na
2 CH3OH
2 Na
2
2 Na
2 CH3O Na
2
H2
H2
O
O
H
Na
Sia gli alcoli che i fenoli reagiscono con i metalli
alcalini dando, rispettivamente alcolati e fenati.
Nota però che queste reazioni non sono reazioni
acido-base ma reazioni redox.
Reazioni di sintesi degli alcoli
Idratazione di alcheni in ambiente acido
Sostituzione nucleofila
Reazioni di sostituzione di un alogenuro
REAZIONI DEGLI ALCOLI
Reazione di un alcol primario con acido alogenidrico
ClR
R
R
+
Cl
+
R
+
Cl
R
H C H
H+
Cl
R
H C H
O
O
H
H
H
Cl-
R
H C H
O
H
H
H2O
Cl
H C R
H
Reazione di un alcol terziario con acido alogenidrico
R
R
R
ClH+
R C Cl
R C
R C OH
H2O
R
R
R
R1
La sostituzione nucleofila è SN1
+
R3 R2
+
R1
R3
R2
R1
+
R3
+ Cl-
R2
R1
R1
+
Cl
R2 R3
R3
R2
Cl
L’alcol
terziario viene protonato dall’acido. L’alcol
terziario
protonato perde una molecola di acqua formando un carbocatione
terziario che può essere attaccato dallo ione cloruro da un lato del
piano di ibridazione oppure dall’altro lato
Alcuni gruppi funzionali attivi come
nucleofili all’interno delle cellule
nucleofilo
Quanto più debole è un
nucleofilo tanto meglio
si comporterà come
gruppo uscente
Forza del nucleofilo
gruppo
uscente
funzione alcolica
funzione fosforilica
estere fosforico
:Nu
R — Nu
E’ l’elevata energia di risonanza che rende stabile l’anione fosfato
rendendolo un buon gruppo uscente
Reazioni di ossido-riduzione
carbonile
(aldeide o chetone)
alcol
carbossile
Numero di ossidazione del C crescente
N.B.
alcol 1° aldeide carbossile
alcol 2° chetone X
alcol 3° X
La variazione di colore dello ione dicromato nella reazione di
ossidazione degli alcoli (e delle aldeidi) viene sfruttata
nell’esame estemporaneo del tasso di etanolo nell’alito (test
del palloncino)
OH
H C H
Ione dicromato
(rosso-arancio)
Cr2O7-- (H+)
O
C
H
H C H
Cr+++
H C H
H
Ione cromo
(verde)
H
etanolo
Alcol etilico
2-propanolo
etanale
Aldeide acetica
propanone
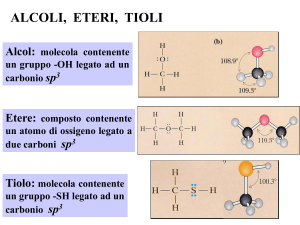
TIOLI
gruppo sulfidrilico
R - SH
lone pairs
H
S
C
sp3
sp3
Reazione redox
Tioli liberi
Ossidazione
- 2H
Riduzione
+ 2H
Ponte disolfuro
LA PERMANENTE E’ UN OPERAZIONE DI INGEGNERIA BIOCHIMICA
ETERI
gruppo etere
R–O–R
lone pairs
C
sp3 O
C
sp3
sp3
Gli eteri sono molecole si comportano
da solventi polari aprotici (mancano
atomi di idrogeno disponibili a formare
ponti ad H)
Per condensazione in
ambiente acido
(ad es. H2SO4)
di due molecole di
etanolo
si ottiene un etere
H OHH
CH3
C
H OHH
2
H2O
C
C
H OHH
2
H+
1a fase: Protonazione dell’alcol
2a fase: Sostituzione
nucleofila
C
CH3
H OHH
(La reazione decorre con
meccanismo SN2)
CH3
CH3
CH3
CH3
C
H OHH
H
C
H
CH3
H+
C
H OH
H
C
H
CH3
dietiletere
(o etere etilico)
Gli eteri devono essere considerati basi di Lewis: in ambien
te acquoso acido sono facilmente protonati ed idrolizzati
H
H
R
C
RH
C
H+
H
protonazione
H O
C H
H
R
O
C H
H
R
H
H
R
C
H
H
R
C
H O
C H
H
R
O
H2O
H
H
+
H O
C H
H
R
H+
RH
C
H
O
H
idrolisi
EPOSSIDI (ETERI)
O
gruppo epossido
R — R
lone pairs
sp3
O
Csp3
C
sp3
Forte tensione di legame
Alta reattività
Reazione tipica degli epossidi:
Sostituzione nucleofila
Meccanismo di reazione in ambiente acido
Nu-H = H2O, R-OH, R-NH2