Chimica organica e laboratorio
Alcoli, aldeidi e
chetoni
Classi terze
Docente: Luciano Canu
Anno Scolastico 2002/2003
Prerequisi
ti
Nomenclatura degli alcani, alcheni, alchini,
idrocarburi aromatici
Isomeria di posizione
Sostituzioni elettrofile aromatiche
Sostituzioni nucleofile
Concetto di acidità e basicità
Concetto di risonanza
Concetto di effetto induttivo e mesomero
2
Obiettivi
Nomenclatura di alcoli e fenoli
Struttura e caratteristiche generali
Acidità di alcoli e fenoli
Preparazione di alcoli e fenoli
Addizione di acqua
Riduzione di aldeidi e chetoni
Preparazione industriale del fenolo
Reazioni degli alcoli e dei fenoli
Eliminazione
Ossidazione del fenolo
3
Obiettivi
operativi*
4
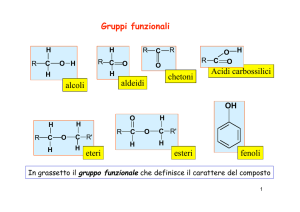
O
R
La struttura
H
H
O
H
O
H
R
O
R
H
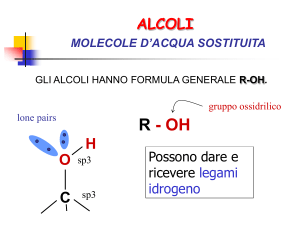
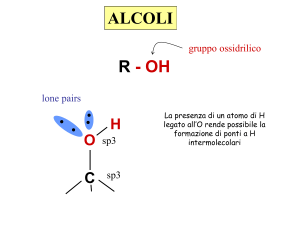
Un alcol può essere considerato come un
idrocarburo (alifatico o aromatico) a cui è stato
sostituito un gruppo OH (ossidrile)
Il nome deriva dalla catena idrocarburica con suffisso
finale -olo
Viceversa si può pensare che derivi da una
molecola d’acqua in cui un atomo d’idrogeno è
sostituito da una catena idrocarburica
Le molecole più piccole sono perfettamente solubili in
acqua poiché formano legami idrogeno
O
O
H
H
acqua
R
O
H
alcol
Ar
H
alcol aromatico
5
CH3OH
Generalità
Negli alcoli il gruppo OH (ossidrile) deve
essere legato ad un atomo di carbonio
ibridato sp3
Nei fenoli il gruppo OH è legato ad un atomo
di carbonio ibridato sp2 facente parte di un
anello aromatico
Hanno caratteristiche chimiche piuttosto differenti
dagli alcoli alifatici
La catena idrocarburica di un alcol può
essere satura o insatura, ramificata o lineare
H
H2
CH3
C
O sp3 C
H2
C
OH
sp2
6
Nomenclatur
a
Le regole IUPAC per l’assegnazione del
CH3
H
O
metano
metanolo
nome agli alcoli sono
Scegliere la catena più lunga di atomi di carbonio
che portano la funzione alcolica (OH)
Numerare la catena in modo da assegnare il
numero più basso alla funzione ossidrilica
Cambiare la o finale dell’alcano nel suffisso olo
Il gruppo OH è una funzione seniore rispetto alle
insaturazioni e agli alogeni
I fenoli sono denominati come dei derivati
dell’idrossibenzene
idrossibenzene
OH
fenolo
7
Esempi
Tra parentesi il nome d’uso
H 3C
H2 H2
C C O
propanolo
(alcol propilico)
OH
H 3C
H
H
C
CH3
H3C
OH
H 3C
CH3
2-metil-2-propanolo
(alcol ter-butilico)
OH
C
CH3
OH
cicloesanolo
C
OH
2-propanolo
(alcol isopropilico)
H2 H
C C
CH3
2-penten-2-olo
H2C CH
OH
H
C
CH3
OH
butan-1,2,3-triolo
8
OH
Esempi
HO
I fenoli prendono il nome dal
composto base:
idrossibenzene
Br
OH
1,2,3-triidrossibenzene
(pirogallolo)
3-bromoidrossibenzene
(m-bromofenolo)
OH
NO2
O2 N
OH
OH
NO2
2,4,6-trinitroidrossibenzene
(acido picrico)
CH3
OH
2-metilidrossibenzene
(o-cresolo)
9
H 3C
Preparazione
CH3
CH
cumene
Gli alcoli si possono preparare partendo
da molte sostanze organiche
Alcheni per addizione
Alogeno derivati per sostituzione nucleofila
Aldeidi e chetoni per riduzione
I fenoli sono composti molto importanti,
molti si ottengono a partire dal fenolo
Questo si prepara industrialmente dal
cumene
Altri fenoli si ottengono dai sali di diazonio
10
Addizione
Gli alcoli secondari e terziari si possono preparare
partendo dagli alcheni in presenza di catalizzatore
acido che attiva l’addizione di acqua
H
C
H2C
CH3
+
H2SO4
H2O
H2C
H
H
C
H2C
CH3
H 2C
H
C
H
C
CH3
OH
H2C
H
C
CH3
CH3
H
H+
H
O
H
C
H2C
CH3
H2C
O
H
H
H
H
H
C
O
H
CH3
H
H
H+
11
Aspetti importanti
H32C
C
H
H
C
CH3
Le reazioni di addizione sono reversibili
L’inverso di una reazione di addizione è
denominato eliminazione
Per esempio da un alcol per eliminazione si
ottiene un alchene
Anche le eliminazioni sono catalizzate da un
acido
Si ottengono solo alcoli secondari e terziari
perché i carbocationi che si formano sono
solo secondari o terziari
12
Riduzione
Gli alcoli primari e secondari si possono
ottenere per riduzione di aldeidi e chetoni
Si utilizza H2 gassoso in presenza di
catalizzatori (Pt, Pd, Ni)
Si può utilizzare anche l’idruro di boro e
sodio (NaBH4)
H
aldeide
H3C
C
O
CH3
chetone
H3C
C
H
H
H3C
OH
alcol 1°
CH3
H
O
CH
H3C
CH
OH alcol 2°
13
Fine
Alcheni e alchini
I carbocationi
Un carbocatione è una specie chimica
organica in cui una carica positiva si
trova su un atomo di carbonio
La struttura del carbocatione è questa:
Atomo di
carbonio
ibridato sp2
+
R C
R
Orbitale
p vuoto
R
15