Chimica organica
V Lezione
1
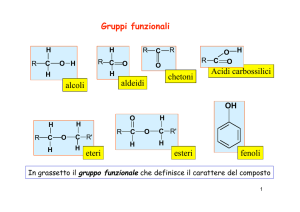
Gruppi funzionali
Un gruppo funzionale è un atomo o un gruppo di atomi che
determina le proprietà chimiche di un composto organico,
permettendone la classificazione.
1
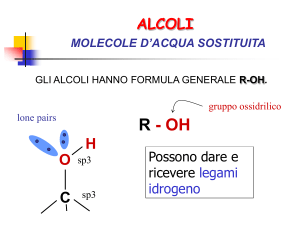
Alcoli
Gli alcoli derivano dagli idrocarburi per sostituzione di
un idrogeno con un gruppo ossidrile (—OH) che ne
diventa il gruppo funzionale.
La formula generale degli alcoli è R—OH.
Viceversa si può pensare che derivi da una molecola
d’acqua in cui un atomo d’idrogeno è sostituito da una
catena idrocarburica
H—OH
R—OH
1
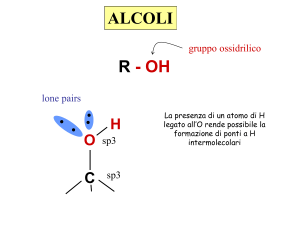
Alcoli
Gli alcoli sono composti che contengono un ossidrile,
–OH, legato ad un carbonio ibridato sp3.
1
Alcoli
1
Alcoli
Le molecole più piccole sono perfettamente solubili in acqua
poiché formano legami idrogeno.
O
H
O
H
acqua
R
O
H
alcol
Ar
H
alcol aromatico
Secondo la nomenclatura IUPAC, il nome dell’alcol deriva da
quello dell’idrocarburo corrispondente a cui si aggiunge la
desinenza -olo.
Atomi di
carbonio
nome
1
metanolo
2
etanolo
3
propanolo
4
butanolo
5
pentanolo
1
CH3OH
CH3CH2OH
CH3CH2CH2OH
CH3CH2CH2CH2OH
CH3CH2CH2CH2CH2OH
Nomenclatura degli alcoli
Il gruppo OH è il gruppo funzionale principale.
• Utilizzare il nome dell’idrocarburo, e sostituire l’ultima lettera –o
con –olo.
• Il carbonio che porta l’ossidrile deve avere il numero più basso.
• Indicare la posizione dell’ossidrile sulla catena principale.
• Identificare e numerare ogni catena laterale o sostituente
1
Nomenclatura degli alcoli
alcoli primari
H H
H
H H H
H C OH
H C C OH
H C C C OH
H
metanolo
H H
etanolo
H H H
1-propanolo
alcole metilico
alcole etilico
alcole n-propilico
H H H
CH3
H C C C H
CH2
alcole
H O H
secondario
H
2-propanolo
alcole isopropilico
alcole
terziario
H3C C CH3
OH
2-metil-2-butanolo
1
alcole isobutilico terziario
Polialcoli
H
H
H C OH
H C OH
H C OH
H C OH
H C OH
H
H
1,2-etandiolo
glicole etilenico
1,2,3-propantriolo
glicerolo
Il glicole etilenico è usato
come anticongelante grazie al
suo basso punto di
congelamento. -13 °C
1
Alcoli
1
COS’E’ L’ALCOL?
L’alcol è una sostanza
tossica, (molecola
volatile) potenzialmente
cancerogena e con una
capacità di indurre
dipendenza superiore alle
sostanze o droghe illegali
più conosciute
1
L’alcol cosa combina?
Prima: L’alcol deprime il sistema nervoso centrale, anche se
provoca euforia, disinibizione, perdita
dell’auto…controllo!!...
Poi: L’individuo diventa malinconico, depresso…
Intossicazione acuta!!!
E’ la classica sbornia, conseguenza di un uso episodico ed
eccessivo di bevande alcoliche
Dura al massimo 12 ore anche a seconda del tipo di bevanda,
della rapidità di assunzione, dei cibi ingeriti…
1
Effetti dell’alcol
….dipendono dalla concentrazione di alcol nel
sangue (alcolemia)
0,5 – 1%: EUFORIA… minor concentrazione,
movimenti più incerti, maggiore tempo di reazione,
instabilità emotiva…
1,5%: EBBREZZA (“Brillo”)… rossore, aumenta la
frequenza del respiro e dei palpiti, loquacità,
confusione mentale…
2%: UBRIACHEZZA… incoerenza, mancanza di
autocritica, incoordinazione motoria, insensibilità al
dolore…
3%: UBRIACHEZZA GRAVE… visione doppia,
rallentamento grave dei riflessi, grave
incoordinazione motoria, confusione mentale…
4%: COMA… perdita duratura della coscienza, assenza
di sensibilità e dei riflessi…
1
5%: PERICOLO DI MORTE…
Cosa può causare l’alcol?
Crea un senso di
benessere e di sicurezza
si sopravvaluta le
proprie capacità con un
alcolemia di solo 0,2gr/lt
Riduce il tempo di
reazione (coordinazione
dei movimenti)
con un alcolemia di
0,7gr/l
1
E’ vero che l’alcol protegge
dal freddo?
In realtà continuando a bere si ottiene il
risultato opposto, cioè una capacità
ridotta dell’organismo a sopportare il
freddo. Infatti la cute calda disperde più
facilmente calore così che il corpo
progressivamente riduce la sua
temperatura.
Il meccanismo fisiologico di
protezione dal freddo è una
vasocostrizione a livello cutaneo
1
Caratteristiche
deducibili dalla
struttura
L’immagine mostra il potenziale elettrostatico
del metanolo. Più rossa è un area, maggiore
è la densità elettronica; più blu è un area,
minore è la densità elettronica.
H
H C OH
H
δO
H
δ+
1
•L’atomo di ossigeno mostra una regione
ad alta densità elettronica (rosso) dovuta
alla presenza di due doppietti elettronici
solitari.
•Gli atomi di ossigeno alcolisi sono basi di
Lewis.
•Quindi gli alcoli possono comportarsi sia
come basi che come nucleofili.
•L’atomo di idrogeno della funzione
alcolica mostra una bassa densità
elettronica (blu), quindi ha carattere
acido.
•Quindi gli alcoli sono acidi (pKa ~ 16).
•La dissociazione di un protone genera un
alcossido.
•Il gruppo –OH è un cattivo gruppo
uscente e deve essere convertito in un
buon gruppo uscente perché si possa
avere una reazione di sostituzione o di
eliminazione.
Legami idrogeno tra molecole di alcoli
Poiché l’ossigeno è molto più elettronegativo del C e dell’H, i legami
C-O e O-H sono polari. La polarità del legame O-H porta alla
formazione di legami idrogeno tra le molecole di alcol, il che ha
come conseguenza l’alto punto di ebollizione tipico degli alcoli. La
solubilità in acqua dei termini a basso peso molecolare e di quelli
più complessi che presentano vari ossidrili (dioli, trioli, … polioli), è
riconducibile anch’essa alla formazione di legami idrogeno. Queste
proprietà rendono gli alcoli buoni solventi
per svariate reazioni.
1
1
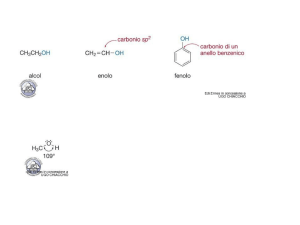
Alcoli: il fenolo
Il fenolo è il capostipite degli alcoli aromatici a cui dà il nome (fenoli).
1
Teorie acido-base
Acidi e basi secondo Brönsted e Lowry
Un acido è una qualsiasi molecola o ione in grado di
donare protoni.
Una base è una qualsiasi molecola o ione che può
accettare un protone.
HCl(g)+ H2O(l) H3O+(aq)+ Cl-(aq)
NH3(l) + H2O(l) NH4+(aq)+ OH-(aq)
1
acido
base
Acidi e basi secondo Brönsted e Lowry
HCl(g) H+(aq)+ Cl-(aq)
NH3(l) NH4+(aq)+ OH-(aq)
acido
base
Quando un acido cede H+ si trasforma nella sua base coniugata, e
analogamente quando una base acquista H+ genera il suo acido
coniugato; ad esempio, Cl- è la base coniugata di HCl ( e
viceversa) e NH4+ l’acido coniugato di NH3 (e viceversa).
Secondo questa definizione
Una reazione acido base è la conseguenza di uno scambio di un
protone
HA + B A- + HB+
tra due coppie “coniugate” acido base
HA è l’acido coniugato della base AB è la base coniugata dell’ acido1 HB+
Acidi e basi secondo Lewis
Un acido è una specie (molecola o ione) che può
accettare una coppia di elettroni.
Una base è una specie (molecola o ione) capace
di donare una coppia di elettroni liberi da legami.
F
F
H
B
+ :N
F
H
Acido
Base
H
F
1
F
H
B
:N
F
H
H
Complesso di coordinazione
Acidità in Alcoli e Fenoli
Alcoli e fenoli sono acidi deboli in quanto l’ossidrile è in
grado di cedere il protone dando luogo, analogamente
all’acqua, ad uno ione alcossido:
(ROH
RO- + H+ )
Quando si allunga la catena di atomi di C e negli
alcoli soggetti a ingombro sterico come l’alcol tbutilico, diminuisce l’acidità a causa appunto
dell’ingombro sterico che rende difficile la
solvatazione dei corrispondenti ioni alcossido.
1
1
Acidità in Alcoli e Fenoli
I fenoli sono molto più acidi degli alcoli: lo ione fenossido viene
stabilizzato dalla risonanza con delocalizzazione della carica negativa
nelle posizioni orto e para dell’anello.
Questa maggiore stabilità sposta la reazione verso destra ovvero
verso la formazione degli ioni fenossido con conseguente maggiore
acidità dei fenoli rispetto agli alcoli.
Se, l’anello del fenolo è sostituito con alogeni (più elettronegativi
dell’O) la acidità aumenta per la presenza di una parziale carica
negativa sull’alogeno e parziale
1 carica positiva del carbonio.
25
Acidità in Alcoli e Fenoli
_
H
H
H
C
C
H
C
_
F
_
H
H
F
O
Ione etossido
_
+
H
C
_
F
O
Ione 2,2,2-trifluoroetossido
Negli alcoli fluoroderivati la polarizzazione della molecola,
dovuta alla forte elettronegatività del fluoro, porta ad una
delocalizzazione della carica negativa (-) sul fluoro con
parziale carica positiva (+) sul C, quindi ad una
polarizzazione del legame CF. il 2,2,2-trifluoroetanolo è
circa 3000 volte più acido dell’etanolo.
In questo modo la carica - dell’O viene parzialmente
neutralizzata dalla carica + del C stabilizzando così l’anione.
Questo fenomeno prende il nome di “Effetto Induttivo”.
1
Acidità in Alcoli e Fenoli
L’effetto visto con il fluoro è estendibile a tutti i gruppi elettronattrattori che, stabilizzando la base coniugata di un acido, spostano la
reazione verso destra provocando un aumento della acidità.
Gli alcoli possono comportarsi anche come basi deboli, in quanto
possiedono dei doppietti elettronici non condivisi sull'ossigeno e sono
quindi Basi di Lewis. Vengono protonati dagli acidi forti secondo la
reazione:
ROH
+
H+
1
[ROH]+
H
Ione alchilossonio
IONE FENOSSIDO
NaOH NON TRASFORMA UN ALCOL NEL CORRISPONDENTE
IONE ALCOSSIDO, IN QUANTO GLI ALCOSSIDI SONO BASI
PIÙ FORTI DELL'IDROSSIDO.
LA REAZIONE PROCEDE IN SENSO INVERSO.
NaOH TRASFORMA I FENOLI IN IONI FENOSSIDO, POICHE’
SONO BASI MENO FORTI.
1
Con Metalli Alcalini
Sia gli alcoli che i fenoli reagiscono con i metalli
alcalini dando, alcolati e fenati.
Queste non sono reazioni acido-base ma reazioni
redox.
2 CH3OH
2 Na
2
2 Na
2 CH3O Na
2
H2
O
O
H
Na
1
H2
1
1
Reazione di un alcol primario con acido alogenidrico
Una SN2
Unico stadio: meccanismo concertato
Cl+
R
R
R
Cl
+
+
R
Cl
R
H C H
H+
Cl
R
H C H
Cl-
O
O
H
H
H
1
R
H C H
O
H
H
H2O
Cl
H C R
H
Reazione di un alcol terziario con acido alogenidrico
L’alcol
terziario protonato perde una molecola di acqua
formando un carbocatione terziario sp2 che può essere
attaccato dallo ione cloruro da un lato del piano di ibridazione
oppure dall’altro lato.
Due stadi: di cui il primo lento e il secondo veloce
R1
R2
R3
La sostituzione nucleofila è SN1
+
R1
R1
R
R3 2 +
R
R C OH
R
R3
R
H+
R C
H2O
R
1
R2
+
+
Cl-
R1
R1
+
2 Cl
Cl R2 R3 RR
3
Cl-
R
R C Cl
R
REAZIONE DI DISIDRATAZIONE
E’ L’INVERSO DELLA IDRATAZIONE DEGLI ALCHENI
È UNA ELIMINAZIONE E PUO’ AVVENIRE CON
MECCANISMO E1 O E2.
LA REAZIONE INIZIA CON LA PROTONAZIONE
DELL’OSSIDRILE OH CHE AGISCE COME BASE
LA FACILITÀ È NELL’ORDINE 3° > 2° > 1°
I FENOLI NON DANNO ELIMINAZIONE E
SOSTITUZIONE
1
ELIMINAZIONE 1 (E1,alcoli terziari)
1. Attacco elettrofilo
2. Disidratazione
3. Riarrangiamento e
perdita di un protone
1
ELIMINAZIONE 1
A VOLTE UN ALCOL PUÒ DARE DUE O PIÙ ALCHENI, PERCHÉ
IL PROTONE CHE ABBANDONA LA MOLECOLA DI ALCOL
DURANTE LA DISIDRATAZIONE PUÒ VENIRE DA QUALSIASI
ATOMO DI CARBONIO ADIACENTE A QUELLO LEGATO AL
GRUPPO OSSIDRILE.
DAL 2-METIL-2-BUTANOLO, AD ESEMPIO, SI POSSONO FORMARE DUE
ALCHENI:
1
ELIMINAZIONE 2 (E2, alcoli primari)
1.
2.
1
OSSIDAZIONE
GLI ALCOLI PRIMARI DANNO ALDEIDI E AD ACIDI
CARBOSSILICI
QUELLI SECONDARI DANNO CHETONI
1
Tasso alcolemico
La variazione di colore dello ione dicromato nella
reazione di ossidazione degli alcoli (e delle aldeidi)
viene sfruttata nell’esame estemporaneo del tasso
di etanolo nell’alito (test del palloncino)
OH
H
C
H
H
C
H
H
etanolo
Ione dicromato
(rosso-arancio)
Cr O -- (H+)
2 7
Cr+++
Ione cromo
(verde)
Alcol etilico
O
H
C
C
H
H
H
etanale
Aldeide acetica
1
Le Reazioni dei Fenoli: La Sostituzione Elettrofila Aromatica
OH
R+
+
X
Fenolo
OH
OH
NO2+
SO3
Br
CH3
Alogenazione
Alchilazione
OH
OH
NO2
SO3H
Nitrazione
Solfonazione
1
L’OSSIDAZIONE DEI FENOLI
I FENOLI SI OSSIDANO CON FACILITÀ.
• CAMPIONI DI FENOLI CHE RESTANO ESPOSTI ALL'ARIA, COL
TEMPO DIVENTANO MOLTO SCURI.
• NEL CASO DELL'IDROCHINONE (1,4-DIIDROSSIBENZENE) LA
REAZIONE PUÒ ESSERE FACILMENTE CONTROLLATA PER
OTTENERE
1,4-BENZOCHINONE (DETTO COMUNEMENTE CHINONE)
1
ETERI
gruppo etere
lone pairs
C
sp3 O
C
sp3
sp3
R–O–R
Gli eteri sono molecole si
comportano
da
solventi
polari
aprotici
(mancano
atomi di idrogeno disponibili
a formare ponti ad H).
1
1
Per condensazione in
ambiente acido
(ad es. H2SO4)
di due molecole di
etanolo
si ottiene un etere
(La reazione decorre con
meccanismo SN2)
CH3
CH3
C
C
H OHH
2
H OHH
H+
1a fase: Protonazione dell’alcol
2a fase: Sostituzione
nucleofila
CH3
C
H OHH
H2O
C
H OHH
CH3
H
C
H OHH
2
CH3
CH3
1
C
H
CH3
H+
C
H OH
H
C
H
CH3
dietiletere
(o etere etilico)
Gli eteri devono essere considerati basi di Lewis: in ambien
te acquoso acido sono facilmente protonati ed idrolizzati
H
H
R
C
RH
C
H+
H
protonazione
H O
C H
H
R
O
C H
H
R
H
H
R
C
H
H
R
C
H O
C H
H
R
O
H2O
H
H
+
H O
C H
1 H
R
H+
RH
C
H
O
H
idrolisi
TIOLI (mercaptani)
gruppo sulfidrilico
lone pairs
S
C
R - SH
H
sp3
sp3
Non può fare legami
idrogeno
La polarità è minore.
S è un buon ligante di
metalli
Forma disolfuri
1
Reazione redox
Tioli liberi
Ossidazione
- 2H
Riduzione
+ 2H
Ponte disolfuro
1
Esercizi
1
Si spieghi perché:
a) il propanolo bolle a una temperatura più elevata del
corrispondente idrocarburo
b)il propanolo, diversamente dal propano o dal butano, è
solubile in acqua
c)il n-esanolo non è solubile in acqua
d)l’etere dimetilico e l’alcol etilico hanno lo stesso peso
molecolare, ma l’etere dimetilico ha un punto di
ebollizione più basso(-24°C) rispetto all’alcol etilico
(78°C)
e) in confronto al toluene, il fenolo ha un punto di ebollizione
più elevato ed è più solubile in acqua
1
Proponi una via di sintesi
a) del 3-metil-1-butanolo a partire dal
(CH3)2CHCH=CH2.
b) dell’1-butanolo da un alchene
1