UNIVERSITA’ DEGLI STUDI DI PARMA
DIPARTIMENTO DI SCIENZE CHIRURGICHE
CLINICA CHIRURGICA E TRAPIANTI D’ORGANO
Direttore: Prof. M. Sianesi
GIST: RAZIONALE DELLE ATTUALI TERAPIE
Prof. Mario Sianesi
GIST
Considerazioni
• Cosa sono
• Dove si localizzano
• Quali i sintomi
• Quale l’iter diagnostico
• Diagnosi differenziale
• Terapia ablativa : Quale, come, quando
• Terapia farmacologica : Quale, quando
• Quale Follow-up
GIST
GASTROINTESTINAL STROMAL TUMORS
• Prima del 1983 : “TUMORI INTESTINALI DI NATURA
MESENCHIMALE”
• 1983 MAZUR e CLARK
GIST : “GRUPPO ETEROGENEO
DI NEOPLASIE CARATTERIZZATE
DA UN ELEMENTO ISTOLOGICO
COMUNE, LA PROLIFERAZIONE
DI CELLULE FUSATE”
Nuove problematiche : istogenetiche, nosografiche,
terapeutiche, prognostiche.
• 1988 MIETTINEN
• 1996 SUSTER
LEIOMIOMA TIPICO :
“COMPLETA DIFFERENZIAZIONE”
Primo schema classificativo (4 sottogruppi)
GIST
SCHEMA CLASSIFICATIVO
1. NEOPLASIE DIFFERENZIATE VERSO ELEMENTI
MUSCOLARI LISCI
Marker positivi per : - ACTINA MUSCOLO LISCIO
- DESMINA
2. NEOPLASIE DIFFERENZIATE VERSO ELEMENTI NERVOSI
Marker positivi per : - ENOLASI NEURONOSPECIFICA (NSE)
- PROTEINA S-100
3. NEOPLASIE DIFFERENZIATE VERSO ELEMENTI MISTI
4. NEOPLASIE SENZA ALCUNA DIFFERENZIAZIONE
GIST
GIST
GASTROINTESTINAL STROMAL TUMORS
“GRUPPO ETEROGENEO DI
NEOPLASIE NON EPITELIALI, A
ORIGINE DALLA PARETE DEL
TRATTO GASTROINTESTINALE,
DALL’OMENTO, DAL MESENTERE,
DAL RETROPERITONEO”
GIST
GASTROINTESTINAL STROMAL TUMORS
ORIGINANO TRA LA MUSCOLARIS MUCOSAE E
LA TONACA MUSCOLARE PROPRIA
SUL PIANO ISTOLOGICO SI CARATTERIZZANO
PER UNA PROLIFERAZIONE DI CELLULE
IMMATURE, EPITELIODI (20%), FUSATE (70%) O
MISTE (10%),CON DIFFERENZIAZIONE MIOIDE O
NEURALE PARZIALE O INCOMPLETA
IDENTIFICAZIONE RECENTE DI FORME CON ASPETTI
DIFFERENZIATIVI VERSO LE CELLULE INTERSTIZIALI DI
CAJAL
CELLULE DI CAJAL
Controllano la motilità intestinale con
funzioni di pace-maker, mediatrici della
trasmissione nervosa enterica. Ritenute a
lungo di origine nervosa, sembrano
invece cellule muscolari specializzate,
localizzate tra le strutture nervose del
sistema autonomo e le strutture
muscolari della parete intestinale.
GIST
NEOPLASIE SENZA ALCUNA DIFFERENZIAZIONE
MARKER positivo per C-kit (CD 117) (recettore con funzione
(90-95%)
di tirosin-kinasi transmembrana)
MARKER positivo per CD34 (antigene di superficie della
(60-65%)
cellula staminale emopoietica)
GIST : origina da una cellula staminale, differenziatasi verso un
fenotipo ICC
Le cellule di Cajal esprimono il kit protoncogene
che codifica per il C-Kit (CD 117)
Mutazioni degli esoni 13 / 17 (2%) , 9 (10%) e soprattutto dell’esone
11 (70%) del protoncogene che codifica per il C-kit
trasformazione neoplastica
GIST
digiuno
esofago
cellule
schenoidi
aspetti epitelioidi
aspetti fusati
(70%)
(20%)
C-Kit +
Stomaco
Leiomioma
Schwannoma
(actina muscolo liscio +)
(S-100+)
GIST
• 1% delle NEOPLASIE MALIGNE
• Tumori mesenchimali più frequenti nel tratto gastroenterico
• 15 casi x 1.000.000 di abitanti
• Età > 40-50 anni
• Sede : STOMACO - (DUODENO)
50-60%
I. TENUE
25-30%
ESOFAGO
< 5%
RETTO/COLON
5%
EXTRAINTESTINALE
5%
• Associazione con altri tumori
• Associazione con condroma polmonare, paraganglioma
extrasurrenale (TRIADE DI CARNEY)
GIST
SINTOMATOLOGIA
Del tutto aspecifica !!
Ø < 2 cm. : asintomatici (30%)
Ø > 5 cm. : generalmente sintomatici (da 4-6 mesi)
EMORRAGIA
(50%)
DOLORE
(20-50%)
OCCLUSIONE
(10-30%)
ULCERAZIONE
PERFORAZIONE
ACCRESCIMENTO generalmente ESOFITICO
GIST
Diagnosi
EGDS – Ecoendoscopia – TC
ESOFAGO
STOMACO
Ecografia
EGDS – Ecoendoscopia – TC
DUODENO
Ecografia
EGDS – Ecoendoscopia – TC
INTESTINO TENUE
Ecografia - RX clisma tenue - VideocapsulaArteriografia selettiva
Colonscopia – Ecoendoscopia – RM
Retto- Colon
Extraintestinale
TC / RM
Prognosi – Follow-up
PET
Biopsia
– TC
:
Endoscopica
Eco / TC guidata
Quando obbligatoria ?
Sedi particolari
Malattia localmente avanzata
Metastasi epatiche
GIST
CLASSIFICAZIONE MOLECOLARE
• Kit positivi alla immunoistochimica
per CD 117 (95 %)
SPORADICI
• Kit negativi alla immunoistochimica
per CD 117
• Mutazioni del gene PDGFRA
(“platelet derived growth factor receptor alfa polypeptide)
FAMILIARI
Generalmente “Wild type genotype”
PEDIATRICI
(5 %)
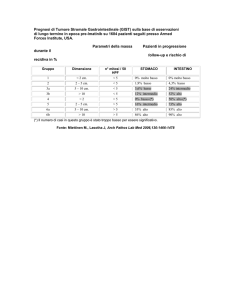
CATEGORIE DI RISCHIO
Consensus Conference Bethesda, 2001
Dimensioni (cm)
<2
2-5
<5
5-10
>5
Rischio molto basso
Rischio basso
Rischio intermedio
Rischio elevato
Rischio molto elevato
>10
qualsiasi dimensione
Indice mitotico
<5/50 HPF
<5/50 HPF
6-10/50 HPF
<5/50 HPF
>5/50 HPF
qualsiasi indice mitotico
>10/50 HPF
• Sede: Stomaco
Più Favorevole?
• Età:
Più Favorevole?
< 40 aa
• Esordio Clinico in Urgenza
Più Sfavorevole?
• Fenotipo: Forme Epitelioidi
Più Sfavorevole?
• Mancata preservazione capsula
Più Sfavorevole?
Grading :
Attualmente non definito
GIST
TERAPIA
RESECABILE
LOCALMENTE AVANZATO
METASTATICO
Di piccole dimensioni, in sedi particolari: valutazione da caso a caso!!
GIST
DIAGNOSI DIFFERENZIALE
• Tumori di origine muscolare
• Tumori di origine nervosa
• Altri tumori mesenchimali
• Linfomi
• Fibromatosi mesenteriale
• Carcinoide
• Tumori metastatici
• Carcinoma del tenue
Benigni / Maligni
GIST TERAPIA
Resecabile
• Asportazione Endoscopica : Suturatrice Endoscopica
Ø < 20-22 mm-
: TEM
• Wedge Resection laparoscopica (o resezione cuneiforme open)
• Resezione Limitata (minilaparotomica; Videoassistita)
• Resezione Ampia (associazione con altre neoplasie)
• Resezione Estesa “en bloc”
Stomaco
Retto
Stomaco
Tenue
“PRESERVAZIONE DELLA CAPSULA”
NO
Radiochemioterapia
NO
Linfoadenectomie estese
Sedi Particolari: esofago- cardias- papilla di Vater- Setto retto vaginale- retto inf.
Follow-up? Biopsie? Terapia neoadiuvante con Imatinib?
SUTURATRICE ENDOSCOPICA
A TUTTO SPESSORE
GIST: IMMAGINE ENDOSCOPICA
GIST GASTRICO: ECOENDOSCOPIA
GIST
MUCOSECTOMIA CIRCONFERENZIALE
EMOCLIPS
MECCANISMO DI SUTURA IN CASO DI PERFORAZIONE
GIST GASTRICO
RGD:Pezzo operatorio (Resezione Open)
GIST: CORPO GASTRICO
WEDGE RESECTION
VIDEOLAPAROSCOPICA
GIST: CORPO GASTRICO
WEDGE RESECTION
VIDEOLAPAROSCOPICA
GIST DIGIUNALE
GIST GASTRICO ULCERATO + EGC CORPO:
GT: pezzo operatorio
GIST GASTRICO INFILTRANTE MESOCOLON
. TRASVERSO: Resezione “En Bloc”
GIST
3° INF. ESOFAGO
GIST PARAVATERIANO EMORRAGICO
GIST PARAVATERIANO EMORRAGICO
GIST DUODENO-DIGIUNALE
Videocapsula
Endoscopia peroperatoria
GIST DUODENO-DIGIUNALE
ECOENDOSCOPIA RETTALE
GIST RETTO
ECOGRAFIA
GIST ISCHIO-RETTALE DESTRO (Ø 4 cm.)
TERAPIA GIST
Localmente avanzato
•
•
•
Biopsia
Caratterizzazione Molecolare
Terapia Neoadiuvante
• Chirurgia radicale
• Rischio ridotto di
Imatinib
400 mg
++++
Imatinib
800 mg
++
Sunitinib
50 mg
+
Altro
( Trials Clinici) +/-
Più conservativa
1) Sanguinamento intraoperatorio
2) Rottura del tumore
• Il 5% dei pazienti verrà operato in Urgenza per complicanze
Risposta Positiva
alla Terapia
o
Continuare indefinitamente
Chirurgia (dopo 6-12 Mesi)
Stazionarietà
Aumentare dose del Farmaco
Chirurgia
Progressione
Chirurgia? Altre Terapie?
Intolleranza
Altre Terapie?
TERAPIA GIST
Metastatico
• Biopsia
• Caratterizzazione molecolare
• Trattamento farmacologico specifico
• Chirurgia
Localizzazioni epatiche/ peritoneali
Asportazione tumore primitivo
CASI SELEZIONATI
Riprendere terapia farmacologica
GIST
Algoritmo Diagnostico - Terapeutico
Malattia Primaria
Malattia Ricorrente
Metastasi
o
non resecabilità
No Metastasi
Imatinib
Studi Clinici:
Nilotinib
Chirurgia
Sorafinib
Dasatinib
Bevacizumab
Risposta o
Stabilizzazione
Progressione
Imatinib post-operatorio
(Adiuvante)
?
Chirurgia
(R0-R1)
Sunitinib / chirurgia /
altre terapie
GIST
Ablazione Chirurgica
Resezione R 0
Follow-up
Resezione R 1
Resezione R 2
• Terapia Farmacol.
•Ri-resezione
• Ri-resezione?
•Terapia Farmacol.
Malattia Metast.
Terapia
Farmacol.
Follow up?
Classe di rischio
Bassa
Marker Sierici:
NON ESISTONO!!
Classe di rischio
Medio Alta / Alta
• Es. Obiettivo
• Es. Ematochimici
Nulla
• Ecografia
• TC/RM/PET
Per 5 anni
1- 2 - 3 anno ogni 3-4 mesi
4 - 5
anno ogni 6 mesi
GIST
Elementi più significativi per il trattamento terapeutico - mirato
• Sede ed implicazioni anatomo-patologiche ed anatomo-chirurgiche
• Diagnosi di GIST
• Attività Biologica
•
Primaria Sensibilità all’Imatinib
•
•
•
Scelta di un dosaggio ottimale
Previsioni di resistenze secondarie
Previsione dell’efficacia del trattamento secondario
GIST
Risposta alla terapia con Imatinib
Genotipo
Percentuale di
Casi
Risposta all’Imatinib
Mutazione dell’esone 11 di C-KIT
65-70%
85%
Mutazione dell’esone 9 di C-KIT
10-12%
45%
Mutazione dell’esone 13 di C-KIT
<5%
Sporadica
Mutazione dell’esone 17 di C-KIT
<5%
Sporadica
Nessuna mutazione di
KIT/PDGFRA
5-10%
Scarsa
GIST
Cause di Progressione della Malattia
(Terapia: Imatinib)
•
•
•
Interruzione / Discontinuità
Mancanza di Compliance / Intolleranza
Livelli subterapeutici del farmaco
5%
• Resistenza Primaria
10%
• Resistenza Secondaria
50% dei casi dopo 2 anni
Progressiva : 20% - anno
Sunitinib
5%
Regressione
60% Stabilizzazione
GIST
IMATINIB :
EFFETTI COLLATERALI
ACUTA : Edema-diarrea-crampi
.
.
muscolari
nausea- rash cutaneo – anemia
tossicità epatica
TOSSICITA’
(moderata / transitoria)
TARDIVA : Mielodepressione
Tossicità renale
Rischio di ripresa di Malattia
Parametri Tumorali
Dimensione
(cm)
GIST
Gastrici
GIST
Ileali
GIST
Duodenali
GIST
Rettali
<2
Nessuno
Nessuno
Nessuno
Nessuno
>2 <5
Molto basso
Basso
Basso
Basso
Basso
Moderato
(24%)
>10
Moderato
(12%)
Elevato
(52%)
Elevato
(34%)
Elevato (57%)
<2
Nessuno
Elevato
(50%)
>2 <5
Moderato
Elevato
(73%)
Elevato
(55%)
Elevato
(85%)
Elevato
(86%)
Elevato
(90%)
>5 <10
>5 <10
>10
Indice mitotico
( HPF)
% dei pazienti in progressione durante follow-up a lungo
termine
< 5/50
> 5 /50
Elevato (54%)
Elevato
(50%)
Elevato
(52%)
Elevato
(86%)
Elevato (71%)
GIST
Sede Primitiva del tumore e mutazioni
Resistenza Secondaria
MUTAZIONE
SEDE DELLA
NEOPLASIA
% Casi
Esone 9 di C-Kit
Piccolo Intestino
11-29%
Stomaco
0,7- 3,2%
Piccolo Intestino
50-58%
Stomaco
56-80%
Esone 11 di C-Kit
PDGFRA
Quasi esclusivamente Stomaco ed Omento (la Max
Parte con morfologia Epitelioide o mista)
GIST
Valutazione Risposta Terapeutica
•
Dimensioni • Aumentate o Stazionarie:
(Degenerazione mixoide/ edema/ emorragia intratumorale)
• Riduzione > 10-15%
•
Densità
• Riduzione U.H. > 15%
> omogeneicità
< vascolarizzazione
•
Aspetto
• Massa Tumorale Ipodensa
• Aspetto Simil-cistico
D.
D.
•
Metabolismo • Riduzione attività metabolica
(non volumetrica)
* Dopo 7-15 gg.
** Dopo 30 gg. o più
TC
TC
Omogenea
TC
Ca Ovaio
Ca Pancreas
Ca Endometrio
Leiomiosarcoma
FDG-PET * / TC **
METASTASI
EPATICA DA
GIST
Controllo 1 mese
dopo il trattamento
con IMATINIB
Controllo 6 mesi
dopo il trattamento
con IMATINIB
< / scomparsa del potenziamento periferico -- aspetto similcistico
dimensioni invariate ma ipodensità omogenea
TAC
TAC prima
di tp
imatinib
TAC dopo
3 mesi di tp
imatinib
PET -FDG
PET prima di
tp imatinib
A
B
A1
B1
PET dopo 3
mesi di tp
imatinib
A-A1 : lesione ipodensa, metabolicamente attiva con U.H. = 50
B-B1 : lesione dopo 3 mesi, con ø >, metab. inattiva, con U.H. = 38
CONTROINDICAZIONI ALLA
CHIRURGIA VIDEOLAPAROSCOPICA
- EXTRAINTESTINALI
- COMPLICATI
GIST
- LOCALMENTE AVANZATI ( NECROSI )
- METASTATICI ( SINCRONI )
- RECIDIVI ( RESECABILI )
GIST
Conclusioni
• Problema estremamente complesso
• Conoscenze in continua evoluzione
• Valutazioni multidisciplinari
AGGIORNAMENTO COSTANTE
RISULTATI MIGLIORI
• FUNZIONALI
• INTERVALLO LIBERO DA MALATTIA
• SOPRAVVIVENZA
Grazie per l’attenzione…
Grazie per l’attenzione…
GIST GASTRICO : pezzo operatorio
Grazie per l’attenzione…
Grazie per l’attenzione…
Grazie per l’attenzione…
Grazie per l’attenzione…
GIST : DIAGNOSI
• EGDS / COLONSCOPIA
• RX PRIME VIE DIGERENTI / RX TUBO DIG.
• RX CLISMA DEL TENUE
• ECOENDOSCOPIA
• VIDEOCAPSULA
• ECOGRAFIA / TAC-SPIRALE / RMN
• ARTERIOGRAFIA
• PET ( prognosi e follow-up ) BIOPSIE ???
GIST
DIAGNOSI
• EGDS / COLONSCOPIA
• RX PRIME VIE DIGERENTI / RX TUBO DIG.
• RX CLISMA DEL TENUE
• ECOENDOSCOPIA
• VIDEOCAPSULA
• ECOGRAFIA / TAC-SPIRALE / RMN
• ARTERIOGRAFIA
• PET
TERAPIA I
GIST
RESECABILE
LOCALMENTE AVANZATO
- Resezione segmentaria
METASTATICO
- Chirurgia iterativa ?
- Wedge resection
- Resezione ampia
- Resezione completa “en bloc”
(extraintestinali)
Sopravvivenza a 5 aa.: 50-55%
NO linfoadenectomie (estese)
Imatinib Mesylate (STI 571)
400 mg/die
(inibitore competitivo dell’attività
tirosin-chinasica del c-kit)
NO radiochemioterapia
TERAPIA II
GIST
DOSE ( OTTIMALE )
• 400 mg/die
• 800 mg/die -resistenza secondaria
-mutazioni esoni 9-18
CORRELAZIONE con lo stato MUTAZIONALE della neoplasia :
(GENI : Kit – PDGFRA)
- mutazione dell’esone 11 di Kit : risposta pos. = 83.5%
- mutazione dell’esone 9 di Kit : risposta pos. = 47.8%
- mutazione di Kit –PDGFRA assente : risposta pos. = 0%
3-12 mesi
DURATA
Indefinitamente ( metastatico )
TERAPIA III
GIST
ADIUVANTE
A tutt’oggi sperimentale
Pz a rischio ricaduta > 50%
NEOADIUVANTE
Retto – Esofago
Citoriduzione
conservazione
funzionalità d’organo
VALUTAZIONE RISPOSTA TERAPEUTICA
I
• DIMENSIONI
< / = / > (degenerazione mixoide; edema;
emorragia intratumorale)
• DENSITA’
< vascolarizzazione
< densità TC - con > omogeneicità
• ASPETTO
Massa tumorale da ipodensa ad omogenea
Aspetto simil-cistico
D.D. con CA. OVAIO, PANCREAS,
ENDOMETRIO E LEIOMIOSARCOMA
Riduzione attività
• METABOLISMO PET con FDG*
metabolica (non
* FDG: 18-Fluoro 2 Deossi-Glucosio
volumetrica -TC)
VALUTAZIONE RISPOSTA TERAPEUTICA
TC
( DOPO > 30 gg.)
•
+
PET con FDG
(DOPO 7 gg.)
Riduzione dimensioni : > 10%
• Riduzione densità (U.H.) : > 15%
II
QUANTIFICAZIONE RISPOSTA TERAPEUTICA
SUV ( STANDARD UPTAKE VALUES )
• RISPOSTA PARZIALE : < FDG – SUV
> 25%
• MALATTIA STAZIONARIA : < FDG – SUV
< 25%
• PROGRESSIONE MALATTIA : > FDG – SUV > 25%
lesione principale o
nuove lesioni
• RISPOSTA COMPLETA : FDG – SUV equivalente ai
livelli di fondo
GIST : FOLLOW UP
ESAMI EMATOCHIMICI- ECOGRAFICI- ENDOSCOPICI TC – RMN – PET ogni 3 –6 mesi per 5 anni
RECIDIVA - PROGRESSIONE
• Ablazione chirurgica
• Ablazione non chirurgica
• Aumento dose IMATINIB da 400 mg a 800mg
• Utilizzo SUNITINIB (SU 11248) 50 mg/die
( inibitore multichinasico con tossicità medio/alta)
Impiego nei pz con mutazione ESONE 9 di Kit ;
nei pz con resistenza secondaria all’IMATINIB
Risposte parziali : 10% ; Stazionarietà : 60%
• Utilizzo di EVEROLIMUS (RAD 001)
???